1 . 我国的冶金工业十分发达,钢铁年产量已达到十亿吨,占世界产量的一半以上,同时有色金属产量也超过了七千万吨。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为___________ 。
(2)铝与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ ;铝的化学性质较活泼,但在空气中不会完全锈蚀,其原因是___________ 。
(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为___________ ,当有 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为___________ 。
②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为___________ 。在碱性的废电解液中通入氯气可以将 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为___________ 。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为
(2)铝与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性
 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的
 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
您最近一年使用:0次
2 . 铁是地壳中占比较高的元素,其化合物在自然界十分常见。
(1)某铁原子可表示为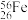 ,其核内中子数是
,其核内中子数是___________ 。
(2)将一个铁球打磨、烧红后放入充满水蒸气的容器中,则发生反应的化学方程式为___________ ;设阿伏加德罗常数的值为 ,当参与反应的
,当参与反应的 的物质的量为
的物质的量为 时,转移的电子数为
时,转移的电子数为___________ 。
(3)服用乳酸亚铁咀嚼片可以缓解缺铁性贫血的症状,其在长期贮存过程中可能因氧化而发生变质,现取少量药片碾碎、溶解、过滤,取滤液加入___________ 溶液并振荡,若滤液变为红色,则药品已变质。
(4)现有甲、乙、丙三名同学分别进行制备 胶体的实验。甲同学向
胶体的实验。甲同学向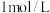 氯化铁溶液中滴入少量的
氯化铁溶液中滴入少量的 溶液;乙同学向
溶液;乙同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液;丙同学直接加热
饱和溶液;丙同学直接加热 饱和
饱和 溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。
溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。
①操作正确的同学是___________ 。
②写出制备胶体过程中的离子方程式___________ 。欲除去胶体中混有的 杂质,可以采取的操作方法是
杂质,可以采取的操作方法是___________ 。
③丁同学向所得胶体中逐滴滴加稀硫酸,实验现象为___________ 。
(1)某铁原子可表示为
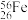 ,其核内中子数是
,其核内中子数是(2)将一个铁球打磨、烧红后放入充满水蒸气的容器中,则发生反应的化学方程式为
 ,当参与反应的
,当参与反应的 的物质的量为
的物质的量为 时,转移的电子数为
时,转移的电子数为(3)服用乳酸亚铁咀嚼片可以缓解缺铁性贫血的症状,其在长期贮存过程中可能因氧化而发生变质,现取少量药片碾碎、溶解、过滤,取滤液加入
(4)现有甲、乙、丙三名同学分别进行制备
 胶体的实验。甲同学向
胶体的实验。甲同学向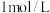 氯化铁溶液中滴入少量的
氯化铁溶液中滴入少量的 溶液;乙同学向
溶液;乙同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液;丙同学直接加热
饱和溶液;丙同学直接加热 饱和
饱和 溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。
溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。①操作正确的同学是
②写出制备胶体过程中的离子方程式
 杂质,可以采取的操作方法是
杂质,可以采取的操作方法是③丁同学向所得胶体中逐滴滴加稀硫酸,实验现象为
您最近一年使用:0次
3 . 下列说法正确的是
| A.水的沸点高于硫化氢,这是由于水分子间存在氢键这种化学键 |
B.将氯气通入碘化钾溶液,可以生成碘单质,说明还原性: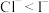 |
C.化学反应 是放热的氧化还原反应 是放热的氧化还原反应 |
D.核素 和 和 互为同位素,单质 互为同位素,单质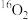 与 与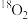 互为同素异形体 互为同素异形体 |
您最近一年使用:0次
解题方法
4 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、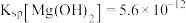 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、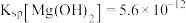 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
180次组卷
|
3卷引用:内蒙古自治区赤峰第四中学2023-2024学年高三下学期开学考试理综试题-高中化学
5 . 强氧化剂一般用来进行消毒、漂白等工序。回答下列问题:
(1)臭氧可以通过氧气在放电条件下生成,上述两种单质都是氧元素的_______ 。
(2)1984年,北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,后更名为“84消毒液”。该消毒液可用氯气与氢氧化钠溶液在常温下反应制得,发生反应的离子方程式为_______ 。如果在某次反应中,有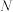 个氯气分子参与此反应,则过程中转移的电子数为
个氯气分子参与此反应,则过程中转移的电子数为_______ 。
(3)漂粉精中的有效成分为_______ ,其进行焰色试验的特征颜色为_______ (填标号)。
a.黄色 b.砖红色 c.绿色 d.紫红色
(4)新型的消毒剂 在中性溶液中可将剧毒的
在中性溶液中可将剧毒的 氧化为两种无毒的气体,自身被还原为
氧化为两种无毒的气体,自身被还原为 ,则发生反应的离子方程式为
,则发生反应的离子方程式为_______ ;“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是“分别在氧化还原反应中得到等量的电子时, 与该种含氯消毒剂的质量比”,则
与该种含氯消毒剂的质量比”,则 的有效氯含量为
的有效氯含量为_______ (结果保留两位小数)。
(1)臭氧可以通过氧气在放电条件下生成,上述两种单质都是氧元素的
(2)1984年,北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,后更名为“84消毒液”。该消毒液可用氯气与氢氧化钠溶液在常温下反应制得,发生反应的离子方程式为
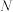 个氯气分子参与此反应,则过程中转移的电子数为
个氯气分子参与此反应,则过程中转移的电子数为(3)漂粉精中的有效成分为
a.黄色 b.砖红色 c.绿色 d.紫红色
(4)新型的消毒剂
 在中性溶液中可将剧毒的
在中性溶液中可将剧毒的 氧化为两种无毒的气体,自身被还原为
氧化为两种无毒的气体,自身被还原为 ,则发生反应的离子方程式为
,则发生反应的离子方程式为 与该种含氯消毒剂的质量比”,则
与该种含氯消毒剂的质量比”,则 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
名校
解题方法
6 . “雨过天晴云破处”“千峰碧波翠色来”描写了汝窑青瓷之美,青瓷在瓷化过程中发生反应:FeCO3+O2→Fe2O3+CO2(未配平),配平后CO2的计量数为
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
解题方法
7 . 在化学活动周中,某校兴趣小组的同学在老师指导下探究铁元素相关物质的性质。回答下列问题:
(1)实验室现有一瓶 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式_______ 。为了证明制得的红褐色液体属于胶体,可以使用的方法是_______ ;乙同学将少量钠单质投入氯化铁溶液中制得铁单质,请评价这一实验方案的可行性_______ (若可行,请写出发生反应的离子方程式,若不可行,请说明理由)。
(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置 是实验室用草酸
是实验室用草酸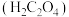 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
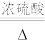
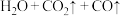 。
。
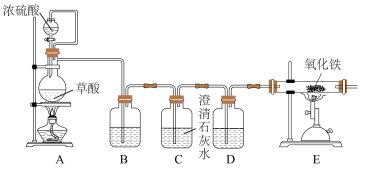
①装置B中盛放的药品为_______ ,装置D的作用为_______ 。
②在实验开始前,应先打开装置_______ (选填“A”或“E”)中的加热装置。写出装置 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移_______ ,其中氧化产物与还原产物的质量比为_______ 。
③该装置的主要缺陷是_______ 。
(1)实验室现有一瓶
 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置
 是实验室用草酸
是实验室用草酸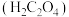 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
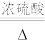
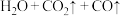 。
。
①装置B中盛放的药品为
②在实验开始前,应先打开装置
 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移③该装置的主要缺陷是
您最近一年使用:0次
名校
解题方法
8 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
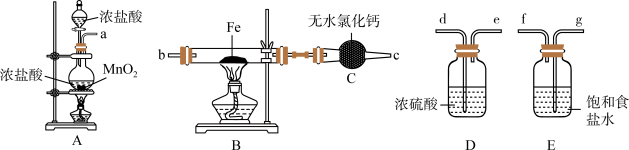
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
79次组卷
|
2卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一上学期期末考试化学试题
9 . 二氯化二硫 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为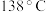 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
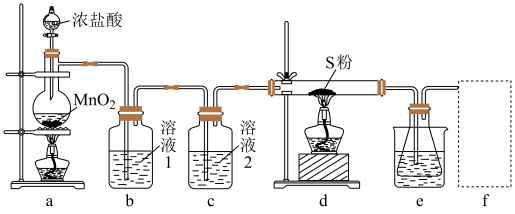
回答下列问题:
(1)装置b用于吸收 ,则溶液1为
,则溶液1为_______ ;溶液2的作用为_______ 。
(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为_______ ,当_______ (描述现象)时,点燃d处酒精灯。
(3)e中大烧杯装有冰水,作用是_______ ;f可以选用_______ (填标号)装置。
(4) (
( 中S为
中S为 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为_______ ,反应中每转移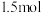 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为_______  。
。
 常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。
常用作杀虫剂、萃取剂以及橡胶的低温硫化剂等。 沸点为
沸点为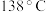 ,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成
,遇水会发生化学反应。二氯化二硫具有很高的化学反应活性,能被金属还原生成氯化物和硫化物,向熔融的硫中通入氯气即可生成 。实验室用S和
。实验室用S和 制备
制备 的装置如图(部分夹持装置已略去)。
的装置如图(部分夹持装置已略去)。
回答下列问题:
(1)装置b用于吸收
 ,则溶液1为
,则溶液1为(2)实验开始时,先点燃a处酒精灯,圆底烧瓶中发生反应的化学方程式为
(3)e中大烧杯装有冰水,作用是

(4)
 (
( 中S为
中S为 价)遇水会生成
价)遇水会生成 、一种强酸和一种淡黄色固体单质,该反应的化学方程式为
、一种强酸和一种淡黄色固体单质,该反应的化学方程式为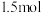 电子,生成的
电子,生成的 在标准状况下的体积为
在标准状况下的体积为 。
。
您最近一年使用:0次
2024-03-01更新
|
143次组卷
|
2卷引用:内蒙古自治区2023-2024学年高一上学期期末教学质量检测化学试题
名校
解题方法
10 . 下列实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向含有淀粉的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 比较 和 和 的氧化性强弱 的氧化性强弱 |
| B | 常温下,用 计测得浓度不同的 计测得浓度不同的 饱和溶液和 饱和溶液和 饱和溶液的 饱和溶液的 | 验证 和 和 的金属性 的金属性 |
| C | 将铁片分别插入 和 和 溶液中 溶液中 | 验证活动性: |
| D | 取一定量未知溶液于试管,滴入 溶液并加热,试管口放置湿润红色石蕊试纸,观察试纸颜色变化 溶液并加热,试管口放置湿润红色石蕊试纸,观察试纸颜色变化 | 检验未知溶液中是否含有铵盐 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-23更新
|
313次组卷
|
4卷引用:2024届内蒙古自治区乌海市第六中学高三下学期第三次模拟考试理综试题-高中化学



