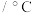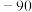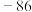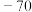名校
解题方法
1 . 废电池粉[锂、铁、磷、铜、铝和碳(碳粉)的质量分数分别为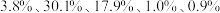 和
和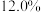 ]回收处理的工艺流程如下:
]回收处理的工艺流程如下: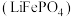 转化为难溶于水
转化为难溶于水 和可溶于水硫酸锂,写出该反应的化学方程式:
和可溶于水硫酸锂,写出该反应的化学方程式:______________ 。哪些途径可以提高转化的效率(写两条):______________ 。
(2)“净化”步骤可以去除滤液中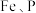 等元素,沉渣1中含
等元素,沉渣1中含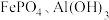 、
、_______ 。沉渣2的主要成分为_______ 。
(3)“电解”可以将溶液中的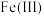 转化为
转化为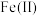 ,溶液中
,溶液中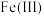 完全转化为
完全转化为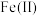 的标志是
的标志是______________ 。甲醇在阳极发生反应生成甲醛,阳极电极反应方程式为_______ 。在电解完成后向溶液中加入 溶液可以将溶液中的
溶液可以将溶液中的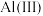 沉淀。
沉淀。
(4)称取一定量的二水磷酸铁,用硝酸溶解后再用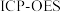 进行分析,得到部分杂质的质量分数
进行分析,得到部分杂质的质量分数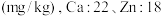 ,评价该制备过程
,评价该制备过程_______ (填“是”或“否”)符合均满足 《电池用磷酸铁》的Ⅱ型标准
《电池用磷酸铁》的Ⅱ型标准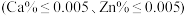 。
。
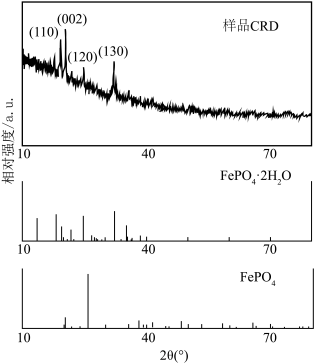
(5) 衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、
衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、 和
和 的标准卡片的
的标准卡片的 衍射实验图谱,结合图像内容判断获的样品
衍射实验图谱,结合图像内容判断获的样品_______ (填“是”或“否”) 。
。
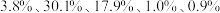 和
和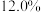 ]回收处理的工艺流程如下:
]回收处理的工艺流程如下: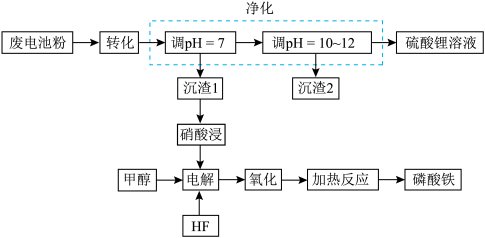
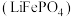 转化为难溶于水
转化为难溶于水 和可溶于水硫酸锂,写出该反应的化学方程式:
和可溶于水硫酸锂,写出该反应的化学方程式:(2)“净化”步骤可以去除滤液中
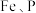 等元素,沉渣1中含
等元素,沉渣1中含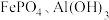 、
、(3)“电解”可以将溶液中的
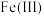 转化为
转化为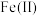 ,溶液中
,溶液中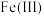 完全转化为
完全转化为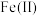 的标志是
的标志是 溶液可以将溶液中的
溶液可以将溶液中的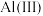 沉淀。
沉淀。(4)称取一定量的二水磷酸铁,用硝酸溶解后再用
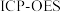 进行分析,得到部分杂质的质量分数
进行分析,得到部分杂质的质量分数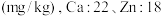 ,评价该制备过程
,评价该制备过程 《电池用磷酸铁》的Ⅱ型标准
《电池用磷酸铁》的Ⅱ型标准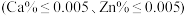 。
。(5)
 衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、
衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、 和
和 的标准卡片的
的标准卡片的 衍射实验图谱,结合图像内容判断获的样品
衍射实验图谱,结合图像内容判断获的样品 。
。
您最近一年使用:0次
解题方法
2 . 硫脲 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为__________ 。
(2)从结构角度分析,硫脲可溶于水的原因是__________ 。
(3)多孔球泡的作用是__________ 。
(4)B中反应完全的标志是__________ 。
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为__________ (填标号)。
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:
取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为__________ 。
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成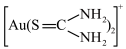 ,反应的离子方程式为
,反应的离子方程式为_______ 。溶解金的过程伴随着溶液变红的现象,原因可能为硫脲发生异构化生成__________ (填化学式)。
 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。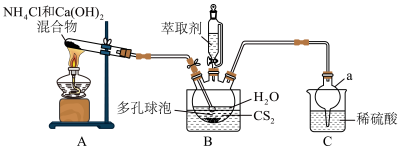
(1)仪器a的名称为
(2)从结构角度分析,硫脲可溶于水的原因是
(3)多孔球泡的作用是
(4)B中反应完全的标志是
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:

取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成
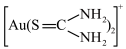 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
3 . 环己酮(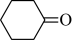 )是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
)是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
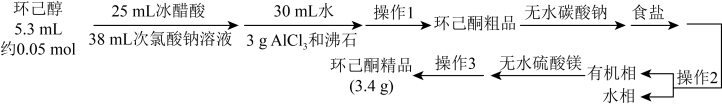
①环己酮的密度比水的密度小,能与水形成恒沸混合物,沸点为95℃。
②31℃时,环己酮在水中的溶解度为2.4 g。
回答下列问题:
(1)环己醇与次氯酸钠溶液反应的离子方程式为
(2)“操作1”和“操作3”是蒸馏,其蒸馏装置中用到的冷凝管是
A.  B.
B.  C.
C. 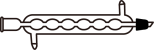
(4)实验中加入无水硫酸镁的目的是
(5)制备环己酮粗品时:
①加入次氯酸钠溶液后,用淀粉-碘化钾试纸检验,试纸应呈蓝色,否则应再补加次氯酸钠溶液,其目的是
②次氯酸钠溶液的浓度可用间接碘量法测定。用移液管移取10.00mL次氯酸钠溶液于500mL容量瓶中,加蒸馏水至刻度线,摇匀后移取25.00mL该溶液于250mL锥形瓶中,加入50mL0.1 mol·L-1盐酸和2g碘化钾,用0.1mol·L-1硫代硫酸钠标准溶液滴定析出的碘。在滴定接近终点时加入1mL0.2%淀粉溶液。析出碘的反应的离子方程式为
(6)本实验环己酮的产率最接近_______(填字母)。
| A.50% | B.60% | C.70% | D.80% |
您最近一年使用:0次
名校
解题方法
4 . 推理是一种重要的科学思维方法,基于下列事实进行的推理正确的是
| 选项 | 事实 | 推理 |
| A | 向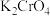 溶液中加浓硫酸,溶液由黄色变橙色 溶液中加浓硫酸,溶液由黄色变橙色 | 向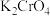 溶液中加浓盐酸,颜色也由黄色变橙色 溶液中加浓盐酸,颜色也由黄色变橙色 |
| B | 向蛋白质溶液中加入饱和 溶液,有固体析出,再加水固体溶解 溶液,有固体析出,再加水固体溶解 | 向蛋白质溶液中加入饱和 溶液,也有固体析出,再加水固体也溶解 溶液,也有固体析出,再加水固体也溶解 |
| C |  的键长小于 的键长小于 的键长 的键长 |  的键能大于 的键能大于 的键能 的键能 |
| D |  是极性分子 是极性分子 |  在四氯化碳中的溶解度小于在水中的溶解度 在四氯化碳中的溶解度小于在水中的溶解度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 高纯 具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯
具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)纯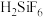 不稳定,易分解为
不稳定,易分解为 和
和___________ ,但其水溶液可以较稳定存在,能完全电离成 和
和 中心原子的配位数为
中心原子的配位数为___________ .
(2)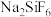 在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为
在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为______________________ .
(3)若没有“干燥”工序,会导致“热分解”产生的 纯度降低,其原因是
纯度降低,其原因是______________________ .
(4)“热分解”工序若采用直接加热分解的方式,会观察到生成的副产品1熔融包裹着未分解的物质,且发现随着时间延长分解效率增加不明显,解释原因______________________ .
(5)“合成”时,为了提升产品纯度,反应温度应该控制在___________  .
.
a.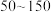 b.
b.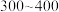 c.
c.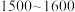
(6)在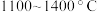 的条件下,将副产品2与
的条件下,将副产品2与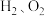 反应,可制得光导纤维的主要成分,反应的化学方程式为
反应,可制得光导纤维的主要成分,反应的化学方程式为______________________ .
 具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯
具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯 的工艺流程如下:
的工艺流程如下: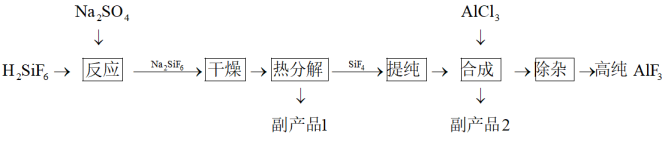
熔点 | 沸点 | 性质 | |
|
|
| 都易水解 |
|
| 57.6 | |
| 1040 | 1537 | |
| 194 | 178(升华) |
(1)纯
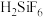 不稳定,易分解为
不稳定,易分解为 和
和 和
和 中心原子的配位数为
中心原子的配位数为(2)
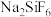 在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为
在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为(3)若没有“干燥”工序,会导致“热分解”产生的
 纯度降低,其原因是
纯度降低,其原因是(4)“热分解”工序若采用直接加热分解的方式,会观察到生成的副产品1熔融包裹着未分解的物质,且发现随着时间延长分解效率增加不明显,解释原因
(5)“合成”时,为了提升产品纯度,反应温度应该控制在
 .
.a.
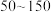 b.
b.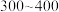 c.
c.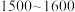
(6)在
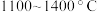 的条件下,将副产品2与
的条件下,将副产品2与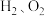 反应,可制得光导纤维的主要成分,反应的化学方程式为
反应,可制得光导纤维的主要成分,反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 钛合金在航空航天领域有着广泛的应用.一种利用废脱硝催化剂(含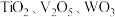 等成分)提取钛的工艺流程如图所示.下列说法错误的是
等成分)提取钛的工艺流程如图所示.下列说法错误的是
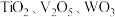 等成分)提取钛的工艺流程如图所示.下列说法错误的是
等成分)提取钛的工艺流程如图所示.下列说法错误的是
A.基态钛的价层电子排布式为 |
| B.上述流程中共涉及到3个氧化还原反应 |
C.高温碱浸生成 的离子方程式为: 的离子方程式为: |
| D.铝热反应制备钒与上述反应中镁冶炼钛的原理相似 |
您最近一年使用:0次
名校
7 . 如今,半导体“硅”已经成为信息时代高科技的代名词,高纯硅是现代信息、半导体和光伏发电等产业的基础材料。制备高纯硅的主要工艺流程如图所示: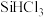 极易水解,反应过程中会产生氢气。
极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒, 的晶体类型为
的晶体类型为________ 。
(2)写出④的化学方程式为________ 。
(3)以上①~⑤的流程中,包含置换反应的是______ (填序号)。整个操作流程都需隔绝空气,原因是________ (答出两条即可)。
(4)氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为____ 。
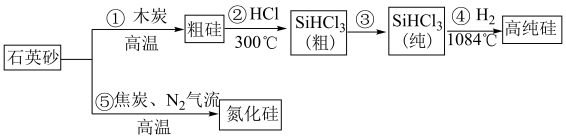
(5)在硅酸盐中,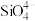 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为_____ ,其化学式为______ 。
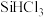 极易水解,反应过程中会产生氢气。
极易水解,反应过程中会产生氢气。回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,
 的晶体类型为
的晶体类型为(2)写出④的化学方程式为
(3)以上①~⑤的流程中,包含置换反应的是
(4)氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为
(5)在硅酸盐中,
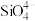 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为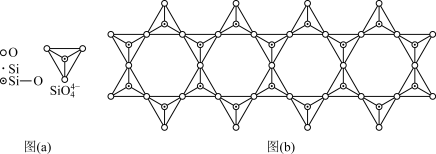
您最近一年使用:0次
名校
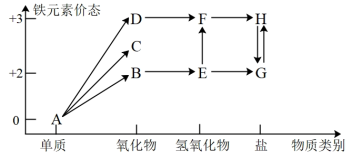
8 . 铁是人类较早使用的金属之一,下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。运用铁及其化合物的知识,回答下列问题。_______ ;E→F反应的化学方程式是_______ ,该反应过程的现象为_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点_______ ;湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式_______ 。
(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈_______ ,制得分散系为_______ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点
 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是
您最近一年使用:0次
解题方法
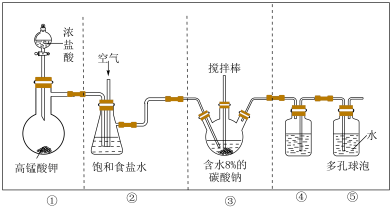
9 . 次氯酸作为消毒剂,被广泛应用于物体表面、织物等污染物品的消毒。某小组涉及如下装置(部分夹持装置略)制备 。
。 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;
ⅱ. 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;
ⅲ. 在
在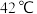 以上会分解。
以上会分解。
请回答下列问题:
(1)写出装置①中发生反应的化学方程式:_____ 。
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:_____ ;饱和食盐水也可替换为_____ 。
(3)制备 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_____ 。
(4)装置④的作用是_____ ;装置⑤中多孔球泡的作用是_____ 。
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b._____ 。
 。
。
 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;ⅱ.
 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;ⅲ.
 在
在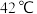 以上会分解。
以上会分解。请回答下列问题:
(1)写出装置①中发生反应的化学方程式:
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:
(3)制备
 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置④的作用是
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b.
您最近一年使用:0次
解题方法
10 . 一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料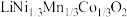 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中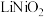 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为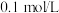 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于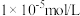 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: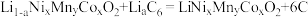 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料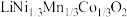 的工业流程如下:
的工业流程如下: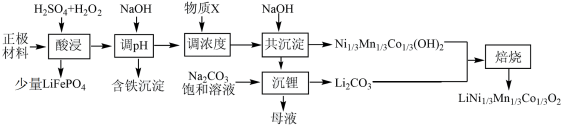

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  | 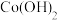 | 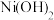 | 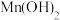 |
 | 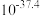 | 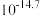 | 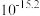 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
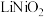 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
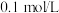 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是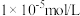 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
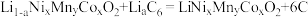 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

您最近一年使用:0次
2024-04-29更新
|
61次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题