1 . LFP是一种常见的锂离子电池正极材料,其中含有LiFePO4、炭黑、铝箔。利用废弃LFP正极材料回收金属、选择性提锂的工艺流程如下图所示。
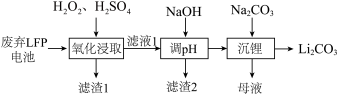
回答下列问题:
(1)Fe位于元素周期表的第___________ 周期___________ 族。
(2)若“滤渣1”中含有炭黑和FePO4,则“氧化浸取”中生成FePO4的离子方程式为___________ 。
(3)“滤渣2”的主要成分是___________ 。
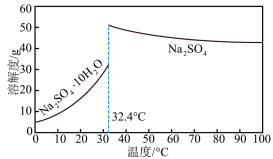
(4) 和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、___________ 、干燥。
(5)利用FePO4和Li2CO3与葡萄糖在氮气氛围中加热能制备LiFePO4和CO,则发生的化学方程式为___________ 。
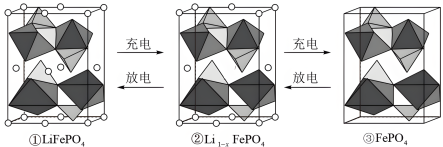
(6)LiFePO4的晶胞结构如图①所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFeO4脱出部分 ,转化为
,转化为 (图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为
(图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为___________ g/cm3,LiFeO4转化 的电极反应式为
的电极反应式为___________ 。

回答下列问题:
(1)Fe位于元素周期表的第
(2)若“滤渣1”中含有炭黑和FePO4,则“氧化浸取”中生成FePO4的离子方程式为
(3)“滤渣2”的主要成分是
(4)
 和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
和Na2SO4的溶解度曲线如下图所示,从母液中获Na2SO4的操作是加热浓缩至有大量晶体析出、
(5)利用FePO4和Li2CO3与葡萄糖在氮气氛围中加热能制备LiFePO4和CO,则发生的化学方程式为
(6)LiFePO4的晶胞结构如图①所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,LiFeO4脱出部分
 ,转化为
,转化为 (图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为
(图②),最终变成FePO4(图③,晶胞参数为a pm、b pm、c pm),则FePO4的晶胞密度为 的电极反应式为
的电极反应式为
您最近一年使用:0次
2 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,同时在化工制备和电池材料等方面具有广泛的应用前景。某实验小组制备高铁酸钾并探究其性质。
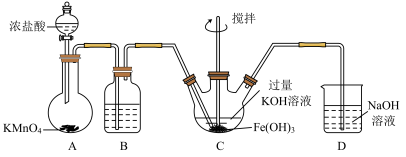
资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价_____ 。
(2)装置B中的试剂为_____ ,作用_____ 。
(3)装置C中制备K2FeO4时,发生反应的化学方程式为_____ ,每得到1mol K2FeO4,理论上消耗Cl2的物质的量为_____ mol。
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为_____ ,高铁酸钾作为水处理剂起到的作用是_____ 。
(5)制备 K2FeO4可以采用干式氧化法,初始反应为
 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为_____ 。

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价
(2)装置B中的试剂为
(3)装置C中制备K2FeO4时,发生反应的化学方程式为
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为
(5)制备 K2FeO4可以采用干式氧化法,初始反应为

 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为
您最近一年使用:0次
解题方法
3 . 北京冬奥会备受世界瞩目。下列说法正确的
A.冬奥会“飞扬”火炬首次使用的燃料 为氧化性气体 为氧化性气体 |
B.国家速滑馆“冰丝带”采用 跨临界直冷制冰涉及化学变化 跨临界直冷制冰涉及化学变化 |
C.冬奥会提供的直饮水都经过 消毒处理,是利用其强氧化性 消毒处理,是利用其强氧化性 |
D.航天员通过化学反应让奥运五环在中国空间站上漂浮,其2号黑色环中,碘化钾、碘酸钾遇到乙酸后产生了碘单质,离子方程式: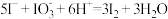 |
您最近一年使用:0次
名校
解题方法
4 . 下列装置、现象和结论均正确的是
| 选项 | A | B | C | D |
| 装置 | 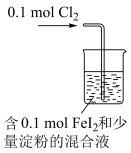 | 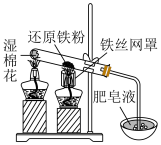 | 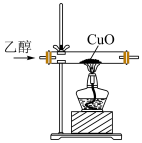 | 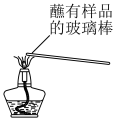 |
| 现象 | 烧杯中溶液变蓝 | 肥皂液中产生大量气泡 | 固体由黑色变红色 | 观察到黄色火焰 |
| 结论 | 还原性:I->Fe2+ | Fe与水蒸气发生反应 | 乙醇具有还原性 | 样品含钠元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
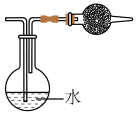
5 .  为高效安全灭菌消毒剂之一,现用如下图所示装置制备
为高效安全灭菌消毒剂之一,现用如下图所示装置制备 ,并将其通入潮湿的
,并将其通入潮湿的 制备纯净的
制备纯净的 。
。
已知:① 沸点为3.8℃,受热易分解,高浓度时易爆炸。
沸点为3.8℃,受热易分解,高浓度时易爆炸。
② 为酸性氧化物,且极易溶于水。
为酸性氧化物,且极易溶于水。

请回答下列问题:
(1)装置C中试剂为_______ 。图中各装置连接顺序为:a→_______ →b→c→_______ →f。(填装置中的字母)
(2)实验中d口和空气的进气速率要适中,实验中通过观察装置C中_______ 控制气体流速;当e口出气量一定时,需控制d口进气量与空气进气量的比值为1∶3的原因是_______ 。
(3)装置B中的化学反应方程式为_______ 。
(4)若实验过程中至少需要3 L(标准状况) 与潮湿的
与潮湿的 反应,实际称取的
反应,实际称取的 固体质量必须适当多于理论量,其原因是
固体质量必须适当多于理论量,其原因是_______ 。(写出两点)
(5)将装置B生成的气体直接通入到下列装置可制得HClO溶液。取下列装置中黄绿色溶液两等份,一份是通过与足量KI溶液反应生成 ,来测定
,来测定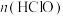 和
和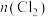 两者之和;另一份是把氯元素全部转化为AgCl,通过
两者之和;另一份是把氯元素全部转化为AgCl,通过 计算氯元素含量。实验结果表明
计算氯元素含量。实验结果表明 ,则黄绿色溶液中
,则黄绿色溶液中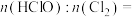
_______ 。(忽略 与水的反应)
与水的反应)
 为高效安全灭菌消毒剂之一,现用如下图所示装置制备
为高效安全灭菌消毒剂之一,现用如下图所示装置制备 ,并将其通入潮湿的
,并将其通入潮湿的 制备纯净的
制备纯净的 。
。已知:①
 沸点为3.8℃,受热易分解,高浓度时易爆炸。
沸点为3.8℃,受热易分解,高浓度时易爆炸。②
 为酸性氧化物,且极易溶于水。
为酸性氧化物,且极易溶于水。
请回答下列问题:
(1)装置C中试剂为
(2)实验中d口和空气的进气速率要适中,实验中通过观察装置C中
(3)装置B中的化学反应方程式为
(4)若实验过程中至少需要3 L(标准状况)
 与潮湿的
与潮湿的 反应,实际称取的
反应,实际称取的 固体质量必须适当多于理论量,其原因是
固体质量必须适当多于理论量,其原因是(5)将装置B生成的气体直接通入到下列装置可制得HClO溶液。取下列装置中黄绿色溶液两等份,一份是通过与足量KI溶液反应生成
 ,来测定
,来测定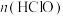 和
和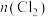 两者之和;另一份是把氯元素全部转化为AgCl,通过
两者之和;另一份是把氯元素全部转化为AgCl,通过 计算氯元素含量。实验结果表明
计算氯元素含量。实验结果表明 ,则黄绿色溶液中
,则黄绿色溶液中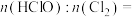
 与水的反应)
与水的反应)
您最近一年使用:0次
名校
解题方法
6 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组为测定黑木耳中的含铁量,进行了如下实验。
【铁元素的分离】
(1)高温灼烧黑木耳,使之完全灰化。用足量的硫酸充分溶解,过滤,得滤液。用铁氰化钾溶液检验发现滤液中也存在 ,请用离子方程式说明检验原理
,请用离子方程式说明检验原理_______ 。
【铁元素含量测定】
研学小组提出以下两种测定方案。
Ⅰ.沉淀法:
(2)向(1)中的滤液中加入足量NaOH溶液,过滤、洗涤沉淀、充分加热至恒重、称量。充分加热至恒重前发生的氧化还原反应方程式为_______ 。
Ⅱ.比色法:
方法:
步骤1:取10 mL a mol/L标准 溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;
溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;
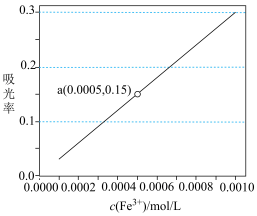
步骤2:将混合液定容至100 mL得到溶液X,再用色度传感器测定其对光的吸收率;
步骤3:改变标准 溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准
溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准 溶液浓度的关系)如下图所示:
溶液浓度的关系)如下图所示:
(3)用比色法估测(1)中的滤液中铁元素含量的操作如下:取10 mL(1)中的滤液,再加_______ ,混合均匀,再定容至100 mL,所得溶液颜色与标准色阶比对,即可测得10 mL滤液中铁元素含量。
(4)若(1)中取9 g黑木耳处理后得到15 mL滤液,按照比色法测得吸光率为上图中a点,则9g黑木耳中含铁元素的质量为_______ 。
(5)若将步骤1中的标准 溶液与(3)中的滤液用量均减少为原来的
溶液与(3)中的滤液用量均减少为原来的 ,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量
,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量_______ 。(填“偏高”、“偏低”或“不变”)
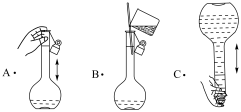
(6)用容量瓶配制a mol/L标准 溶液的部分操作如下,其中正确的是
溶液的部分操作如下,其中正确的是_______ ,若定容时仰视读数,则测得的黑木耳中铁元素的含量_______ 。(填“偏高”、“偏低”或“不变”)
【铁元素的分离】
(1)高温灼烧黑木耳,使之完全灰化。用足量的硫酸充分溶解,过滤,得滤液。用铁氰化钾溶液检验发现滤液中也存在
 ,请用离子方程式说明检验原理
,请用离子方程式说明检验原理【铁元素含量测定】
研学小组提出以下两种测定方案。
Ⅰ.沉淀法:
(2)向(1)中的滤液中加入足量NaOH溶液,过滤、洗涤沉淀、充分加热至恒重、称量。充分加热至恒重前发生的氧化还原反应方程式为
Ⅱ.比色法:
方法:
步骤1:取10 mL a mol/L标准
 溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;
溶液,再加0.1 mL b mol/L KSCN溶液,混合均匀;步骤2:将混合液定容至100 mL得到溶液X,再用色度传感器测定其对光的吸收率;
步骤3:改变标准
 溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准
溶液的浓度,重复步骤1和步骤2,得到标准色阶(吸光率与标准 溶液浓度的关系)如下图所示:
溶液浓度的关系)如下图所示:
(3)用比色法估测(1)中的滤液中铁元素含量的操作如下:取10 mL(1)中的滤液,再加
(4)若(1)中取9 g黑木耳处理后得到15 mL滤液,按照比色法测得吸光率为上图中a点,则9g黑木耳中含铁元素的质量为
(5)若将步骤1中的标准
 溶液与(3)中的滤液用量均减少为原来的
溶液与(3)中的滤液用量均减少为原来的 ,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量
,其他操作相同,对比色阶,则测得的黑木耳中铁元素的含量(6)用容量瓶配制a mol/L标准
 溶液的部分操作如下,其中正确的是
溶液的部分操作如下,其中正确的是
您最近一年使用:0次
解题方法
7 . 某工厂的工业废水中含有大量的 、较多的
、较多的 和
和 。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
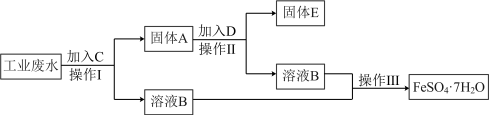
(1)加入试剂D为___________ 。
(2)加入试剂C,溶液中发生的离子方程式有___________ 。
(3)操作Ⅲ包括蒸发浓缩、___________ 、过滤、洗涤、干燥。
(4)工业上常用绿矾( )做处理剂,处理酸性废水中含有的重铬酸根离子(
)做处理剂,处理酸性废水中含有的重铬酸根离子( ),使
),使 全部转化为
全部转化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)实验室由 固体配制
固体配制 溶液。
溶液。
①如下图所示的仪器中配制溶液不需使用的是___________ (填字母),还缺少的玻璃仪器是___________ (填写仪器名称)。
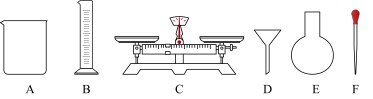
②若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是___________ (填字母)。
A.定容时仰视刻度线 B. 固体失去部分结晶水
固体失去部分结晶水
C.移液前,容量瓶内有蒸馏水 D.未冷却至室温就转移定容
 、较多的
、较多的 和
和 。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
(1)加入试剂D为
(2)加入试剂C,溶液中发生的离子方程式有
(3)操作Ⅲ包括蒸发浓缩、
(4)工业上常用绿矾(
 )做处理剂,处理酸性废水中含有的重铬酸根离子(
)做处理剂,处理酸性废水中含有的重铬酸根离子( ),使
),使 全部转化为
全部转化为 ,反应的离子方程式为
,反应的离子方程式为(5)实验室由
 固体配制
固体配制 溶液。
溶液。①如下图所示的仪器中配制溶液不需使用的是

②若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是
A.定容时仰视刻度线 B.
 固体失去部分结晶水
固体失去部分结晶水C.移液前,容量瓶内有蒸馏水 D.未冷却至室温就转移定容
您最近一年使用:0次
8 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如下图所示:
的一种制备方法如下图所示:

已知:① 难溶于水;
难溶于水;
②硝酸能与除金和铂以外的绝大多数金属反应;
③还原性: 。
。
回答下列问题:
(1)I元素位于元素周期表第___________ 周期第___________ 族。
(2)加入Fe粉进行转化反应的化学方程式为___________ 。
(3)“转化”步骤中生成的沉淀与硝酸反应,生成___________ 后可循环使用;“富集”步骤之前,海水要除去 的目的是
的目的是___________ 。
(4)通入的 完全反应,若反应物用量比0<
完全反应,若反应物用量比0<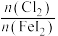 ≤1时,氧化产物为
≤1时,氧化产物为___________ ;当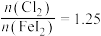 时,反应的离子方程式为
时,反应的离子方程式为___________ 。
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
已知:①
 难溶于水;
难溶于水;②硝酸能与除金和铂以外的绝大多数金属反应;
③还原性:
 。
。回答下列问题:
(1)I元素位于元素周期表第
(2)加入Fe粉进行转化反应的化学方程式为
(3)“转化”步骤中生成的沉淀与硝酸反应,生成
 的目的是
的目的是(4)通入的
 完全反应,若反应物用量比0<
完全反应,若反应物用量比0<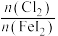 ≤1时,氧化产物为
≤1时,氧化产物为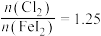 时,反应的离子方程式为
时,反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 一种铁基脱硫剂脱除硫化氢(H2S)的方法包括吸收和再生两个阶段,其工艺流程原理如图所示。下列有关说法错误的是
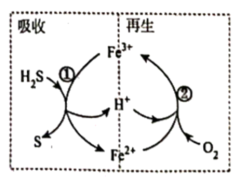

A.反应①中 是氧化产物,反应②中 是氧化产物,反应②中 既不是氧化剂,又不是还原剂 既不是氧化剂,又不是还原剂 |
B.再生反应②的离子方程式为: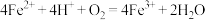 |
C.氧化性: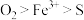 |
D.若要保持脱硫液中 的物质的量不变,则吸收的 的物质的量不变,则吸收的 与通入的 与通入的 在相同状况下的体积比为 在相同状况下的体积比为 |
您最近一年使用:0次
解题方法
10 . 四氢铝钠( )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):

回答下列问题:
(1) 中氢的化合价为
中氢的化合价为_______ 。
(2)浸渣的主要成分是_______ (填化学式);“转化”中 的具体作用是
的具体作用是_______ 。
(3)由 制备
制备 的离子方程式为
的离子方程式为_______ ;“分离”中铝元素转化成_______ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是_______ 。
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为_______ 。
(6)“有效氢”指单位质量(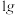 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表_______ (填化学式)。

 )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):
回答下列问题:
(1)
 中氢的化合价为
中氢的化合价为(2)浸渣的主要成分是
 的具体作用是
的具体作用是(3)由
 制备
制备 的离子方程式为
的离子方程式为(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为
(6)“有效氢”指单位质量(
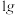 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表
您最近一年使用:0次



