名校
解题方法
1 . 镍的氧化物M是蓄电池材料。某小组用含镍废料(成分为NiO、Ni2O3、FeO、MgO和SiO2等)制备M的工艺流程如图所示。
(1)固体2的主要成分是_______ (填化学式)。提高“酸浸”速率宜采用的措施有_______ (答两条)。
(2)“酸浸”中有无色无味且有助燃性的气体产生,该过程中发生反应的离子方程式为_______ 。
(3)已知: ,
, 。若浸出液中
。若浸出液中 ,当离子浓度
,当离子浓度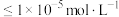 时认为已完全沉淀。用Na2CO3调节pH范围为
时认为已完全沉淀。用Na2CO3调节pH范围为_______ 。
(4)“系列操作”包括蒸发浓缩、_______ 、过滤、乙醇洗涤、干燥。用乙醇洗涤的目的是_______ 。
(5)灼烧NiSO4•7H2O时,剩余固体的质量与温度的变化关系如图1所示。_______ 。
(6)Nb和Ni组成合金,晶胞如图2所示。设 为阿伏加德罗常数的值。该晶胞密度为
为阿伏加德罗常数的值。该晶胞密度为_______  (只列计算式)。
(只列计算式)。

(1)固体2的主要成分是
(2)“酸浸”中有无色无味且有助燃性的气体产生,该过程中发生反应的离子方程式为
(3)已知:
 ,
, 。若浸出液中
。若浸出液中 ,当离子浓度
,当离子浓度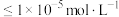 时认为已完全沉淀。用Na2CO3调节pH范围为
时认为已完全沉淀。用Na2CO3调节pH范围为(4)“系列操作”包括蒸发浓缩、
(5)灼烧NiSO4•7H2O时,剩余固体的质量与温度的变化关系如图1所示。

(6)Nb和Ni组成合金,晶胞如图2所示。设
 为阿伏加德罗常数的值。该晶胞密度为
为阿伏加德罗常数的值。该晶胞密度为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
2024-05-06更新
|
66次组卷
|
3卷引用:湖北省T8联盟2024届高三下学期压轴考试(一模)化学试题(1)
名校
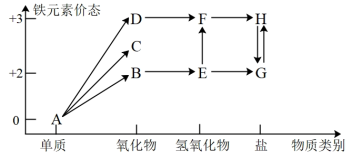
2 . 铁是人类较早使用的金属之一,下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。运用铁及其化合物的知识,回答下列问题。_______ ;E→F反应的化学方程式是_______ ,该反应过程的现象为_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点_______ ;湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式_______ 。
(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈_______ ,制得分散系为_______ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点
 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是
您最近一年使用:0次
解题方法
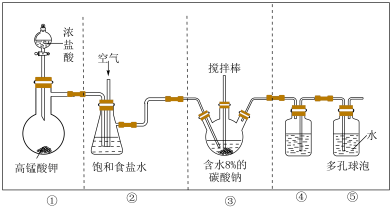
3 . 次氯酸作为消毒剂,被广泛应用于物体表面、织物等污染物品的消毒。某小组涉及如下装置(部分夹持装置略)制备 。
。 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;
ⅱ. 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;
ⅲ. 在
在 以上会分解。
以上会分解。
请回答下列问题:
(1)写出装置①中发生反应的化学方程式:_____ 。
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:_____ ;饱和食盐水也可替换为_____ 。
(3)制备 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_____ 。
(4)装置④的作用是_____ ;装置⑤中多孔球泡的作用是_____ 。
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b._____ 。
 。
。
 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;ⅱ.
 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;ⅲ.
 在
在 以上会分解。
以上会分解。请回答下列问题:
(1)写出装置①中发生反应的化学方程式:
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:
(3)制备
 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置④的作用是
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b.
您最近一年使用:0次
解题方法
4 . 一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料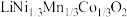 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于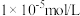 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: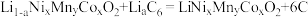 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料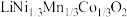 的工业流程如下:
的工业流程如下: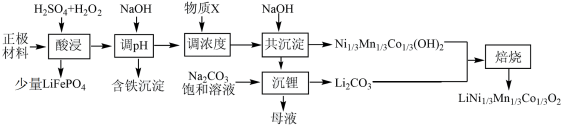

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  |  |  |  |
 | 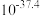 | 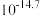 | 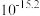 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是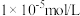 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
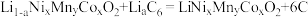 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

您最近一年使用:0次
2024-04-29更新
|
73次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
名校
5 . 利用氨的催化氧化原理制备硝酸并进行喷泉实验,装置如图所示(省略夹持装置),下列说法正确的是

A.可以利用 制备氨气 制备氨气 |
| B.一段时间后,可以在圆底烧瓶观察到无色喷泉 |
C.若要液体充满圆底烧瓶,理论上通入的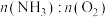 小于1∶2 小于1∶2 |
D.1mol  完全转化为硝酸,转移电子的数目为8 完全转化为硝酸,转移电子的数目为8 |
您最近一年使用:0次
2024-04-27更新
|
102次组卷
|
2卷引用:湖北省部分学校2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
6 . 氧化亚铜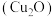 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
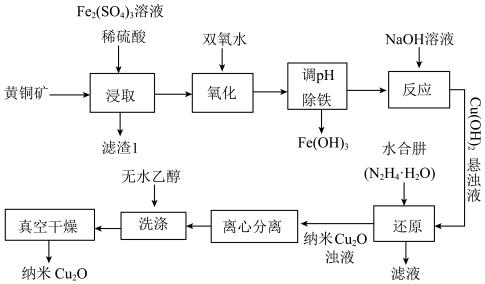
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。
已知: (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇;
 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。___________ 和 。
。
(2)写出浸取时发生反应的离子方程式___________ 。
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式___________ ,每生成 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为___________ 。
(4)洗涤过程中,用无水乙醇洗涤的目的是___________ 。
(5)证明得到的 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是___________ 。
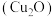 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。已知:
 (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇; 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。
 。
。(2)写出浸取时发生反应的离子方程式
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式
 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为(4)洗涤过程中,用无水乙醇洗涤的目的是
(5)证明得到的
 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是
您最近一年使用:0次
名校
解题方法
7 . 硫铁矿(主要成分为FeS2)是工业制硫酸的主要原料。硫铁矿烧渣中含有Fe2O3、Fe3O4、Al2O3等成分,可用于制备硫酸和绿矾(FeSO4·7H2O),流程示意图如下。
(1)硫元素位于周期表中第___________ 周期,第___________ 族。
(2)硫铁矿煅烧时反应的化学方程式为___________ 。
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
为提高SO2的转化率,该反应应选择的温度是___________ ℃,压强采用“常压”的主要原因为___________ 。
(4)“还原”和“除铝”能否交换顺序?___________ (填“能”或“否”),原因是___________
(5)“结晶”过程的步骤如下:___________ (填操作和现象)。
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++ +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为___________ 。
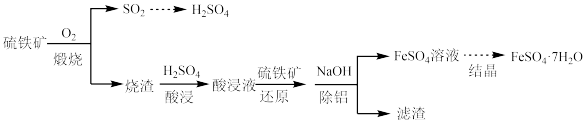
| Fe3+ | A13+ | Fe2+ | |
| 开始沉淀时的pH | |1.5 | 3.3 | 6.5 |
| 沉淀完全时的pH | 3.7 | 5.2 | 9.7 |
(1)硫元素位于周期表中第
(2)硫铁矿煅烧时反应的化学方程式为
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(4)“还原”和“除铝”能否交换顺序?
(5)“结晶”过程的步骤如下:
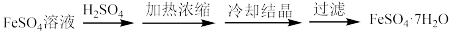
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++
 +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
您最近一年使用:0次
解题方法
8 . 我国科研人员合成出了尺寸可调、品质高的CdE(E=S,Se,Te)量子点,并发展成为如今镉基量子点合成的通用方法。
(1)基态S原子的价电子排布式为___________ 。CdSe量子点直径尺寸在8~12nm,所以CdSe量子点常被称为___________ (填分散系名称)量子点。
(2)在一定条件下可由 和Se反应生成
和Se反应生成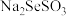 ,再由
,再由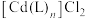 与
与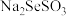 反应制得CdSe颗粒,制备流程和生成
反应制得CdSe颗粒,制备流程和生成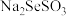 的实验装置如图所示:
的实验装置如图所示:___________ 。
② 与配位剂L形成配合物
与配位剂L形成配合物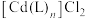 的化学方程式为
的化学方程式为___________ 。
③研究表明,CdSe的生成分两步,其中第二步是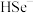 与
与 反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为
反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为___________ 。
④某化学小组通过实验探究了60℃下,其他条件相同时,反应时间、配位剂浓度分别对纳米颗粒平均粒径的影响,结果如图1、图2所示。___________ 。
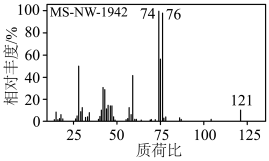
(3)配位剂L是一种组成人体内蛋白质的氨基酸,其质谱图如图所示,分子中含硫质量分数为26.45%且巯基(-SH)与β-碳原子直接相连,则配位剂L的结构简式为___________ 。实验室中,还可以用___________ (填现代仪器分析法名称)获得其化学键或官能团的信息。
(1)基态S原子的价电子排布式为
(2)在一定条件下可由
 和Se反应生成
和Se反应生成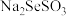 ,再由
,再由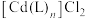 与
与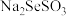 反应制得CdSe颗粒,制备流程和生成
反应制得CdSe颗粒,制备流程和生成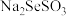 的实验装置如图所示:
的实验装置如图所示: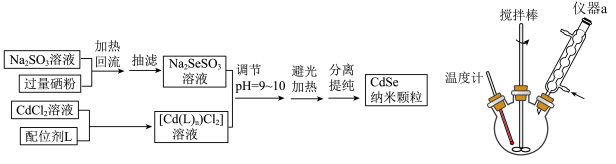
②
 与配位剂L形成配合物
与配位剂L形成配合物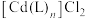 的化学方程式为
的化学方程式为③研究表明,CdSe的生成分两步,其中第二步是
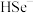 与
与 反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为
反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为④某化学小组通过实验探究了60℃下,其他条件相同时,反应时间、配位剂浓度分别对纳米颗粒平均粒径的影响,结果如图1、图2所示。

(3)配位剂L是一种组成人体内蛋白质的氨基酸,其质谱图如图所示,分子中含硫质量分数为26.45%且巯基(-SH)与β-碳原子直接相连,则配位剂L的结构简式为
您最近一年使用:0次
9 . 氧化性酸的铵盐受热分解过程中铵被氧化,产物中有大量气体,因此受热往往会发生爆炸。硝酸铵在不同温度下受热分解的产物如下表所示。下列说法正确的是
| 温度 | 分解产物 | |
| 反应I | 185~200℃ |  、 、 |
| 反应II | 高于230℃ |  、 、 、 、 |
| 反应III | 高于400℃ |  、 、 、 、 |
A. 和 和 的VSEPR模型名称均为四面体形 的VSEPR模型名称均为四面体形 |
B.三个反应中,均有 |
C.反应I和II中,转移 时生成等物质的量的气体 时生成等物质的量的气体 |
D.反应II和III中, 均仅为氧化产物 均仅为氧化产物 |
您最近一年使用:0次
名校
10 . 古代青铜器的出土,体现了古代中国对人类物质文明的巨大贡献。青铜器埋藏会产生多种锈蚀产物,其中 结构致密,可以阻止内部青铜继续被腐蚀,而
结构致密,可以阻止内部青铜继续被腐蚀,而 结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:
结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:不正确 的是
 结构致密,可以阻止内部青铜继续被腐蚀,而
结构致密,可以阻止内部青铜继续被腐蚀,而 结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:
结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:
A.青铜锈蚀Ⅰ过程属于电化学腐蚀,负极的电极反应方程式为: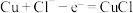 |
B.青铜锈蚀Ⅰ过程中 浓度越大,腐蚀趋势越大 浓度越大,腐蚀趋势越大 |
C.青铜锈蚀Ⅲ生成 的方程式为: 的方程式为: |
| D.青铜器修复可用碳酸钠溶液浸泡一段时间,使其保存更长久 |
您最近一年使用:0次
2024-04-15更新
|
418次组卷
|
5卷引用:湖北省襄阳四中2024届高三下学期学业水平适应性考试(一模)化学试题