1 . 从海带浸泡液(碘元素主要以 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。 的作用为
的作用为_______ (填“氧化剂”或“还原剂”)。
(2)为提高①的化学反应速率,可采取的措施是_______ (写出一条即可)。
(3)补全②的离子方程式:_______ 。
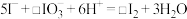
(4)②中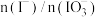 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。
分析图中信息,选择最佳条件:_______ 。
 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。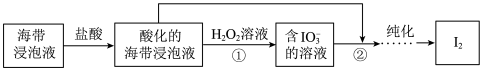
 的作用为
的作用为(2)为提高①的化学反应速率,可采取的措施是
(3)补全②的离子方程式:
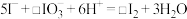
(4)②中
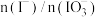 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。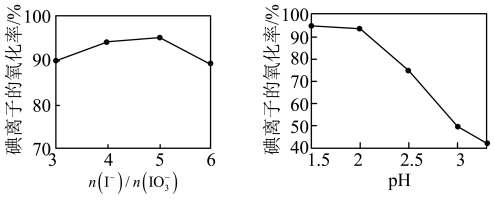
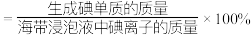
分析图中信息,选择最佳条件:
您最近一年使用:0次
解题方法
2 . 从某工厂铜电解车间产生的难溶副产物黑铜泥(主要成分为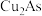 和
和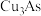 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。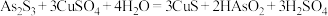 ;
;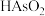 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。
(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是___________ 。
(2)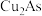 和
和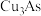 被氧化为
被氧化为 和
和 。
。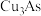 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。___________ 。
(4)上述流程中可循环使用的物质是___________ 。
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将___________ (填“偏大”“偏小”或“不变”)。
②样品中砷的质量分数为___________ 。
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因___________ 。
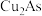 和
和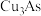 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。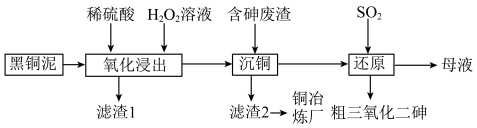
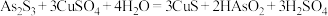 ;
;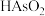 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是
(2)
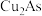 和
和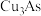 被氧化为
被氧化为 和
和 。
。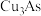 被氧化的离子方程式为
被氧化的离子方程式为(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。
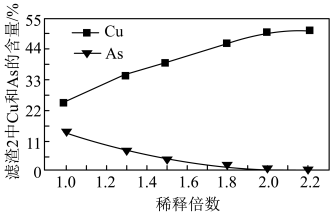
(4)上述流程中可循环使用的物质是
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用
 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将
②样品中砷的质量分数为
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因
您最近一年使用:0次
解题方法
3 . 某化学小组探究硫酸铁铵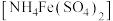 与
与 、
、 的反应。
的反应。
已知: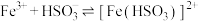 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
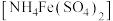 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入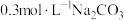 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
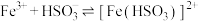 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
解题方法
4 . 下列事实中涉及的反应与氧化还原无关的是
A.用 溶液吸收 溶液吸收 |
B.利用铜与浓硫酸加热反应制取 |
C.乙醇使紫色酸性 溶液褪色 溶液褪色 |
| D.在船体上镶嵌锌块,可以减缓船体被海水腐蚀 |
您最近一年使用:0次
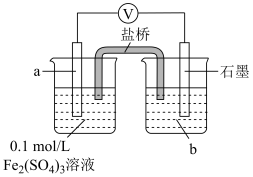
5 . 以 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
资料:i.水溶液中: 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。
ii. ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。
将等体积的溶液a分别加到等量铜粉中,实验记录如下:
(1)Ⅰ中产生白色沉淀的离子方程式是____________ 。
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将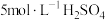 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。
依据电极反应式,分析产生 的原因
的原因____________ 。
②Ⅱ中溶液变为黄色,用离子方程式解释可能原因____________ 。
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1: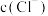 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因____________ 。
②假设2: 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:______ (填操作和现象),证实假设2不合理。
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因______ 。
(5)结合现象和化学反应原理解释选择 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因____________ 。
 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。资料:i.水溶液中:
 呈无色;
呈无色; 呈黄色;
呈黄色; 呈棕色。
呈棕色。ii.
 ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。将等体积的溶液a分别加到等量铜粉中,实验记录如下:
实验 | 溶液a | 现象 |
Ⅰ |  溶液( 溶液( ) ) | 产生白色沉淀,溶液蓝色变浅,5h时铜粉剩余 |
Ⅱ | 浓盐酸(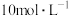 ) ) | 产生无色气泡,溶液无色;继而溶液变为黄色;较长时间后溶液变为棕色,5h时铜粉剩余 |
Ⅲ |  溶液( 溶液( )和浓盐酸( )和浓盐酸(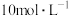 ) ) | 溶液由黄绿色变为棕色,无气泡;随着反应进行,溶液颜色变浅,后接近于无色,5h时铜粉几乎无剩余 |
(1)Ⅰ中产生白色沉淀的离子方程式是
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为
 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将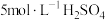 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。依据电极反应式,分析产生
 的原因
的原因②Ⅱ中溶液变为黄色,用离子方程式解释可能原因
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1:
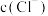 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因
②假设2:
 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因
(5)结合现象和化学反应原理解释选择
 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因
您最近一年使用:0次
解题方法
6 . 废电池中含磷酸铁锂,提锂后的废渣主要含 、
、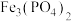 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。 、
、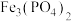 均难溶于水。
均难溶于水。
ii.将 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。
(1)酸浸前,将废渣粉碎的目的是________ 。
(2)从平衡移动的角度解释加入硝酸溶解 的原因:
的原因:________ 。
(3)在酸浸液中加入 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中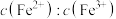 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用:________ 。 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:________ 。
(5)过滤得到电池级 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有________ 。
(6)磷酸铁锂-石墨电池的总反应: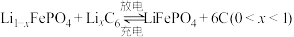 。
。
①高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是________ 。
②放电时负极的电极反应式是________ 。
 、
、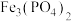 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。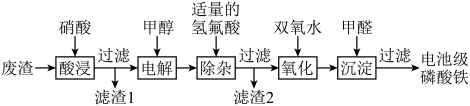
 、
、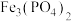 均难溶于水。
均难溶于水。ii.将
 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。(1)酸浸前,将废渣粉碎的目的是
(2)从平衡移动的角度解释加入硝酸溶解
 的原因:
的原因:(3)在酸浸液中加入
 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中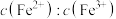 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用: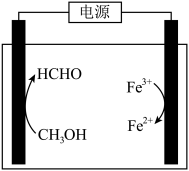
 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:(5)过滤得到电池级
 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有(6)磷酸铁锂-石墨电池的总反应:
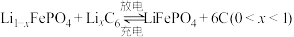 。
。①高温条件下,
 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是②放电时负极的电极反应式是
您最近一年使用:0次
解题方法
7 . 从电子废料(含Au、Ag和Cu等)中可回收金,主要流程如下: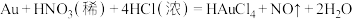
下列说法不正确 的是
下列说法
A.浓盐酸促进了Au和 的反应,其原因是降低了 的反应,其原因是降低了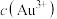 ,增强了Au的还原性 ,增强了Au的还原性 |
B.依据王水溶金原理,NaCN饱和溶液与 也可使Au溶解 也可使Au溶解 |
C. 可实现析金发生反应: 可实现析金发生反应: |
D.以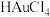 为电解质进行粗金的电解精炼,可能会有AgCl覆盖在阴极发生钝化 为电解质进行粗金的电解精炼,可能会有AgCl覆盖在阴极发生钝化 |
您最近一年使用:0次
8 . 某小组探究 的制备。
的制备。
已知:i. (绿色,不溶于水)、
(绿色,不溶于水)、 (绿色)、
(绿色)、 (灰绿色,不溶于水)、
(灰绿色,不溶于水)、
 (玫瑰红色)、
(玫瑰红色)、 (橙色)、
(橙色)、 (黄色)
(黄色)
ii. 是一种弱酸,易分解:
是一种弱酸,易分解: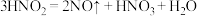
将 固体和
固体和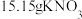 固体(物质的量之比为1:3)与过量的
固体(物质的量之比为1:3)与过量的 固体混合,高温煅烧得含
固体混合,高温煅烧得含 的黄色固体,反应如下:
的黄色固体,反应如下:
 。
。
(1) 受热分解转化为
受热分解转化为 ,反应的化学方程式是
,反应的化学方程式是________ 。
(2) 转化为
转化为 ,进行实验Ⅰ:
,进行实验Ⅰ: ,
, 转化为
转化为 反应的离子方程式是
反应的离子方程式是________ 。
②无色气泡中的气体有________ 。
③资料显示溶液变为棕黑色是 与
与 混合所致。设计实验:取少量棕黑色溶液于试管中,逐滴加入NaOH溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液
混合所致。设计实验:取少量棕黑色溶液于试管中,逐滴加入NaOH溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液________ (填操作和现象),证实溶液中存在 与
与 。
。
(3)探究 的来源
的来源
来源1:……
来源2:酸性环境中, 与
与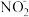 发生氧化还原反应生成
发生氧化还原反应生成 。
。
①来源1:________ 。
②进行实验Ⅱ证实来源2成立,实验操作及现象如下:
溶液由橙色变为绿色、绿色变为玫瑰红色的反应的离子方程式:________ 、________ 。
从平衡移动的角度解释溶液由玫瑰红色变为绿色的原因:________ 。
(4)为避免 转化为
转化为 的过程中产生
的过程中产生 ,进行实验Ⅲ。
,进行实验Ⅲ。
将煅烧后的黄色固体浸泡于100mL水中,过滤后向滤液中加入醋酸溶液,调至pH=5,溶液变为橙色。
实验Ⅲ中溶液的颜色与实验Ⅰ中的不同的原因可能是________ 。
 的制备。
的制备。已知:i.
 (绿色,不溶于水)、
(绿色,不溶于水)、 (绿色)、
(绿色)、 (灰绿色,不溶于水)、
(灰绿色,不溶于水)、 (玫瑰红色)、
(玫瑰红色)、 (橙色)、
(橙色)、 (黄色)
(黄色)ii.
 是一种弱酸,易分解:
是一种弱酸,易分解: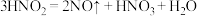
将
 固体和
固体和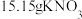 固体(物质的量之比为1:3)与过量的
固体(物质的量之比为1:3)与过量的 固体混合,高温煅烧得含
固体混合,高温煅烧得含 的黄色固体,反应如下:
的黄色固体,反应如下: 。
。(1)
 受热分解转化为
受热分解转化为 ,反应的化学方程式是
,反应的化学方程式是(2)
 转化为
转化为 ,进行实验Ⅰ:
,进行实验Ⅰ: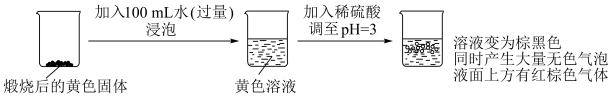
 ,
, 转化为
转化为 反应的离子方程式是
反应的离子方程式是②无色气泡中的气体有
③资料显示溶液变为棕黑色是
 与
与 混合所致。设计实验:取少量棕黑色溶液于试管中,逐滴加入NaOH溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液
混合所致。设计实验:取少量棕黑色溶液于试管中,逐滴加入NaOH溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液 与
与 。
。(3)探究
 的来源
的来源来源1:……
来源2:酸性环境中,
 与
与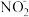 发生氧化还原反应生成
发生氧化还原反应生成 。
。①来源1:
②进行实验Ⅱ证实来源2成立,实验操作及现象如下:
实验操作 | 实验现象 |
| 溶液由橙色逐渐变为棕黑色,进而变为绿色,过程中无红棕色气体产生。 继续加入  溶液,溶液变为玫瑰红色,加入 溶液,溶液变为玫瑰红色,加入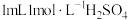 溶液后,溶液恢复绿色。 溶液后,溶液恢复绿色。 |
从平衡移动的角度解释溶液由玫瑰红色变为绿色的原因:
(4)为避免
 转化为
转化为 的过程中产生
的过程中产生 ,进行实验Ⅲ。
,进行实验Ⅲ。将煅烧后的黄色固体浸泡于100mL水中,过滤后向滤液中加入醋酸溶液,调至pH=5,溶液变为橙色。
实验Ⅲ中溶液的颜色与实验Ⅰ中的不同的原因可能是
您最近一年使用:0次
解题方法
9 . 处理废旧铅酸电池中的含铅浆液(主要含 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。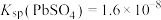 ,
,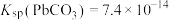 ,
,
ii. 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。
(1)向含铅浆液中加入过量的 实现转化脱硫。
实现转化脱硫。
①结合离子方程式说明 溶液显碱性的原因:
溶液显碱性的原因:________ 。
②转化脱硫反应的离子方程式是________ 。
③检验 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是________ 。
(2)受热时, 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。
将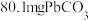 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中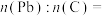
________ 。[ 、
、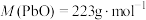 ]
]
(3)“还原”时加入 溶液,反应的化学方程式是
溶液,反应的化学方程式是________ 。
(4)“浸出”反应的离子方程式是________ 。
(5)以惰性电极电解 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是________ 。
 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。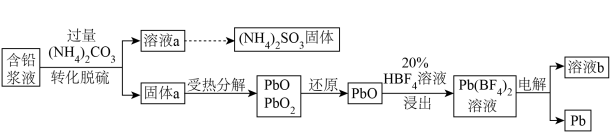
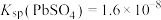 ,
,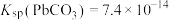 ,
,ii.
 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。(1)向含铅浆液中加入过量的
 实现转化脱硫。
实现转化脱硫。①结合离子方程式说明
 溶液显碱性的原因:
溶液显碱性的原因:②转化脱硫反应的离子方程式是
③检验
 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是(2)受热时,
 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。将
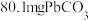 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中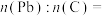
 、
、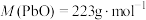 ]
](3)“还原”时加入
 溶液,反应的化学方程式是
溶液,反应的化学方程式是(4)“浸出”反应的离子方程式是
(5)以惰性电极电解
 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是
您最近一年使用:0次

 )中的铜元素以
)中的铜元素以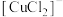 的形式,铁元素以
的形式,铁元素以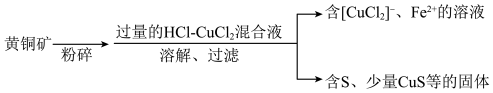
 ,配体是
,配体是
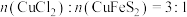
 溶液的混合液也可能使黄铜矿溶解
溶液的混合液也可能使黄铜矿溶解

