名校
解题方法
1 . 实验小组探究溶液酸碱性对锰化合物和 ,氧化还原反应的影响。
,氧化还原反应的影响。
资料:i. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ii. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
iii. 为微溶物。
为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因________________________ 。
(2)已知,实验I、II、III中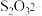 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:
①对于 氧化性的认识是
氧化性的认识是____________ 。
②实验Ⅱ所得溶液中 的检验方法为
的检验方法为________________________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为____________ 。
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:____________ (写出2点)。
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
②实验VI:向实验IV的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
对比实验V、VI,结合方程式分析实验VI滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因____________ 。
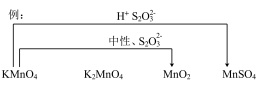
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系_____________ 。
 ,氧化还原反应的影响。
,氧化还原反应的影响。资料:i.
 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。ii.
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。iii.
 为微溶物。
为微溶物。实验 | 序号 | 试剂 | 现象 |
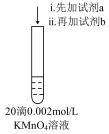
| I | a:10滴 溶液 溶液b:20滴 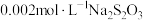 溶液 溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
II | a:10滴蒸馏水 b:20滴 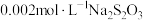 溶液 溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀 | |
III | a:10滴 溶液 溶液b:2滴 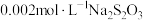 溶液和18滴蒸馏水 溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置5min,未见明显变化 | |
IV | a:10滴 溶液 溶液b:20滴 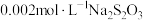 溶液 溶液 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、II、III中
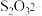 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:①对于
 氧化性的认识是
氧化性的认识是②实验Ⅱ所得溶液中
 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量
 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。②实验VI:向实验IV的试管中继续滴加足量
 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。对比实验V、VI,结合方程式分析实验VI滴加
 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系
您最近一年使用:0次
2024-02-29更新
|
272次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
2 . 以 溶液和不同金属的盐溶液作为实验对象,探究
溶液和不同金属的盐溶液作为实验对象,探究 的性质和盐溶液间反应的多样性。
的性质和盐溶液间反应的多样性。
【查阅资料】
① 能与多种不同金属离子形成沉淀或配合物:
能与多种不同金属离子形成沉淀或配合物:
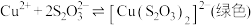 ,
,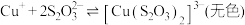
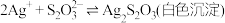 ,
,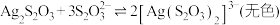
② 易被氧化为
易被氧化为 或者
或者
【进行实验】
Ⅰ.探究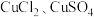 和
和 溶液之间的反应
溶液之间的反应
(1)经检验,实验a绿色变浅后的溶液中含 ,这说明
,这说明 具有
具有_______ (填“氧化”或“还原”)性。
(2)从反应速率和化学平衡两个角度解释实验a的实验现象_______ 。
II.探究 和
和 溶液之间的反应。
溶液之间的反应。
(3)实验c中产生的白色沉淀为 ,用化学用语解释“超过
,用化学用语解释“超过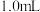 后,产生少量白色沉淀”的原因:
后,产生少量白色沉淀”的原因:_______ 。
(4)为了探究实验c中产生黑色沉淀的原因,甲同学进行了进一步的实验:
ⅰ.取少量滤液B,用广泛pH试纸测定 ;
;
ⅱ.另取少量滤液B于试管中,_______ (填操作和现象),说明滤液中有 。
。
由上述实验现象,进而推测出黑色沉淀A可能为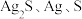 或它们的混合物。运用氧化还原反应规律,做出该推测的理由是
或它们的混合物。运用氧化还原反应规律,做出该推测的理由是_______ 。
【获得结论】
(5)根据上述实验, 和金属盐溶液之间反应的多样性与多种因素有关:①
和金属盐溶液之间反应的多样性与多种因素有关:①_______ :②金属盐中的阴离子是否能够参与反应;③反应时间的长短;④_______ 。
 溶液和不同金属的盐溶液作为实验对象,探究
溶液和不同金属的盐溶液作为实验对象,探究 的性质和盐溶液间反应的多样性。
的性质和盐溶液间反应的多样性。| 实验 试管 | 试剂滴管:逐滴滴加,总体积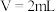 | 现象 |
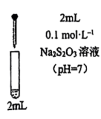 | 实验a: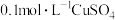 溶液 溶液实验b: 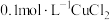 溶液 溶液 | 溶液先变为绿色,静止后缓慢变浅,最终变为浅绿色 溶液先变为绿色,缓慢产生白色浑浊,充分反应后绿色比实验a更浅 |
实验c: 溶液 溶液 | 生成白色沉淀,振荡后迅速溶解,得到无色清液;超过1.0mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色,静置充分反应后,过滤得到黑色沉淀A和滤液B |
①
 能与多种不同金属离子形成沉淀或配合物:
能与多种不同金属离子形成沉淀或配合物: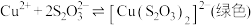 ,
,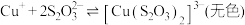
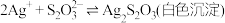 ,
,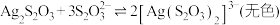
②
 易被氧化为
易被氧化为 或者
或者
【进行实验】
Ⅰ.探究
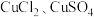 和
和 溶液之间的反应
溶液之间的反应(1)经检验,实验a绿色变浅后的溶液中含
 ,这说明
,这说明 具有
具有(2)从反应速率和化学平衡两个角度解释实验a的实验现象
II.探究
 和
和 溶液之间的反应。
溶液之间的反应。(3)实验c中产生的白色沉淀为
 ,用化学用语解释“超过
,用化学用语解释“超过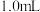 后,产生少量白色沉淀”的原因:
后,产生少量白色沉淀”的原因:(4)为了探究实验c中产生黑色沉淀的原因,甲同学进行了进一步的实验:
ⅰ.取少量滤液B,用广泛pH试纸测定
 ;
;ⅱ.另取少量滤液B于试管中,
 。
。由上述实验现象,进而推测出黑色沉淀A可能为
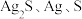 或它们的混合物。运用氧化还原反应规律,做出该推测的理由是
或它们的混合物。运用氧化还原反应规律,做出该推测的理由是【获得结论】
(5)根据上述实验,
 和金属盐溶液之间反应的多样性与多种因素有关:①
和金属盐溶液之间反应的多样性与多种因素有关:①
您最近一年使用:0次
名校
解题方法
3 . 三草酸合铁酸钾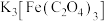 是制作蓝图的感光剂,光照下转化为黄色的
是制作蓝图的感光剂,光照下转化为黄色的 。已知:
。已知: 在水中的溶解度:
在水中的溶解度: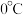 时,
时,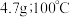 时,
时,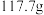
(1)制备 晶体
晶体
I.向 溶液中加入
溶液中加入 溶液,得到黄色沉淀
溶液,得到黄色沉淀 ;
;
Ⅱ.过滤,在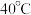 条件下向沉淀中加入
条件下向沉淀中加入 和
和 溶液,沉淀变为红褐色;
溶液,沉淀变为红褐色;
Ⅲ.待沉淀转化完全后,将浊液煮沸 ;停止加热,加入
;停止加热,加入 溶液,红褐色沉淀溶解,得到
溶液,红褐色沉淀溶解,得到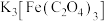 溶液;
溶液;
Ⅳ.___________(操作),得到 晶体。
晶体。
①配制 溶液需要加入稀硫酸,目的是防止氧化和
溶液需要加入稀硫酸,目的是防止氧化和___________ (用化学用语表示)。
②配平Ⅱ中反应方程式:___________ 。

③取少量Ⅱ中产物,先加入足量硫酸,___________ (填操作和现象),说明 完全反应。
完全反应。
④Ⅲ中将浊液煮沸 的目的是
的目的是___________ 。
⑤Ⅱ中加入 与
与 的物质的量比值大于2(理论值),结合化学方程式解释原因:
的物质的量比值大于2(理论值),结合化学方程式解释原因:___________ 。
⑥Ⅳ中的操作是___________ 。
(2)产品纯度检测
i.称量 制得的
制得的 样品,加水溶解,并加入稀
样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;
ii.加入过量 粉,反应完全后,弃去不溶物,向溶液中加入稀
粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用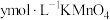 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知:ⅱ中 粉将铁元素全部还原为
粉将铁元素全部还原为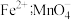 转化为
转化为 。
。
①步骤ⅰ的目的是___________ 。
②该样品中铁元素的质量分数是___________ (用含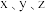 的代数式表示)。
的代数式表示)。
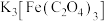 是制作蓝图的感光剂,光照下转化为黄色的
是制作蓝图的感光剂,光照下转化为黄色的 。已知:
。已知: 在水中的溶解度:
在水中的溶解度: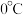 时,
时,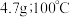 时,
时,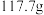
(1)制备
 晶体
晶体I.向
 溶液中加入
溶液中加入 溶液,得到黄色沉淀
溶液,得到黄色沉淀 ;
;Ⅱ.过滤,在
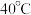 条件下向沉淀中加入
条件下向沉淀中加入 和
和 溶液,沉淀变为红褐色;
溶液,沉淀变为红褐色;Ⅲ.待沉淀转化完全后,将浊液煮沸
 ;停止加热,加入
;停止加热,加入 溶液,红褐色沉淀溶解,得到
溶液,红褐色沉淀溶解,得到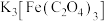 溶液;
溶液;Ⅳ.___________(操作),得到
 晶体。
晶体。①配制
 溶液需要加入稀硫酸,目的是防止氧化和
溶液需要加入稀硫酸,目的是防止氧化和②配平Ⅱ中反应方程式:

③取少量Ⅱ中产物,先加入足量硫酸,
 完全反应。
完全反应。④Ⅲ中将浊液煮沸
 的目的是
的目的是⑤Ⅱ中加入
 与
与 的物质的量比值大于2(理论值),结合化学方程式解释原因:
的物质的量比值大于2(理论值),结合化学方程式解释原因:⑥Ⅳ中的操作是
(2)产品纯度检测
i.称量
 制得的
制得的 样品,加水溶解,并加入稀
样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;ii.加入过量
 粉,反应完全后,弃去不溶物,向溶液中加入稀
粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用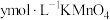 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:ⅱ中
 粉将铁元素全部还原为
粉将铁元素全部还原为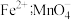 转化为
转化为 。
。①步骤ⅰ的目的是
②该样品中铁元素的质量分数是
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 以黄铜矿(主要成分为CuFeS2)为原料,用(NH4)2S2O8溶液作浸取剂提取铜。
已知:i.S2O 的结构式为
的结构式为 。
。
ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为___________ 。
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是___________ 。
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
①结合离子方程式解释添加Ag+ 可以显著提高Cu元素的浸出率的原因:___________ 。
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:___________ 。
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为___________ 。
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为___________ 。
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:___________ 。
已知:i.S2O
 的结构式为
的结构式为 。
。ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
| 添加Ag+ | 未加Ag+ | |
| Cu元素的浸出率 | 98.02% | 30.90% |
| 过程中产物形态 |  |  |
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:
您最近一年使用:0次
2024-02-23更新
|
221次组卷
|
3卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
解题方法
5 . 氮及其化合物在农业、医药、国防等领域应用广泛。请回答下列问题
(1)实验室加热 和
和  固体混合物制取
固体混合物制取  ,反应的化学方程式是
,反应的化学方程式是___________ 。
(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。
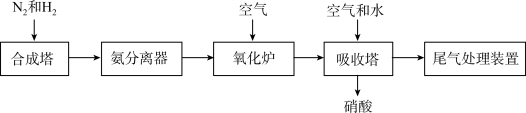
①合成塔中生成 ,说明
,说明  具有
具有___________ (填“氧化性”或“还原性”)。
②氧化炉中 转化为
转化为 ,发生反应的化学方程式是
,发生反应的化学方程式是___________ 。
③吸收塔中 最终可转化为
最终可转化为  。通入空气是为了提供
。通入空气是为了提供___________ (填字母)。
a. b.
b. c.
c.
④尾气处理装置中,可用 将尾气中
将尾气中  还原为
还原为  。反应的化学方程式是
。反应的化学方程式是___________ 。
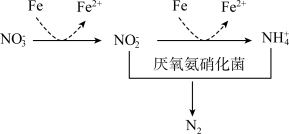
(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因___________ 。
(1)实验室加热
 和
和  固体混合物制取
固体混合物制取  ,反应的化学方程式是
,反应的化学方程式是(2)工业合成氨及氨氧化制取硝酸的流程示意图如下。

①合成塔中生成
 ,说明
,说明  具有
具有②氧化炉中
 转化为
转化为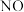 ,发生反应的化学方程式是
,发生反应的化学方程式是③吸收塔中
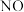 最终可转化为
最终可转化为  。通入空气是为了提供
。通入空气是为了提供a.
 b.
b. c.
c.
④尾气处理装置中,可用
 将尾气中
将尾气中  还原为
还原为  。反应的化学方程式是
。反应的化学方程式是(3)氮元素含量过高会造成水体污染,添加铁粉能够提高氮的脱除率,工艺如下图所示。试从价态角度分析原因

您最近一年使用:0次
6 . 钛(T)被称为“未来金属”,钛合金广泛应用于多个领域。
(1)工业上由钛铁矿(主要成分为 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图

① 元素在元素周期表的位置是
元素在元素周期表的位置是_______ 。
②基态 原子的简化电子排布式是
原子的简化电子排布式是_______ 。
③补全反应器中发生反应的化学方程式:_______ 。

④由合成器得到的粗产品是 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于_______  即可。
即可。
(2)超高硬度生物材料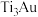 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。

① 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有_______ 个。
② 的晶胞边长为
的晶胞边长为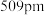 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是_______  (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,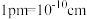 )
)
③与 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的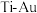 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是_______ (填“ ”或“
”或“ ”)。
”)。
(1)工业上由钛铁矿(主要成分为
 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图
①
 元素在元素周期表的位置是
元素在元素周期表的位置是②基态
 原子的简化电子排布式是
原子的简化电子排布式是③补全反应器中发生反应的化学方程式:

④由合成器得到的粗产品是
 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于 即可。
即可。 |  |  |  | |
熔点/ |  | 648.8 | 714 | 1667 |
沸点/ | 136.4 | 1090 | 1412 | 3287 |
(2)超高硬度生物材料
 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。
①
 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有②
 的晶胞边长为
的晶胞边长为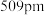 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是 (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
, )
)③与
 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
名校
7 . X、Y、Z、W、M为五种短周期元素,且原子序数依次增大。X与W、Z与M分别同主族,M的原子最外层电子数比次外层少2个。X与Y可以按照原子个数比3:1形成化合物A,1个A分子中含有10个电子。请回答:
(1)Y在周期表中的位置是___________ 。
(2)甲、乙、丙为三种强电解质,分别由上述五种元素中的三种组成。甲、乙、丙的稀溶液之间存在如下转化关系:

①乙、丙溶液混合加热的离子方程式为:___________ 。
②金属Cu与甲、乙的混合溶液反应的离子方程式为:___________ 。
(3)化合物WY3是合成抗禽流感药物“达菲”的中间物质,WY3受撞击会生成一种非金属单质和一种化合物W3Y,请写出该反应的化学方程式___________ 。若反应生成标准状况下33.6L气体单质,则电子转移的物质的量为___________ mol。
(1)Y在周期表中的位置是
(2)甲、乙、丙为三种强电解质,分别由上述五种元素中的三种组成。甲、乙、丙的稀溶液之间存在如下转化关系:

①乙、丙溶液混合加热的离子方程式为:
②金属Cu与甲、乙的混合溶液反应的离子方程式为:
(3)化合物WY3是合成抗禽流感药物“达菲”的中间物质,WY3受撞击会生成一种非金属单质和一种化合物W3Y,请写出该反应的化学方程式
您最近一年使用:0次
8 . 硫酸亚铁晶体( )是一种重要的无机化工原料,应用广泛。
)是一种重要的无机化工原料,应用广泛。
Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的红渣(主要成分为 ,含有少量
,含有少量 等)为原料生产硫酸亚铁晶体的工艺流程如下。
等)为原料生产硫酸亚铁晶体的工艺流程如下。
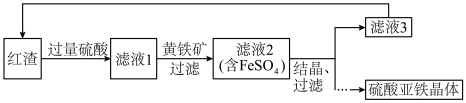
(1)红渣和硫酸发生反应的离子方程式是______ 。
(2)硫酸浸取后过滤,滤渣中含有______ (填化学式)。
(3)黄铁矿的主要成分是 ,其作用是
,其作用是______ 。
(4)流程中可循环利用的物质有______ 、 。
。
(5)若用含 的滤液3制备
的滤液3制备 ,可选用的试剂是
,可选用的试剂是______ 和______ 。
(6)产品纯度测定
已知:
取 硫酸亚铁晶体产品,用稀
硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入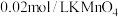 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液
溶液 。
。 的质量分数是
的质量分数是______ ( 的摩尔质量是
的摩尔质量是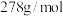 )。
)。
Ⅱ.用制备颜料铵铁蓝.
(7) 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式:____
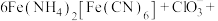 ______
______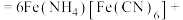 ______+______+______
______+______+______
 )是一种重要的无机化工原料,应用广泛。
)是一种重要的无机化工原料,应用广泛。Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的红渣(主要成分为
 ,含有少量
,含有少量 等)为原料生产硫酸亚铁晶体的工艺流程如下。
等)为原料生产硫酸亚铁晶体的工艺流程如下。
(1)红渣和硫酸发生反应的离子方程式是
(2)硫酸浸取后过滤,滤渣中含有
(3)黄铁矿的主要成分是
 ,其作用是
,其作用是(4)流程中可循环利用的物质有
 。
。(5)若用含
 的滤液3制备
的滤液3制备 ,可选用的试剂是
,可选用的试剂是(6)产品纯度测定
已知:

取
 硫酸亚铁晶体产品,用稀
硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入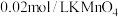 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液
溶液 。
。 的质量分数是
的质量分数是 的摩尔质量是
的摩尔质量是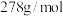 )。
)。Ⅱ.用制备颜料铵铁蓝.
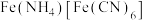
(7)
 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和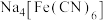 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀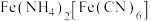 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式: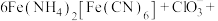 ______
______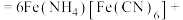 ______+______+______
______+______+______
您最近一年使用:0次
9 . 工业上,常用以下方法处理硫化氢废气。
Ⅰ.高温热分解法,即在恒温、恒压条件下,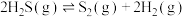
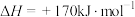
(1)下列不能 作为该反应达到平衡状态的标志的是_____。(填字母)
(2)达到平衡状态后,通入氩气,分析 平衡转化率的变化及原因
平衡转化率的变化及原因_____ 。
(3)为提高 转化率,常用
转化率,常用 作催化剂,经过相同时间测定
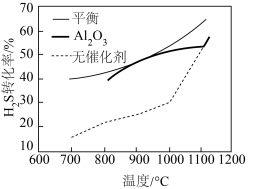
作催化剂,经过相同时间测定 的转化率与温度的关系如图,在
的转化率与温度的关系如图,在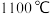 以后,有无催化剂
以后,有无催化剂 的转化率几乎相等,其原因是
的转化率几乎相等,其原因是_____ 。
II. 溶液脱除法,即将含有
溶液脱除法,即将含有 的废气通入
的废气通入 溶液中
溶液中
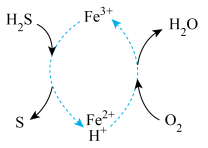
(4)脱除并再生的原理如图,写出总反应的化学方程式_____ 。
(5)如图所示,反应相同时间时,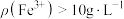 时
时 脱除率下降,推测可能的原因为
脱除率下降,推测可能的原因为_____ 。

(6)当废气中硫化氢浓度较低时,常用纯碱溶液吸收,结合表中数据计算该反应的平衡常数_____ 。
Ⅰ.高温热分解法,即在恒温、恒压条件下,
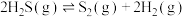
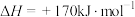
(1)下列
A. 在体系中质量分数保持不变 在体系中质量分数保持不变 |
| B.气体的平均相对分子质量不再变化 |
| C.气体密度不再变化 |
D. 的消耗速率与 的消耗速率与 的消耗速率之比为 的消耗速率之比为 |
(2)达到平衡状态后,通入氩气,分析
 平衡转化率的变化及原因
平衡转化率的变化及原因(3)为提高
 转化率,常用
转化率,常用 作催化剂,经过相同时间测定
作催化剂,经过相同时间测定 的转化率与温度的关系如图,在
的转化率与温度的关系如图,在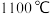 以后,有无催化剂
以后,有无催化剂 的转化率几乎相等,其原因是
的转化率几乎相等,其原因是
II.
 溶液脱除法,即将含有
溶液脱除法,即将含有 的废气通入
的废气通入 溶液中
溶液中(4)脱除并再生的原理如图,写出总反应的化学方程式

(5)如图所示,反应相同时间时,
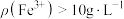 时
时 脱除率下降,推测可能的原因为
脱除率下降,推测可能的原因为
(6)当废气中硫化氢浓度较低时,常用纯碱溶液吸收,结合表中数据计算该反应的平衡常数
| 酸(常温下) |  |  |
 |  | 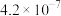 |
 | 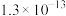 | 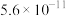 |
您最近一年使用:0次
名校
10 . Ⅰ.工业上常用电解 溶液制备
溶液制备 ,反应方程式如下:
,反应方程式如下: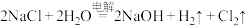 。回答下列问题:
。回答下列问题:
(1)用 的
的 溶液进行电解制备
溶液进行电解制备 。
。
①该 溶液中
溶液中 的物质的量是
的物质的量是_______  ;
;
②标准状况下,理论上最多能产生
_______ L;
③该反应中两种气体产物的质量比是_______ ;
④当 恰好完全反应时,停止电解,把所得溶液稀释到
恰好完全反应时,停止电解,把所得溶液稀释到 ,则所得
,则所得 溶液的物质的量浓度为
溶液的物质的量浓度为_______  。
。
(2)写出该反应的离子方程式_______ 。
Ⅱ.我国科学家用 人工合成淀粉时,第一步需要将
人工合成淀粉时,第一步需要将 转化为甲醇,反应的化学方程式为:
转化为甲醇,反应的化学方程式为: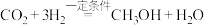 。
。
(3)做还原剂的物质是_______ ;
(4)反应中每生成 ,消耗
,消耗 的物质的量是
的物质的量是_______  ,转移电子的物质的量是
,转移电子的物质的量是_______  。
。
(5)对于反应: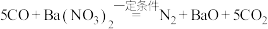 。
。
①发生还原反应的物质为_______ ;
②若有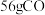 参与反应,则反应中转移的电子的物质的量为
参与反应,则反应中转移的电子的物质的量为_______  。
。
 溶液制备
溶液制备 ,反应方程式如下:
,反应方程式如下: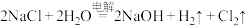 。回答下列问题:
。回答下列问题:(1)用
 的
的 溶液进行电解制备
溶液进行电解制备 。
。①该
 溶液中
溶液中 的物质的量是
的物质的量是 ;
;②标准状况下,理论上最多能产生

③该反应中两种气体产物的质量比是
④当
 恰好完全反应时,停止电解,把所得溶液稀释到
恰好完全反应时,停止电解,把所得溶液稀释到 ,则所得
,则所得 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(2)写出该反应的离子方程式
Ⅱ.我国科学家用
 人工合成淀粉时,第一步需要将
人工合成淀粉时,第一步需要将 转化为甲醇,反应的化学方程式为:
转化为甲醇,反应的化学方程式为: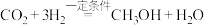 。
。(3)做还原剂的物质是
(4)反应中每生成
 ,消耗
,消耗 的物质的量是
的物质的量是 ,转移电子的物质的量是
,转移电子的物质的量是 。
。(5)对于反应:
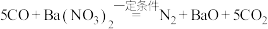 。
。①发生还原反应的物质为
②若有
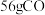 参与反应,则反应中转移的电子的物质的量为
参与反应,则反应中转移的电子的物质的量为 。
。
您最近一年使用:0次