名校
1 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为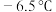 ,沸点为
,沸点为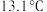 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,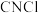 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到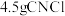 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为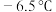 ,沸点为
,沸点为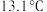 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。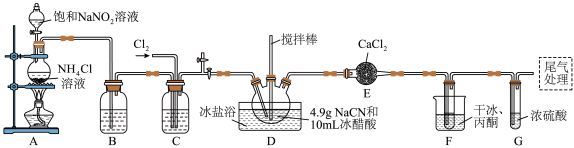
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为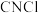 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到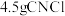 ,则产率为
,则产率为
您最近一年使用:0次
解题方法
2 . 氮化钛(TiN)是一种金黄色固体,熔点高、硬度大、且具有较高的导电性和超导性,可用于制备高温结构材料和超导材料。某实验小组以二氧化钛固体( )为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:
)为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:___________ 。
(2)已知在800℃时,装置C中反应生成TiN、 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(3)装置D的主要作用是___________ 。
(4)实验中部分操作如下:
①反应前,称取 样品;②打开装置A中仪器a的旋塞;
样品;②打开装置A中仪器a的旋塞;
③关闭装置A中仪器a的旋塞;④打开管式炉加热开关,加热至800℃左右;
⑤关闭管式炉加热开关,待装置冷却;⑥反应后,称得瓷舟中固体质量为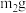 。
。
正确的操作顺序为:①→___________ →⑥(填标号)。
(5)经测定该方法制备的TiN纯度不高,原因可能是___________ 。
(6)TiN的晶胞结构如图所示,其晶胞参数为0.423nm,设 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为___________  。(列出计算式)
。(列出计算式)
 )为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题:
)为原料制备TiN,实验装置如下图所示,夹持仪器已略去。回答下列问题: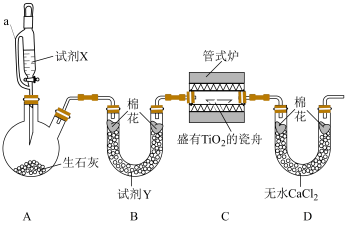
(2)已知在800℃时,装置C中反应生成TiN、
 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为(3)装置D的主要作用是
(4)实验中部分操作如下:
①反应前,称取
 样品;②打开装置A中仪器a的旋塞;
样品;②打开装置A中仪器a的旋塞;③关闭装置A中仪器a的旋塞;④打开管式炉加热开关,加热至800℃左右;
⑤关闭管式炉加热开关,待装置冷却;⑥反应后,称得瓷舟中固体质量为
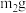 。
。正确的操作顺序为:①→
(5)经测定该方法制备的TiN纯度不高,原因可能是
(6)TiN的晶胞结构如图所示,其晶胞参数为0.423nm,设
 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为 。(列出计算式)
。(列出计算式)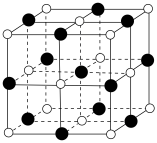
您最近一年使用:0次
名校
解题方法
3 . 钼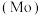 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;
②钼酸铵 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。
(1)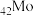 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为__________ 。
(2)“焙烧”中 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:________________ 。
(3)下列说法正确的是__________(填标号)。
(4)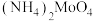 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。
(5)经过结晶、过滤、洗涤、干燥等操作得到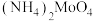 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为__________ 。
(6)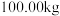 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为 )通过该工艺最终得到
)通过该工艺最终得到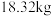 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为__________  。(保留一位小数,产率=
。(保留一位小数,产率=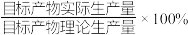 )
)
(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为__________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为__________
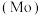 及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和
及其化合物广泛应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 的形式存在,从镍钼矿中分离钼的一种工艺流程如图。
的形式存在,从镍钼矿中分离钼的一种工艺流程如图。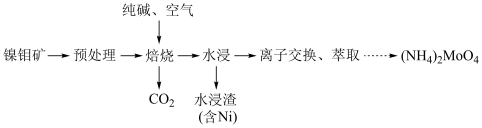
 在“焙烧”过程中转化为
在“焙烧”过程中转化为 ;
;②钼酸铵
 为白色晶体,具有很高的水溶性,不溶于乙醇。
为白色晶体,具有很高的水溶性,不溶于乙醇。(1)
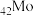 与
与 同族,基态
同族,基态 原子的价层电子排布式为
原子的价层电子排布式为(2)“焙烧”中
 元素转化为
元素转化为 ,同时有
,同时有 生成,写出
生成,写出 在“焙烧”时发生反应的化学方程式:
在“焙烧”时发生反应的化学方程式:(3)下列说法正确的是__________(填标号)。
A.电负性: |
B.离子半径: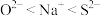 |
C.第一电离能: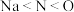 |
D.基态 中成对电子数与未成对电子数之比为 中成对电子数与未成对电子数之比为 |
(4)
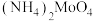 中存在的相互作用有__________(填标号)。
中存在的相互作用有__________(填标号)。| A.分子间作用力 | B.金属键 |
| C.共价键 | D.离子键 |
(5)经过结晶、过滤、洗涤、干燥等操作得到
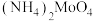 ,洗涤时所选用的最佳试剂为
,洗涤时所选用的最佳试剂为(6)
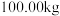 该镍钼矿(
该镍钼矿( 元素的质量分数为
元素的质量分数为 )通过该工艺最终得到
)通过该工艺最终得到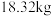 钼酸铵产品,则该工艺中钼酸铵的产率为
钼酸铵产品,则该工艺中钼酸铵的产率为 。(保留一位小数,产率=
。(保留一位小数,产率=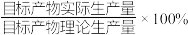 )
)(7)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在
 原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为
原子立方晶格的八面体空隙中,晶胞结构如图所示。氮化钼的化学式为 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为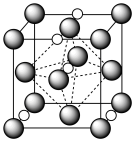
您最近一年使用:0次
7日内更新
|
115次组卷
|
2卷引用:2024届山西省晋城市高三下学期第三次模拟考试理科综合试题-高中化学
解题方法
4 .  无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用
无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co属于元素周期表___________ 区(填“s”“p”或“d”),基态Co原子核外电子共有___________ 种不同的空间运动状态。
(2)已知烧渣是LiCl、 和
和 的混合物,则“焙烧”时发生反应的化学方程式为
的混合物,则“焙烧”时发生反应的化学方程式为___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用的实验方法名称是
常用的实验方法名称是___________ 。
(4)常温下,已知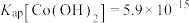 ,钴离子沉淀完全时
,钴离子沉淀完全时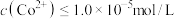 ,则“沉钴”时应控制pH≥
,则“沉钴”时应控制pH≥___________ 。(已知: ,结果保留两位小数)
,结果保留两位小数)
(5) 极易水解,生成中间体
极易水解,生成中间体 (
( )和第一步水解产物
)和第一步水解产物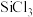 (OH)的机理如下:
(OH)的机理如下: 的离子方程式:
的离子方程式:___________ ;
② 比
比 易水解的原因可能是
易水解的原因可能是___________ (答一点即可)。
(6)已知 与
与 分子结构相似,与
分子结构相似,与 互溶,极易水解。选择合适仪器并组装蒸馏装置对
互溶,极易水解。选择合适仪器并组装蒸馏装置对 、
、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号),先馏出的物质为___________ 。
 无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用
无色、有刺激性气味,常温常压下为液态,沸点57.5℃。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: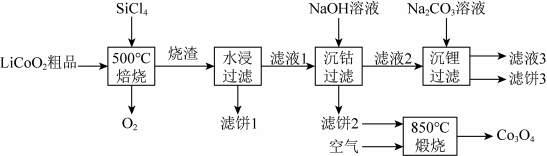
(1)Co属于元素周期表
(2)已知烧渣是LiCl、
 和
和 的混合物,则“焙烧”时发生反应的化学方程式为
的混合物,则“焙烧”时发生反应的化学方程式为(3)鉴别洗净的“滤饼3”和固体
 常用的实验方法名称是
常用的实验方法名称是(4)常温下,已知
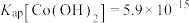 ,钴离子沉淀完全时
,钴离子沉淀完全时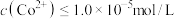 ,则“沉钴”时应控制pH≥
,则“沉钴”时应控制pH≥ ,结果保留两位小数)
,结果保留两位小数)(5)
 极易水解,生成中间体
极易水解,生成中间体 (
( )和第一步水解产物
)和第一步水解产物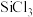 (OH)的机理如下:
(OH)的机理如下: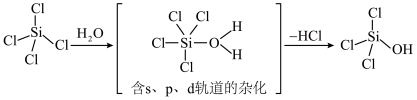
 的离子方程式:
的离子方程式:②
 比
比 易水解的原因可能是
易水解的原因可能是(6)已知
 与
与 分子结构相似,与
分子结构相似,与 互溶,极易水解。选择合适仪器并组装蒸馏装置对
互溶,极易水解。选择合适仪器并组装蒸馏装置对 、
、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧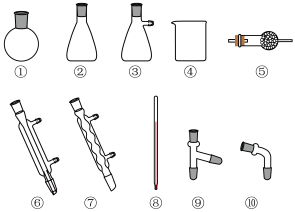
您最近一年使用:0次
解题方法
5 . 冶炼金属产生的酸泥属于有价值危险物。从某酸泥(含 单质,
单质, 及
及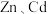 的化合物等)中回收汞和硒的一种工艺如图:
的化合物等)中回收汞和硒的一种工艺如图: 如下表所示:
如下表所示:
回答下列问题:
(1)“氧化浸出”时,酸泥中硒、汞、锌、镉分别以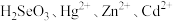 形式进入溶液。
形式进入溶液。
①基态 原子核外电子的运动状态有
原子核外电子的运动状态有_______ 种, 中
中 原子杂化类型为
原子杂化类型为_______ 。
②不溶于水的 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为_____ ,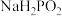 加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的
加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的_____ 倍。
(3)①“沉硒”时“气液逆流”的目的是_______ 。
②已知: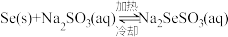 ,粗硒中的杂质不溶于
,粗硒中的杂质不溶于 溶液。利用该原理对粗硒进行提纯:将粗硒投入
溶液。利用该原理对粗硒进行提纯:将粗硒投入______ 中,待硒充分溶解后_____ ,冷却析出硒,再过滤、洗涤、干燥。
(4)为使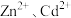 完全沉淀,“中和”时需调节溶液的
完全沉淀,“中和”时需调节溶液的 范围为
范围为____ ,所得“中和液”中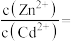
_______ 。
 单质,
单质, 及
及 的化合物等)中回收汞和硒的一种工艺如图:
的化合物等)中回收汞和硒的一种工艺如图: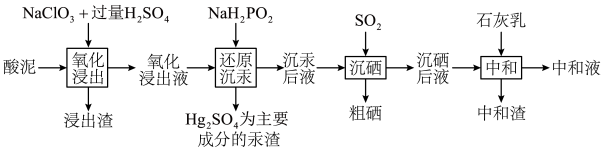
 如下表所示:
如下表所示:| 氢氧化物 |  | |||
开始沉淀 | 完全沉淀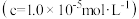 | 沉淀 开始溶解 | 沉淀 完全溶解 | |
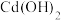 | 8.2 | 9.7 | — | — |
 | 6.5 | 8.0 | 10.5 | 12~13 |
(1)“氧化浸出”时,酸泥中硒、汞、锌、镉分别以
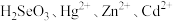 形式进入溶液。
形式进入溶液。①基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 中
中 原子杂化类型为
原子杂化类型为②不溶于水的
 被氧化的离子方程式为
被氧化的离子方程式为(2)沉汞后液中磷以最高价形式存在。“还原沉汞”的主要反应中,氧化剂和还原剂的物质的量之比为
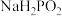 加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的
加入量对沉汞效果的影响如下表所示,则其最适宜加入量是汞量的 加入量 加入量 | 沉汞率 | 汞渣含 | 沉硒率 |
| 汞量的1.0倍 | 68.42 | 57.80 | 1.23 |
| 汞量的1.25倍 | 85.93 | 66.30 | 1.77 |
| 汞量的1.5倍 | 99.53 | 78.84 | 2.95 |
| 汞量的1.75倍 | 99.70 | 70.80 | 5.23 |
| 汞量的2.0倍 | 99.72 | 60.84 | 6.59 |
(3)①“沉硒”时“气液逆流”的目的是
②已知:
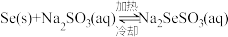 ,粗硒中的杂质不溶于
,粗硒中的杂质不溶于 溶液。利用该原理对粗硒进行提纯:将粗硒投入
溶液。利用该原理对粗硒进行提纯:将粗硒投入(4)为使
 完全沉淀,“中和”时需调节溶液的
完全沉淀,“中和”时需调节溶液的 范围为
范围为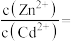
您最近一年使用:0次
解题方法
6 .  是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。
是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过途径Ⅱ脱除,写出反应方程式
通过途径Ⅱ脱除,写出反应方程式___________ ;若反应Ⅳ中 与
与 等物质的量反应,则得到的无机酯结构简式为:
等物质的量反应,则得到的无机酯结构简式为:___________ 。
(2)反应Ⅲ为: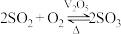 ,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为
,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为___________ 。 及
及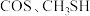 等多种有机硫,其中
等多种有机硫,其中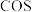 的电子式为
的电子式为___________ ;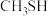 (沸点为
(沸点为 )的燃烧热为
)的燃烧热为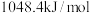 ,则体现其燃烧热的热化学方程式为:
,则体现其燃烧热的热化学方程式为:___________ 。
(4)工业生产中利用 浓硫酸代替水吸收
浓硫酸代替水吸收 ,主要原因是:
,主要原因是:___________ 。 也可用
也可用 表示,其对应的盐
表示,其对应的盐 是重要的化工试剂,其一种工业生产和应用如图所示:
是重要的化工试剂,其一种工业生产和应用如图所示:___________ (填“酸性”、“中性”或“碱性”),用离子方程式表明原因___________ ; 与磁铁矿发生反应产生的
与磁铁矿发生反应产生的 的化学方程式为
的化学方程式为___________ 。
 是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。
是大气污染物,其主要来源途径为工业上含硫矿物煅烧,可以按如下流程脱除或利用。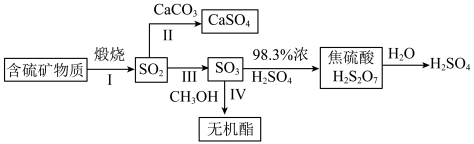
已知: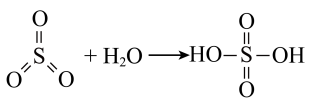
(1)富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过途径Ⅱ脱除,写出反应方程式
通过途径Ⅱ脱除,写出反应方程式 与
与 等物质的量反应,则得到的无机酯结构简式为:
等物质的量反应,则得到的无机酯结构简式为:(2)反应Ⅲ为:
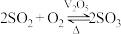 ,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为
,催化氧化过程中钒元素的变化如图所示,则过程c发生反应的化学方程式为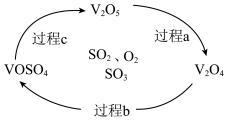
 及
及 等多种有机硫,其中
等多种有机硫,其中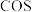 的电子式为
的电子式为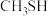 (沸点为
(沸点为 )的燃烧热为
)的燃烧热为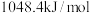 ,则体现其燃烧热的热化学方程式为:
,则体现其燃烧热的热化学方程式为:(4)工业生产中利用
 浓硫酸代替水吸收
浓硫酸代替水吸收 ,主要原因是:
,主要原因是: 也可用
也可用 表示,其对应的盐
表示,其对应的盐 是重要的化工试剂,其一种工业生产和应用如图所示:
是重要的化工试剂,其一种工业生产和应用如图所示: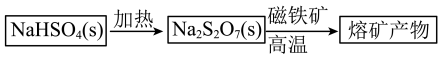
 与磁铁矿发生反应产生的
与磁铁矿发生反应产生的 的化学方程式为
的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 氯化六氨合钴{ }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: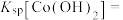
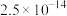 、
、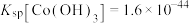 、
、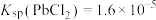 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,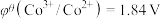 、
、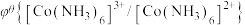
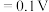 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是___________ (填仪器名称)。___________ ;控制反应温度在55℃的原因为___________ 。
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度___________ (填“大于”“小于”或“等于”)在浓盐酸中的。
(4)与步骤三中过滤相比,步骤四中抽滤的优点为___________ 。
(5)制备产品的总反应方程式为___________ ;步骤二中双氧水可用PbO2或KMnO4代替,其中更适合选用___________ (填化学式)代替双氧水,原因为___________ 。
(6)本实验所得产品的产率为___________ (列出计算式)。
 }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: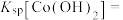
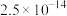 、
、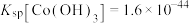 、
、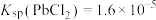 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,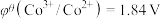 、
、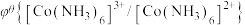
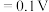 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度
(4)与步骤三中过滤相比,步骤四中抽滤的优点为
(5)制备产品的总反应方程式为
(6)本实验所得产品的产率为
您最近一年使用:0次
2024-05-16更新
|
165次组卷
|
3卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
解题方法
8 .  还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。
 还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。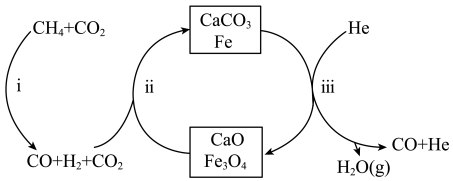
A.该反应的催化剂为 和 和 |
| B.过程iii在恒压条件下通入He,有利于增加CO的产量 |
| C.过程i、ii、iii均涉及置换反应 |
D.每生成4mol的CO,转移的电子数约为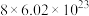 |
您最近一年使用:0次
名校
9 . 铜是使用广泛的一种金属。下图是某高砷银铜精矿制取铜、银的工艺。该矿石的主要成分是CuS,还含有Ag、As、Ca、Si、Al等的化合物。
①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②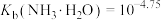 。
。
③萃取原理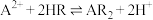 。
。
回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为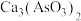 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式___________ 。
(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是___________ 。
(3)写出氨浸铜反应的离子方程式___________ 。氨铵比1:1时氨浸铜效果最好,此时溶液pH=___________ 。
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为___________ ,萃取时萃取剂分子中___________ 键断裂。___________ 。
(6)浸银液含 ,还原时氧化产物为
,还原时氧化产物为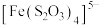 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为___________ 。

①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②
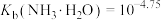 。
。③萃取原理
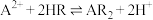 。
。回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为
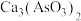 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是
(3)写出氨浸铜反应的离子方程式
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为
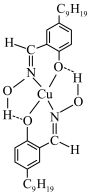
(6)浸银液含
 ,还原时氧化产物为
,还原时氧化产物为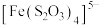 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
2024-04-21更新
|
192次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
名校
10 . SrCO3广泛应用于许多领域。以天青石(主要成分为SrSO4,还含有Al、Si、Ba的化合物)为原料制备SrCO3的一种工艺方法如下:

| A.SrSO4和碳粉“煅烧”生成SrS和碳氧化物,当只生成CO时,SrSO4和C的质量比为23:3 |
| B.“煅烧”过程可能生成少量SO2 |
C.滤渣主要含有BaS、SiO2、 、C等 、C等 |
D.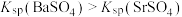 |
您最近一年使用:0次
2024-04-21更新
|
175次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题



