名校
1 . 氯化亚铜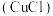 常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:
常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:
①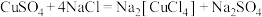 ;
;
② 。
。
下列说法错误的是
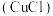 常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:
常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:①
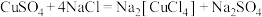 ;
;②
 。
。下列说法错误的是
| A.反应①为非氧化还原反应,反应②为氧化还原反应 |
B. 中铜元素的化合价为 中铜元素的化合价为 价 价 |
| C.反应①②涉及的物质中有一种酸性氧化物 |
D.每转移 电子、生成 电子、生成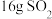 |
您最近一年使用:0次
2023-12-01更新
|
187次组卷
|
6卷引用:山西省2023-2024学年高一上学期12月联合考试化学试题
2 . 氯气是一种重要的化工原料,可用于生产塑料、合成纤维和染料等。实验室某实验小组现用下图装置来制取氯气并对氯气的某些性质和用途进行探究(K为开关,夹持装置已省略)。请回答下列问题:
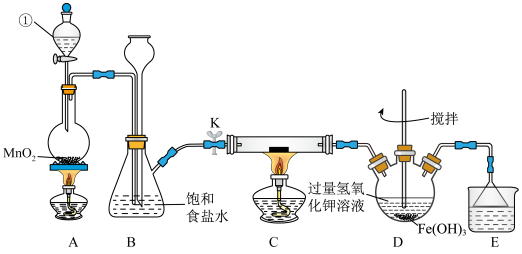
(1)仪器①的名称为___________ 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,若___________ ,则说明装置气密性良好。
(3)装置A中发生反应的化学方程式为___________ ,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)装置E中的试剂是___________ ,作用是___________ 。
(5)装置C中为湿润的KI-淀粉试纸,通入 后试纸变蓝,则该反应的离子方程式为
后试纸变蓝,则该反应的离子方程式为___________ ;该小组为了研究干燥的氯气与金属钠之间的反应,欲在装置C中直接放置一块纯净的金属钠进行实验,该方案存在不妥之处,请你指出不妥之处并改正:___________ 。
(6)高铁酸盐是一种新型强氧化剂,在电池材料和水处理等方面具有广泛的应用前景。上图中的装置D可用于实验室制备高铁酸钾( ),反应原理如下,请用单线桥表示出该反应的电子转移情况:
),反应原理如下,请用单线桥表示出该反应的电子转移情况:
_________ 。

(1)仪器①的名称为
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,若
(3)装置A中发生反应的化学方程式为
(4)装置E中的试剂是
(5)装置C中为湿润的KI-淀粉试纸,通入
 后试纸变蓝,则该反应的离子方程式为
后试纸变蓝,则该反应的离子方程式为(6)高铁酸盐是一种新型强氧化剂,在电池材料和水处理等方面具有广泛的应用前景。上图中的装置D可用于实验室制备高铁酸钾(
 ),反应原理如下,请用单线桥表示出该反应的电子转移情况:
),反应原理如下,请用单线桥表示出该反应的电子转移情况:
您最近一年使用:0次
解题方法
3 . 8月1日起,为了国家信息安全,我国禁止镓和锗的出口,锗是一种重要的半导体材料,工业上用精硫锗矿(主要成分为 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示:
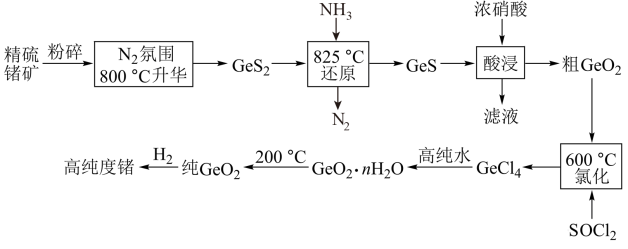
(1) 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为___________ 。
(2)800℃升华时通入 的目的是:
的目的是:___________ 、___________ 。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:___________ ,酸浸时温度不能过高的原因是___________ 。
(4) 易水解生成
易水解生成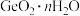 ,证明
,证明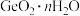 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是___________ 。
(5)测定错的含量:称取0.5500g锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下 ,能将
,能将 氧化为
氧化为 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:___________ 、___________ ,②该样品中储的质量分数是___________ %(精确到0.01%)。
 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示:
(1)
 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为(2)800℃升华时通入
 的目的是:
的目的是:(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:
(4)
 易水解生成
易水解生成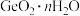 ,证明
,证明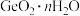 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是(5)测定错的含量:称取0.5500g锗样品,加入双氧水溶解,再加入盐酸生成
 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下 ,能将
,能将 氧化为
氧化为 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:
您最近一年使用:0次
名校
4 . 有以下物质:①石墨②铁③蔗糖④一氧化碳⑤氯化铁固体⑥碳酸氢钠固体⑦氢氧化钡溶液⑧ ⑨熔融氯化钠⑩液态氯化氢
⑨熔融氯化钠⑩液态氯化氢
(1)其中能导电的是___________ (填序号,下同);属于非电解质的是___________ ;属于弱电解质的是___________ 。
(2)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式:___________ 。
(3)写出用⑤的饱和溶液制备 胶体的化学方程式:
胶体的化学方程式:___________ 。
(4)已知 易溶于水,外观和食盐相似,有咸味,人误食会中毒。
易溶于水,外观和食盐相似,有咸味,人误食会中毒。 能发生反应:
能发生反应: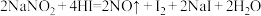 。淀粉遇碘单质会变蓝色,则鉴别
。淀粉遇碘单质会变蓝色,则鉴别 固体和NaCl固体,选用的物质为
固体和NaCl固体,选用的物质为___________ (填标号)。
a.水 b.淀粉―碘化钾溶液 c.白醋 d.白酒
某工厂的废液中含有2%~5%的 ,直接排放会造成污染。下列试剂中:a.NaCl;b.
,直接排放会造成污染。下列试剂中:a.NaCl;b. ;c.
;c. ;d.浓
;d.浓 ,能使
,能使 转化为
转化为 的是
的是___________ (填序号)。
(5)酸性条件下,加热 和
和 混合溶液制备
混合溶液制备 ,同时产生一种黄绿色气体,该反应的离子方程式
,同时产生一种黄绿色气体,该反应的离子方程式___________ 。
(6)NaCN不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体 ,二者溶于水均呈碱性,该反应的离子方程式为
,二者溶于水均呈碱性,该反应的离子方程式为___________ 。
 ⑨熔融氯化钠⑩液态氯化氢
⑨熔融氯化钠⑩液态氯化氢(1)其中能导电的是
(2)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式:
(3)写出用⑤的饱和溶液制备
 胶体的化学方程式:
胶体的化学方程式:(4)已知
 易溶于水,外观和食盐相似,有咸味,人误食会中毒。
易溶于水,外观和食盐相似,有咸味,人误食会中毒。 能发生反应:
能发生反应: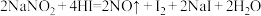 。淀粉遇碘单质会变蓝色,则鉴别
。淀粉遇碘单质会变蓝色,则鉴别 固体和NaCl固体,选用的物质为
固体和NaCl固体,选用的物质为a.水 b.淀粉―碘化钾溶液 c.白醋 d.白酒
某工厂的废液中含有2%~5%的
 ,直接排放会造成污染。下列试剂中:a.NaCl;b.
,直接排放会造成污染。下列试剂中:a.NaCl;b. ;c.
;c. ;d.浓
;d.浓 ,能使
,能使 转化为
转化为 的是
的是(5)酸性条件下,加热
 和
和 混合溶液制备
混合溶液制备 ,同时产生一种黄绿色气体,该反应的离子方程式
,同时产生一种黄绿色气体,该反应的离子方程式(6)NaCN不慎泄露时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体
 ,二者溶于水均呈碱性,该反应的离子方程式为
,二者溶于水均呈碱性,该反应的离子方程式为
您最近一年使用:0次
5 . 氧化还原反应在生产、生活中有很多应用,回答下列问题:
(1)工业制取水煤气的反应为 ,其中水作
,其中水作___________ (填“氧化剂”或“还原剂”)。下列反应中水的作用与上述反应中完全相同的是___________ (填标号)。
A. B.
B.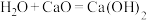
C.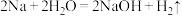 D.
D.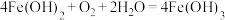
(2)高铁酸钾 是一种新型绿色消毒剂。
是一种新型绿色消毒剂。
①制备高铁酸钾时,先制备得到 ,反应为
,反应为 ,该反应的还原剂是
,该反应的还原剂是___________ (填化学式);每生成 ,转移的电子的物质的量为
,转移的电子的物质的量为___________  。
。
②低温下,向高铁酸钠溶液中加入 至饱和可制得高铁酸钾
至饱和可制得高铁酸钾 固体,请解释其原因:
固体,请解释其原因:___________ 。
(3)氯气溶于水形成了氯水,氯水具有强氧化性,氯水中,具有强氧化性的粒子为___________ (填离子符号或化学式),写出氯气与水反应的化学方程式:___________ 。
(1)工业制取水煤气的反应为
 ,其中水作
,其中水作A.
 B.
B.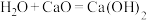
C.
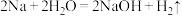 D.
D.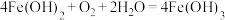
(2)高铁酸钾
 是一种新型绿色消毒剂。
是一种新型绿色消毒剂。①制备高铁酸钾时,先制备得到
 ,反应为
,反应为 ,该反应的还原剂是
,该反应的还原剂是 ,转移的电子的物质的量为
,转移的电子的物质的量为 。
。②低温下,向高铁酸钠溶液中加入
 至饱和可制得高铁酸钾
至饱和可制得高铁酸钾 固体,请解释其原因:
固体,请解释其原因:(3)氯气溶于水形成了氯水,氯水具有强氧化性,氯水中,具有强氧化性的粒子为
您最近一年使用:0次
名校
6 .  有高毒性,在溶液中以
有高毒性,在溶液中以 或
或 的形式存在,不同
的形式存在,不同 条件下两者可相互转化(
条件下两者可相互转化( )。常用还原法、微生物电化学法、沉淀法处理含
)。常用还原法、微生物电化学法、沉淀法处理含 的废水。
的废水。
(1)向废水中加入 或
或 等还原剂可将
等还原剂可将 还原为低毒性
还原为低毒性 ,再调节溶液
,再调节溶液 使
使 转化为
转化为 沉淀除去。
沉淀除去。
①酸性废水中 将
将 还原为
还原为 的离子方程式为
的离子方程式为___________ 。
②其他条件相同,在不改变所加铁屑总量的情况下,加入烟道灰(细小的活性炭),可增大 的去除率,其原因是
的去除率,其原因是___________ 。
(2)利用微生物电化学法可有效处理含有机物和 的酸性废水,其工作原理如图所示。
的酸性废水,其工作原理如图所示。
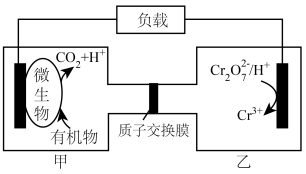
①若废水中的有机物是 ,则甲池中电极反应式为
,则甲池中电极反应式为___________ 。
②甲池产生 (标准状况)
(标准状况) 时,理论上乙池中
时,理论上乙池中 的物质的量减少
的物质的量减少___________ 。
(3)已知 易溶于水,
易溶于水, 难溶于水。利用沉淀法有效去除酸性废水中
难溶于水。利用沉淀法有效去除酸性废水中 的实验操作为
的实验操作为___________ 。
 有高毒性,在溶液中以
有高毒性,在溶液中以 或
或 的形式存在,不同
的形式存在,不同 条件下两者可相互转化(
条件下两者可相互转化( )。常用还原法、微生物电化学法、沉淀法处理含
)。常用还原法、微生物电化学法、沉淀法处理含 的废水。
的废水。(1)向废水中加入
 或
或 等还原剂可将
等还原剂可将 还原为低毒性
还原为低毒性 ,再调节溶液
,再调节溶液 使
使 转化为
转化为 沉淀除去。
沉淀除去。①酸性废水中
 将
将 还原为
还原为 的离子方程式为
的离子方程式为②其他条件相同,在不改变所加铁屑总量的情况下,加入烟道灰(细小的活性炭),可增大
 的去除率,其原因是
的去除率,其原因是(2)利用微生物电化学法可有效处理含有机物和
 的酸性废水,其工作原理如图所示。
的酸性废水,其工作原理如图所示。
①若废水中的有机物是
 ,则甲池中电极反应式为
,则甲池中电极反应式为②甲池产生
 (标准状况)
(标准状况) 时,理论上乙池中
时,理论上乙池中 的物质的量减少
的物质的量减少(3)已知
 易溶于水,
易溶于水, 难溶于水。利用沉淀法有效去除酸性废水中
难溶于水。利用沉淀法有效去除酸性废水中 的实验操作为
的实验操作为
您最近一年使用:0次
2023-11-19更新
|
292次组卷
|
3卷引用:山西省晋城市第一中学校2023-2024学年高二上学期第五次调研考试化学试题
名校
解题方法
7 . 下列说法中正确的个数为
①在氧化还原反应中,金属单质在反应中只能作还原剂
②在氧化还原反应中,非金属单质在反应中只能作氧化剂
③某元素从游离志变为化合态,则该元素一定被还原
④有单质参加或生成的化学反应不一定是氧化还原反应
⑤氧化还原反应中的反应物不是氧化剂就是还原剂
⑥氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
⑦阳离子只有氧化性,阴离子只有还原性
⑧在 中只有1种粒子不具有还原性
中只有1种粒子不具有还原性
⑨氧化剂与还原剂混合一定能发生氧化还原反应
⑩金属原子失电子数越多,金属的还原性越强
①在氧化还原反应中,金属单质在反应中只能作还原剂
②在氧化还原反应中,非金属单质在反应中只能作氧化剂
③某元素从游离志变为化合态,则该元素一定被还原
④有单质参加或生成的化学反应不一定是氧化还原反应
⑤氧化还原反应中的反应物不是氧化剂就是还原剂
⑥氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
⑦阳离子只有氧化性,阴离子只有还原性
⑧在
 中只有1种粒子不具有还原性
中只有1种粒子不具有还原性⑨氧化剂与还原剂混合一定能发生氧化还原反应
⑩金属原子失电子数越多,金属的还原性越强
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
名校
8 . 氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。下列变化涉及到氧化还原反应的有几个
①用石灰乳脱除烟气中的
②用盐酸去除铁锈(主要成分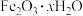 )
)
③用84消毒液(有效成分 )杀灭细菌
)杀灭细菌
④铜铸数像上出现铜绿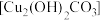
⑤用浸泡过高锰酸钾溶液的硅藻土保鲜水果
⑥谷物发酵酿造食醋
⑦大气中 参与酸雨形成
参与酸雨形成
⑧用赤铁矿石炼铁
⑨打磨磁石制指南针
①用石灰乳脱除烟气中的

②用盐酸去除铁锈(主要成分
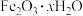 )
)③用84消毒液(有效成分
 )杀灭细菌
)杀灭细菌 ④铜铸数像上出现铜绿
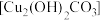
⑤用浸泡过高锰酸钾溶液的硅藻土保鲜水果
⑥谷物发酵酿造食醋
⑦大气中
 参与酸雨形成
参与酸雨形成 ⑧用赤铁矿石炼铁
⑨打磨磁石制指南针
| A.7个 | B.6个 | C.5个 | D.4个 |
您最近一年使用:0次
解题方法
9 . 某透明溶液中可能只存在Na+、Fe2+、Ba2+、NO 、CO
、CO 、HCO
、HCO 、SO
、SO 中的几种离子,现进行如下实验:
中的几种离子,现进行如下实验:
Ⅰ.取适量原溶液,向其中加入BaCl2溶液,无沉淀产生,继续滴加盐酸,严生无色的气体;
Ⅱ.另取适量原溶液,向其中逐滴滴入NaOH溶液,有沉淀a生成。
已知:①NO是一种无色气体;
②不考虑水电离出的H+和OH-;
③Fe2++NO +H+→Fe3++NO↑+H2O;
+H+→Fe3++NO↑+H2O;
④Fe2+与CO (或HCO
(或HCO )在同一溶液中不能大量共存;
)在同一溶液中不能大量共存;
⑤不考虑空气对反应的影响。
回答下列问题:
(1)仅由“取适量原溶液,向其中加入BaCl2溶液,无沉淀产生”可知,该溶液中一定不存在_______ (填离子符号),判断的理由为_______ (用离子方程式表示,写1个即可)。
(2)仅由“继续滴加盐酸,产生无色的气体”可知:
①原溶液中可能存在的离子有_______ (填标号)。
A.NO 、Fe2+ B.HCO
、Fe2+ B.HCO 、Fe2+ C.HCO
、Fe2+ C.HCO 、Na+、Ba2+ D.CO
、Na+、Ba2+ D.CO 、Fe2+、Na+、Ba2+
、Fe2+、Na+、Ba2+
②无色的气体可能是______ 。
③请配平离子方程式Fe2++NO +H+→Fe3++NO↑+H2O:
+H+→Fe3++NO↑+H2O:_______ 。
(3)若原溶液为绿色,则原溶液中一定存在的离子为________ (填离子符号)。
(4)往生成的沉淀a中加入稀盐酸,若有无色气体产生,此时发生反应的离子方程式为________ 。
 、CO
、CO 、HCO
、HCO 、SO
、SO 中的几种离子,现进行如下实验:
中的几种离子,现进行如下实验:Ⅰ.取适量原溶液,向其中加入BaCl2溶液,无沉淀产生,继续滴加盐酸,严生无色的气体;
Ⅱ.另取适量原溶液,向其中逐滴滴入NaOH溶液,有沉淀a生成。
已知:①NO是一种无色气体;
②不考虑水电离出的H+和OH-;
③Fe2++NO
 +H+→Fe3++NO↑+H2O;
+H+→Fe3++NO↑+H2O;④Fe2+与CO
 (或HCO
(或HCO )在同一溶液中不能大量共存;
)在同一溶液中不能大量共存;⑤不考虑空气对反应的影响。
回答下列问题:
(1)仅由“取适量原溶液,向其中加入BaCl2溶液,无沉淀产生”可知,该溶液中一定不存在
(2)仅由“继续滴加盐酸,产生无色的气体”可知:
①原溶液中可能存在的离子有
A.NO
 、Fe2+ B.HCO
、Fe2+ B.HCO 、Fe2+ C.HCO
、Fe2+ C.HCO 、Na+、Ba2+ D.CO
、Na+、Ba2+ D.CO 、Fe2+、Na+、Ba2+
、Fe2+、Na+、Ba2+②无色的气体可能是
③请配平离子方程式Fe2++NO
 +H+→Fe3++NO↑+H2O:
+H+→Fe3++NO↑+H2O:(3)若原溶液为绿色,则原溶液中一定存在的离子为
(4)往生成的沉淀a中加入稀盐酸,若有无色气体产生,此时发生反应的离子方程式为
您最近一年使用:0次
2023-11-04更新
|
91次组卷
|
2卷引用:山西省临汾市尧都区尧庙镇尧庙中学等2023-2024学年高一上学期10月月考化学试题
名校
解题方法
10 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
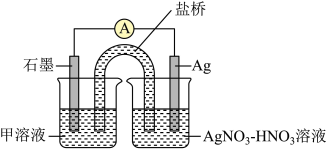
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
612次组卷
|
7卷引用:山西省部分学校2023-2024学年高三上学期10月月考(一轮复习联考(二))化学试题



