名校
1 . 碘酸钾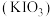 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。
下列说法错误的是
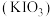 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。
 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。下列说法错误的是
A.水浴加热时发生反应的离子方程式为 |
| B.滴入适量乙醇的作用是除去多余的高锰酸钾 |
| C.为提高洗涤效果,可用热水进行洗涤 |
| D.在冷却结晶时,温度过低可能导致产品的纯度降低 |
您最近一年使用:0次
2 . 氧钒(Ⅳ)碱式碳酸铵晶体{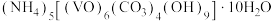 }的制备及纯度分析步骤如下。
}的制备及纯度分析步骤如下。
Ⅰ.制备氧钒(Ⅳ)碱式碳酸铵晶体的流程如下:
 碱式碳酸铵晶体
碱式碳酸铵晶体
其中,步骤ⅱ可通过如图装置完成。
实验步骤: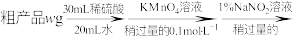
 再重复实验两次。
再重复实验两次。
已知:①氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,
②+4价钒在弱酸性条件下具有还原性。
③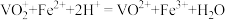 。
。
④在该实验条件下, 与尿素不反应。
与尿素不反应。
回答下列问题:
(1)从原子结构角度解释+5价钒较稳定的原因:_______ 。
(2)步骤ⅰ中 和
和 反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是
反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是_______ 。
(3)步骤ⅱ中盛装 溶液的仪器名称为
溶液的仪器名称为_______ 。
(4)步骤ⅱ中装置D的作用是_______ 。
(5)步骤ⅲ中依次用饱和 溶液无水乙醇、乙醚洗涤晶体,用饱和
溶液无水乙醇、乙醚洗涤晶体,用饱和 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
(6)分析测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品纯度的流程:
①滴入 溶液的目的是除去
溶液的目的是除去 ,写出其反应的离子方程式:
,写出其反应的离子方程式:_______ 。
②若平均消耗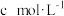
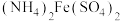 标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_______ %。
③若其他操作均正确,但 的加入量不足,会引起测定结果
的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
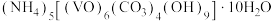 }的制备及纯度分析步骤如下。
}的制备及纯度分析步骤如下。Ⅰ.制备氧钒(Ⅳ)碱式碳酸铵晶体的流程如下:
 碱式碳酸铵晶体
碱式碳酸铵晶体其中,步骤ⅱ可通过如图装置完成。

实验步骤:
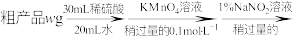
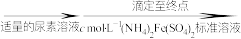 再重复实验两次。
再重复实验两次。已知:①氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,

②+4价钒在弱酸性条件下具有还原性。
③
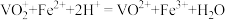 。
。④在该实验条件下,
 与尿素不反应。
与尿素不反应。回答下列问题:
(1)从原子结构角度解释+5价钒较稳定的原因:
(2)步骤ⅰ中
 和
和 反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是
反应得到的产物之一是一种无毒无害的气体,该反应中氧化剂与还原剂的物质的量之比是(3)步骤ⅱ中盛装
 溶液的仪器名称为
溶液的仪器名称为(4)步骤ⅱ中装置D的作用是
(5)步骤ⅲ中依次用饱和
 溶液无水乙醇、乙醚洗涤晶体,用饱和
溶液无水乙醇、乙醚洗涤晶体,用饱和 溶液洗涤的目的是
溶液洗涤的目的是(6)分析测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品纯度的流程:
①滴入
 溶液的目的是除去
溶液的目的是除去 ,写出其反应的离子方程式:
,写出其反应的离子方程式:②若平均消耗
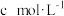
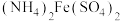 标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
标准溶液的体积为a mL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为③若其他操作均正确,但
 的加入量不足,会引起测定结果
的加入量不足,会引起测定结果
您最近一年使用:0次
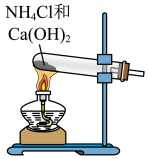
3 . 合成氨是人类科学技术发展史上的一项重大成就。实验室利用如右图所示装置及药品制取氨气:_____________ 。
(2)下列装置中,可用于收集氨的是_________ (填标号)。______________ 。
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g) 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
①2min内该反应的平均反应速率v(N2)=______ mol/(L·min)
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为____________ mol/L。
③能说明该反应已经达到平衡状态的是____________ 。
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为_____ 。
(2)下列装置中,可用于收集氨的是
a. 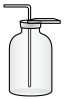 b.
b. 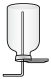 c.
c. 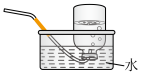
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g)
 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:①2min内该反应的平均反应速率v(N2)=
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为
③能说明该反应已经达到平衡状态的是
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
4 . 利用废旧锂电池可回收金属元素。已知废旧锂离子电池的主要成分为 以及
以及 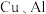 等单质,回收工艺流程如图:
等单质,回收工艺流程如图:
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
(2)“生化反应”后溶液中存在的主要阳离子有 、
、_______ 。“生化反应”最初使用的是 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为_______ ,使用细菌的优点是_______ 。
(3) 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因:_______ 。_______ 。
(5) (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 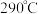 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 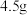 ,所得固体成分为
,所得固体成分为_______ (填化学式)。
(6)金属铜的晶胞如图所示,此晶胞的边长为 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ=_______ g∙cm-3 (用含  的代数式表示)。
的代数式表示)。
 以及
以及  等单质,回收工艺流程如图:
等单质,回收工艺流程如图: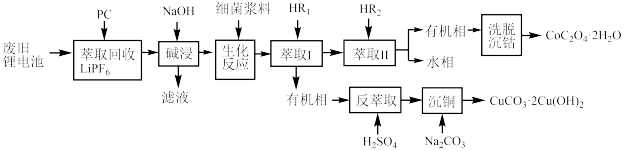
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
| A.漏斗 | B.胶头滴管 | C.分液漏斗 | D.蒸馏烧瓶 |
(2)“生化反应”后溶液中存在的主要阳离子有
 、
、 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为(3)
 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因: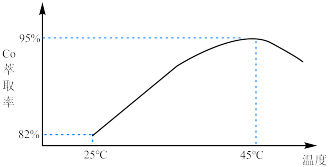
(5)
 (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 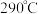 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 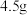 ,所得固体成分为
,所得固体成分为(6)金属铜的晶胞如图所示,此晶胞的边长为
 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ= 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
5 . 氢氧化铈  是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为
是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为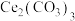 ]制备氢氧化铈的流程如图。下列说法
]制备氢氧化铈的流程如图。下列说法错误 的是
 是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为
是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为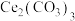 ]制备氢氧化铈的流程如图。下列说法
]制备氢氧化铈的流程如图。下列说法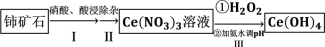
| A.铈是一种常见的稀土元素且属于金属元素 |
B.步骤Ⅰ中发生的反应为 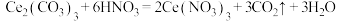 |
| C.步骤Ⅱ中用到的玻璃仪器有漏斗、烧杯、玻璃棒 |
D.步骤Ⅲ中参加反应的氧化剂与还原剂的物质的量之比为 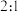 |
您最近一年使用:0次
名校
解题方法
6 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。河南焦作的山药富含硒( ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。
(1)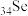 的原子结构示意图为
的原子结构示意图为______________ ,其在周期表中的位置为______________ 。
(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是______________ (填标号)。
A.还原性: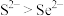
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性: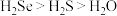
D.氧化性: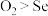
② 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为______________ ; 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为______________ 。
(3)某混合物中硒主要以 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将该混合物与浓硫酸混合焙烧,产生 、
、 的烟气
的烟气
ⅱ.用水吸收ⅰ中烟气,可得 固体
固体
已知: 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。
①可用足量 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为__________ 。
② 中
中 的化合价为
的化合价为_________ 价;焙烧时, 与浓
与浓 反应的化学方程式为
反应的化学方程式为_________________ ,理论上该反应每转移1 电子,得到的
电子,得到的 的质量为
的质量为_________ g。
 ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。(1)
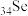 的原子结构示意图为
的原子结构示意图为(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是
A.还原性:
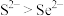
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性:
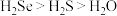
D.氧化性:
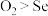
②
 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为(3)某混合物中硒主要以
 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将该混合物与浓硫酸混合焙烧,产生
 、
、 的烟气
的烟气ⅱ.用水吸收ⅰ中烟气,可得
 固体
固体已知:
 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。①可用足量
 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为②
 中
中 的化合价为
的化合价为 与浓
与浓 反应的化学方程式为
反应的化学方程式为 电子,得到的
电子,得到的 的质量为
的质量为
您最近一年使用:0次
2024-04-21更新
|
224次组卷
|
3卷引用:广西壮族自治区百所名校2023-2024学年高一下学期3月联合考试化学试题
解题方法
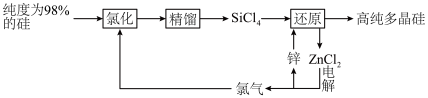
7 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在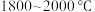 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成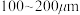 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯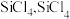 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为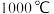 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融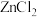 被电解成
被电解成 和
和 ,由此可知
,由此可知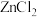 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗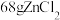 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在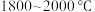 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
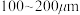 的粉末,这样做的目的是
的粉末,这样做的目的是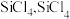 的电子式为
的电子式为(3)“还原”时的温度约为
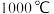 ,该反应的化学方程式为
,该反应的化学方程式为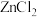 被电解成
被电解成 和
和 ,由此可知
,由此可知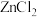 属于
属于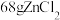 ,则生成
,则生成 。
。
您最近一年使用:0次
名校
解题方法
8 . 以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示:_____________ 。“滤渣1”的化学式为___________ 。
(2)“酸浸”时 与
与 反应的化学方程式为
反应的化学方程式为__________________ 。如果用浓盐酸代替硫酸和 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是______________________ (任答一点)。
(3)“操作2”所得副产品的一种用途为_____________ 。
(4)“沉钴”时温度不能太高,原因是_____________________________ 。
(5)“沉钴”步骤中同时还会产生 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_________________ 。
(6)实验室模拟“操作1”,需要将 转移到
转移到________ (填仪器名称)中加热分解,得到 。
。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示: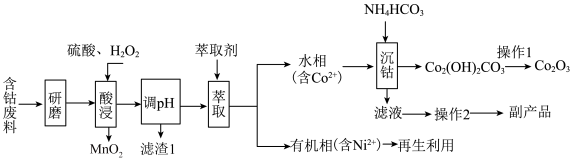
(2)“酸浸”时
 与
与 反应的化学方程式为
反应的化学方程式为 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是(3)“操作2”所得副产品的一种用途为
(4)“沉钴”时温度不能太高,原因是
(5)“沉钴”步骤中同时还会产生
 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(6)实验室模拟“操作1”,需要将
 转移到
转移到 。
。
您最近一年使用:0次
名校
解题方法
9 . 氮是自然界各种生物体生命活动不可缺少的重要元素,下列对氮的化合物进行性质探究实验:
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:_______________________ ,振荡注射器,再次观察现象,全过程发生的化学反应,用方程式表示为:___________________________ 。_______________________ 。
(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
①图1和图2的有孔隔板均可用于干燥气体,则X可为:_____________ 。
A.浓硫酸 B.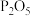 C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为_____________ 。
③将盛有氯气和氨气的注射器按下图连接,进行实验。
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式_____________ 。
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:


(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
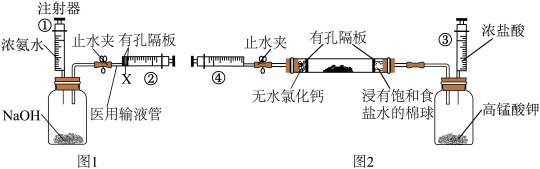
①图1和图2的有孔隔板均可用于干燥气体,则X可为:
A.浓硫酸 B.
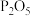 C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为
③将盛有氯气和氨气的注射器按下图连接,进行实验。
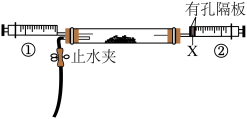
操作 | 现象 |
| 向玻璃管中注入12mL氯气,然后再注入 | 玻璃管中黄绿色气体消失,无白烟生成 |
再注入24mL氨气 | 有白烟生成 |
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。

 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)化学与生活、生产息息相关。
① 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;
③ 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;
⑤CO可用于冶炼金属; ⑥ 可用于制硫酸;
可用于制硫酸;
⑦ 可用于制硝酸
可用于制硝酸
上述物质中,属于酸性氧化物的是______________________ (填序号)。
(2)硝酸是用途广泛的重要化工原科。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为___________ 。
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是___________ (填序号)。
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。 的沸点
的沸点___________  的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。
(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
(6)实验室中 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式_________________________ 。
(7)氰气[ ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素___________ (写元素符号)显负价。
(1)化学与生活、生产息息相关。
①
 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;③
 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;⑤CO可用于冶炼金属; ⑥
 可用于制硫酸;
可用于制硫酸;⑦
 可用于制硝酸
可用于制硝酸上述物质中,属于酸性氧化物的是
(2)硝酸是用途广泛的重要化工原科。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。
 的沸点
的沸点 的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
| A.“类钫”单质具有强氧化性 | B.“类钫”单质能与冷水剧烈反应 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”在化合物中显+1价 |
 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式(7)氰气[
 ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素
您最近一年使用:0次



