名校
解题方法
1 . 以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示:_____________ 。“滤渣1”的化学式为___________ 。
(2)“酸浸”时 与
与 反应的化学方程式为
反应的化学方程式为__________________ 。如果用浓盐酸代替硫酸和 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是______________________ (任答一点)。
(3)“操作2”所得副产品的一种用途为_____________ 。
(4)“沉钴”时温度不能太高,原因是_____________________________ 。
(5)“沉钴”步骤中同时还会产生 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_________________ 。
(6)实验室模拟“操作1”,需要将 转移到
转移到________ (填仪器名称)中加热分解,得到 。
。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示: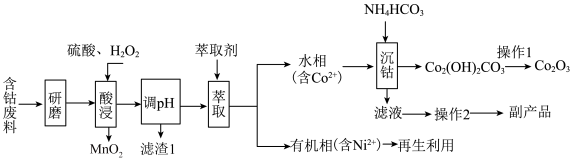
(2)“酸浸”时
 与
与 反应的化学方程式为
反应的化学方程式为 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是(3)“操作2”所得副产品的一种用途为
(4)“沉钴”时温度不能太高,原因是
(5)“沉钴”步骤中同时还会产生
 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(6)实验室模拟“操作1”,需要将
 转移到
转移到 。
。
您最近一年使用:0次
名校
解题方法
2 . 氮是自然界各种生物体生命活动不可缺少的重要元素,下列对氮的化合物进行性质探究实验:
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:_______________________ ,振荡注射器,再次观察现象,全过程发生的化学反应,用方程式表示为:___________________________ 。_______________________ 。
(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
①图1和图2的有孔隔板均可用于干燥气体,则X可为:_____________ 。
A.浓硫酸 B. C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为_____________ 。
③将盛有氯气和氨气的注射器按下图连接,进行实验。
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式_____________ 。
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:


(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
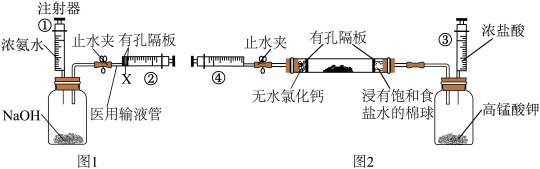
①图1和图2的有孔隔板均可用于干燥气体,则X可为:
A.浓硫酸 B.
 C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为
③将盛有氯气和氨气的注射器按下图连接,进行实验。
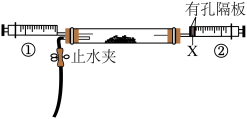
操作 | 现象 |
| 向玻璃管中注入12mL氯气,然后再注入 | 玻璃管中黄绿色气体消失,无白烟生成 |
再注入24mL氨气 | 有白烟生成 |
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。

 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
您最近一年使用:0次
3 . 利用废旧锂电池可回收金属元素。已知废旧锂离子电池的主要成分为 以及
以及  等单质,回收工艺流程如图:
等单质,回收工艺流程如图:
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
(2)“生化反应”后溶液中存在的主要阳离子有 、
、_______ 。“生化反应”最初使用的是 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为_______ ,使用细菌的优点是_______ 。
(3) 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因:_______ 。_______ 。
(5) (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 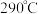 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 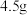 ,所得固体成分为
,所得固体成分为_______ (填化学式)。
(6)金属铜的晶胞如图所示,此晶胞的边长为 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ=_______ g∙cm-3 (用含  的代数式表示)。
的代数式表示)。
 以及
以及  等单质,回收工艺流程如图:
等单质,回收工艺流程如图: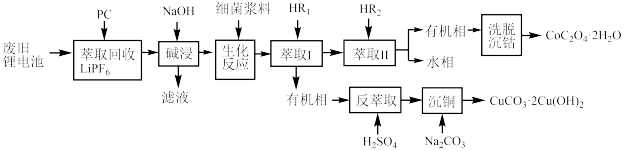
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
| A.漏斗 | B.胶头滴管 | C.分液漏斗 | D.蒸馏烧瓶 |
(2)“生化反应”后溶液中存在的主要阳离子有
 、
、 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为(3)
 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因: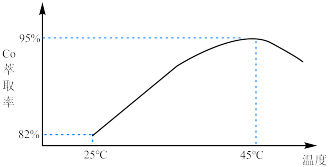
(5)
 (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 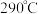 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 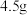 ,所得固体成分为
,所得固体成分为(6)金属铜的晶胞如图所示,此晶胞的边长为
 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ= 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
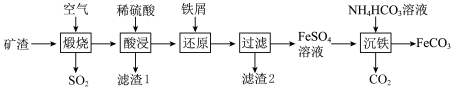
4 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。______ (写化学式),该物质是工业制备高纯度硅的原料,写出硅与氯化氢在高温条件下发生的化学方程式:________ 。
(2)FeS2在空气中煅烧的化学方程式为______ 。
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将 转化为
转化为 外,还能
外,还能______ 。若将6 g铁粉加入200 mL  和CuSO4的混合溶液中,充分反应得到200 mL
和CuSO4的混合溶液中,充分反应得到200 mL 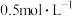 FeSO4溶液和5.2 g固体沉淀物。
FeSO4溶液和5.2 g固体沉淀物。
①5.2 g固体沉淀物的成份为_______ (写化学式)。
②原 溶液的物质的量浓度是
溶液的物质的量浓度是_______ 。
(4)检验 是否完全被还原的实验操作是
是否完全被还原的实验操作是_______ 。
(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:_______ 。
(2)FeS2在空气中煅烧的化学方程式为
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将
 转化为
转化为 外,还能
外,还能 和CuSO4的混合溶液中,充分反应得到200 mL
和CuSO4的混合溶液中,充分反应得到200 mL 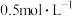 FeSO4溶液和5.2 g固体沉淀物。
FeSO4溶液和5.2 g固体沉淀物。①5.2 g固体沉淀物的成份为
②原
 溶液的物质的量浓度是
溶液的物质的量浓度是(4)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:
您最近一年使用:0次
2024-04-05更新
|
196次组卷
|
2卷引用:广西壮族自治区贵百河联考2023-2024学年高一下学期4月月考化学试题
解题方法
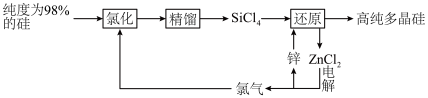
5 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在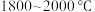 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成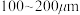 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯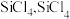 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗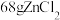 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在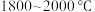 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
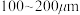 的粉末,这样做的目的是
的粉末,这样做的目的是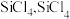 的电子式为
的电子式为(3)“还原”时的温度约为
 ,该反应的化学方程式为
,该反应的化学方程式为 被电解成
被电解成 和
和 ,由此可知
,由此可知 属于
属于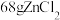 ,则生成
,则生成 。
。
您最近一年使用:0次
2024-04-04更新
|
39次组卷
|
2卷引用:广西桂林市恭城瑶族自治县民族高级中学2023-2024学年高一下学期开学考试化学试题
名校
6 . 回答下列问题:
(1)化学与生活、生产息息相关。
① 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;
③ 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;
⑤CO可用于冶炼金属; ⑥ 可用于制硫酸;
可用于制硫酸;
⑦ 可用于制硝酸
可用于制硝酸
上述物质中,属于酸性氧化物的是______________________ (填序号)。
(2)硝酸是用途广泛的重要化工原料。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为___________ 。
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是___________ (填序号)。
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。 的沸点
的沸点___________  的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。
(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
(6)实验室中 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式_________________________ 。
(7)氰气[ ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素___________ (写元素符号)显负价。
(1)化学与生活、生产息息相关。
①
 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;③
 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;⑤CO可用于冶炼金属; ⑥
 可用于制硫酸;
可用于制硫酸;⑦
 可用于制硝酸
可用于制硝酸上述物质中,属于酸性氧化物的是
(2)硝酸是用途广泛的重要化工原料。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。
 的沸点
的沸点 的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
| A.“类钫”单质具有强氧化性 | B.“类钫”单质能与冷水剧烈反应 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”在化合物中显+1价 |
(6)实验室中
 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式(7)氰气[
 ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素
您最近一年使用:0次
名校
解题方法
7 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: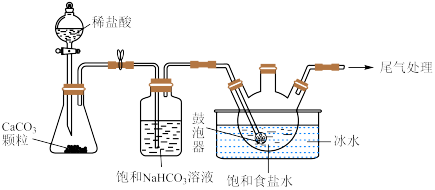
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
291次组卷
|
5卷引用:广西壮族自治区部分学校2023-2024学年高三下学期教学质量监测联考(二模)化学试题
名校
解题方法
8 . 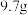 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,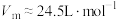 )。将生成的
)。将生成的 、
、 与
与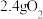 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是
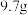 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,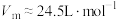 )。将生成的
)。将生成的 、
、 与
与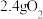 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是A.原合金中, 和 和 的物质的量之比为 的物质的量之比为 |
B.生成的混合气体甲的总质量为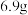 |
C.溶液乙中,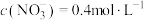 |
D.原硝酸溶液中含有 的物质的量为 的物质的量为 |
您最近一年使用:0次
2024-03-27更新
|
169次组卷
|
7卷引用:广西壮族自治区百所名校2023-2024学年高一下学期3月联合考试化学试题
解题方法
9 . 碱式碳酸铜俗称铜绿,用于催化剂、烟火、农药、颜料、电镀、防腐等行业及制造铜化合物。在工业上用辉铜矿(主要成分为 ,含少量
,含少量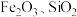 等杂质)来制备铜绿的工艺流程如下图:
等杂质)来制备铜绿的工艺流程如下图:
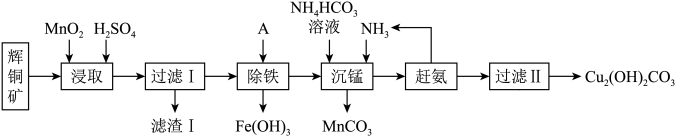
已知:下表为部分金属阳离子在常温下沉淀时的pH值:
(1)“酸浸”过程中,会加入软锰矿(主要成分为 )氧化
)氧化 ,并生成一种黄色沉淀,请写出该离子方程式:
,并生成一种黄色沉淀,请写出该离子方程式:_______ ;为提高酸浸效率,可采取的措施是_______ 。
(2)“除铁”过程中,A物质选用 来中和酸,调节
来中和酸,调节 的范围为
的范围为_______ ;当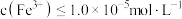 时视为沉淀完全,则
时视为沉淀完全,则
_______ 。
(3)为了保证产品纯度,请设计实验确认 是否除尽
是否除尽_______ 。
(4)经上述流程转化后,为确认该 的纯度,取
的纯度,取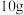 样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到
样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到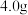 沉淀。请写出加热时的化学方程式
沉淀。请写出加热时的化学方程式_______ ,产物纯度为_______  (精确到小数点后1位)。
(精确到小数点后1位)。
(5)某同学仔细研究后,认为该工艺流程还可以提取副产物,从而提高经济效益。他从滤渣I溶解回收黄色沉淀,所用溶剂最合适的是_______ (填化学式),但该操作温度不宜过高,其原因是_______ 。
 ,含少量
,含少量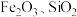 等杂质)来制备铜绿的工艺流程如下图:
等杂质)来制备铜绿的工艺流程如下图:
已知:下表为部分金属阳离子在常温下沉淀时的pH值:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 7.5 | 2.3 | 5.6 | 8.3 |
| 完全沉淀的pH | 9.0 | 3.0 | 6.7 | 9.8 |
(1)“酸浸”过程中,会加入软锰矿(主要成分为
 )氧化
)氧化 ,并生成一种黄色沉淀,请写出该离子方程式:
,并生成一种黄色沉淀,请写出该离子方程式:(2)“除铁”过程中,A物质选用
 来中和酸,调节
来中和酸,调节 的范围为
的范围为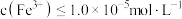 时视为沉淀完全,则
时视为沉淀完全,则
(3)为了保证产品纯度,请设计实验确认
 是否除尽
是否除尽(4)经上述流程转化后,为确认该
 的纯度,取
的纯度,取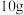 样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到
样品加强热至质量不再变化(假设杂质受热不反应),所得气体全部通入澄清石灰水中,得到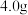 沉淀。请写出加热时的化学方程式
沉淀。请写出加热时的化学方程式 (精确到小数点后1位)。
(精确到小数点后1位)。(5)某同学仔细研究后,认为该工艺流程还可以提取副产物,从而提高经济效益。他从滤渣I溶解回收黄色沉淀,所用溶剂最合适的是
您最近一年使用:0次
10 .  是一种重要的消毒剂,在日常生活中应用广泛。
是一种重要的消毒剂,在日常生活中应用广泛。
(1) 在水溶液中的电离方程式是
在水溶液中的电离方程式是_______ 。
(2)使用 溶液时经常滴加稀硫酸,目的是
溶液时经常滴加稀硫酸,目的是_______ 。
(3)实验室中要配制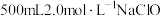 溶液。
溶液。
①实验中用到的玻璃仪器是烧杯、玻璃棒、_______ ;
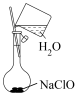
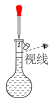
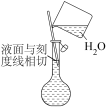
②配制溶液的过程中一些操作如下图所示:
关于上述操作的说法正确的是_______ 。
A.溶解 固体的操作如图①所示
固体的操作如图①所示
B.定容时的操作如图②所示
C.定容时的操作可用图③表示
D.定容时向容量瓶内加蒸馏水至接近刻度线 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
(4)下列操作能使所配制溶液浓度偏低的是_______。
(5)洁厕灵(主要成分是盐酸)与“84”消毒液混合使用发生下列反应: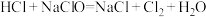 ,该反应的氧化剂是
,该反应的氧化剂是______ ,反应过程中生成标准状况下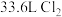 ,转移电子数是
,转移电子数是_____ 。
 是一种重要的消毒剂,在日常生活中应用广泛。
是一种重要的消毒剂,在日常生活中应用广泛。(1)
 在水溶液中的电离方程式是
在水溶液中的电离方程式是(2)使用
 溶液时经常滴加稀硫酸,目的是
溶液时经常滴加稀硫酸,目的是(3)实验室中要配制
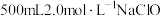 溶液。
溶液。①实验中用到的玻璃仪器是烧杯、玻璃棒、
②配制溶液的过程中一些操作如下图所示:
 |  |  |
| ① | ② | ③ |
A.溶解
 固体的操作如图①所示
固体的操作如图①所示B.定容时的操作如图②所示
C.定容时的操作可用图③表示
D.定容时向容量瓶内加蒸馏水至接近刻度线
 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切(4)下列操作能使所配制溶液浓度偏低的是_______。
| A.称量固体时物码反放 | B.使用的容量瓶不干燥 |
| C.称量时使用有油污的砝码 | D.定容摇匀后液面下降又加水 |
(5)洁厕灵(主要成分是盐酸)与“84”消毒液混合使用发生下列反应:
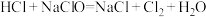 ,该反应的氧化剂是
,该反应的氧化剂是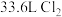 ,转移电子数是
,转移电子数是
您最近一年使用:0次



