名校
1 . 学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是______ ,胶体和溶液的本质区别是_______ 。
(2)生铁是______ (填“混合物”或“化合物”)。通常合金的熔点_____ (填“高于”或“低于”)其组成单质的熔点。
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得: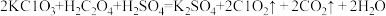 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为______ mol;该反应中的还原剂是______ (填化学式)。
(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=____ 。
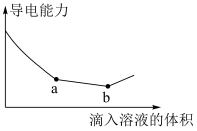
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是______ ,从a点到b点反应的离子方程式是______ ,解释b点之后导电能力上升的原因:______ 。
(1)云、雾属于胶体,鉴别胶体和溶液的方法是
(2)生铁是
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:
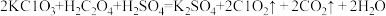 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是
您最近一年使用:0次
2024-01-28更新
|
111次组卷
|
4卷引用:广西北海市2023-2024学年高一上学期期末考试化学试题
名校
解题方法
2 . 高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为
是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 ,杂质有
,杂质有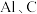 及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是
及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是

 是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为
是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 ,杂质有
,杂质有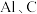 及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是
及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是
| A.“碱浸”可以除去废铁屑中的油脂 |
B.“滤渣”的主要成分是 和 和 |
C.“操作Ⅰ”通入的空气可以用 溶液代替 溶液代替 |
D.若流程改为先“氧化”后“调 ”,可能会生成 ”,可能会生成 |
您最近一年使用:0次
2024-01-22更新
|
769次组卷
|
5卷引用:化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升
(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)选择题11-14江苏省扬州中学2023-2024学年高二下学期3月考试化学试题
名校
解题方法
3 . 工业上以NH3为原料按如下流程制取化合物A。 反应生成Cl-
反应生成Cl-
请回答:
(1)写出NH3催化氧化生成NO的化学方程式________ 。
(2)等物质的量的HNO3与ClF反应除生成A外,另一种产物为HF。
①电子衍射研究表明,气态HF中存在环状六聚体(HF)6,而其他卤素的气态氢化物却不存在,气态HF中存在环状六聚体(HF)6的原因是_____ 。
②下列说法正确的是_____ 。
A.尾气的主要成分是NO,可用NaOH溶液直接吸收 B.ClF中的Cl呈零价
C.化合物A具有强氧化性 D.TiCl4与A反应能生成Ti(NO3)4
(3)①设计实验验证化合物A中含有Cl元素___________ 。
②写出实验过程中涉及的反应方程式___________ 。

 反应生成Cl-
反应生成Cl-请回答:
(1)写出NH3催化氧化生成NO的化学方程式
(2)等物质的量的HNO3与ClF反应除生成A外,另一种产物为HF。
①电子衍射研究表明,气态HF中存在环状六聚体(HF)6,而其他卤素的气态氢化物却不存在,气态HF中存在环状六聚体(HF)6的原因是
②下列说法正确的是
A.尾气的主要成分是NO,可用NaOH溶液直接吸收 B.ClF中的Cl呈零价
C.化合物A具有强氧化性 D.TiCl4与A反应能生成Ti(NO3)4
(3)①设计实验验证化合物A中含有Cl元素
②写出实验过程中涉及的反应方程式
您最近一年使用:0次
名校
4 . 为探究氯气的性质,某实验小组设计了如图所示的微型实验装置。①~③是浸有相应溶液的滤纸条,该实验制备氯气的原理为: (已知:
(已知: 和KSCN溶液反应会生成红色物质)。下列说法正确的是
和KSCN溶液反应会生成红色物质)。下列说法正确的是

 (已知:
(已知: 和KSCN溶液反应会生成红色物质)。下列说法正确的是
和KSCN溶液反应会生成红色物质)。下列说法正确的是
| A.①处红色褪去,证明氯气具有漂白性 |
B.②处变蓝,证明还原性: |
C.③处变红,证明氧化性: |
D.在浓盐酸和 的反应中浓盐酸只体现了还原性 的反应中浓盐酸只体现了还原性 |
您最近一年使用:0次
名校
5 .  常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。
常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。 可在酸性条件下用
可在酸性条件下用 氧化
氧化 (二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量
(二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量 并探究其某些性质。
并探究其某些性质。

回答下列问题:
(1)简述对发生装置A进行气密性检查的过程:___________ 。
(2)E装置的作用是___________ 。
(3)若 的氧化产物为
的氧化产物为 ,则A中反应里,氧化剂与还原剂的物质的量之比为
,则A中反应里,氧化剂与还原剂的物质的量之比为___________ 。
(4)关闭弹簧夹②,打开弹簧夹①③,反应产生的 与装置C中物质反应生成了
与装置C中物质反应生成了 、水和某气体,写出该反应的化学方程式:
、水和某气体,写出该反应的化学方程式:___________ ,反应中若打开弹簧夹①②,关闭弹簧夹③,B中可观察到的现象为___________ 。
(5)NaOH溶液是化学实验室广泛使用的试剂,现有某瓶NaOH溶液的信息说明如下:质量分数为20%、密度为1.20g·cm-3、250mL、请稀释后使用。
①该“NaOH溶液”的物质的量浓度为___________ mol·L-1。(保留至小数点后一位)
②某同学要使用85mL1.5mol/L的NaOH稀溶液来进行某实验,实验员用上述的浓溶液来配制时,选用了规格为100mL的容量瓶,应用量筒量取浓碱液___________ mL。
③配制时,玻璃仪器除了容量瓶、烧杯、量筒外,还需要___________ 。
④实验配制中的下列情况,会导致所配溶液物质的量浓度偏低的是___________ (填标号)。
A.容量瓶底部有少量蒸馏水未进行处理 B.量取浓溶液时,仰视量筒刻度线
C.稀释、移液后的烧杯及玻璃棒未洗涤 D.移液时有少量洗涤液滴落到瓶外
E.定容时俯视容量瓶刻度线 F.摇匀后发现液面低于刻度线后未做处理
 常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。
常温常压下为橙黄色气体,易溶于水,可用于水的净化和纸张、纺织品的漂白。 可在酸性条件下用
可在酸性条件下用 氧化
氧化 (二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量
(二元弱酸)的反应原理来制备,现实验室用如图所示装置(部分夹持装置和加热装置省略)制取少量 并探究其某些性质。
并探究其某些性质。
回答下列问题:
(1)简述对发生装置A进行气密性检查的过程:
(2)E装置的作用是
(3)若
 的氧化产物为
的氧化产物为 ,则A中反应里,氧化剂与还原剂的物质的量之比为
,则A中反应里,氧化剂与还原剂的物质的量之比为(4)关闭弹簧夹②,打开弹簧夹①③,反应产生的
 与装置C中物质反应生成了
与装置C中物质反应生成了 、水和某气体,写出该反应的化学方程式:
、水和某气体,写出该反应的化学方程式:(5)NaOH溶液是化学实验室广泛使用的试剂,现有某瓶NaOH溶液的信息说明如下:质量分数为20%、密度为1.20g·cm-3、250mL、请稀释后使用。
①该“NaOH溶液”的物质的量浓度为
②某同学要使用85mL1.5mol/L的NaOH稀溶液来进行某实验,实验员用上述的浓溶液来配制时,选用了规格为100mL的容量瓶,应用量筒量取浓碱液
③配制时,玻璃仪器除了容量瓶、烧杯、量筒外,还需要
④实验配制中的下列情况,会导致所配溶液物质的量浓度偏低的是
A.容量瓶底部有少量蒸馏水未进行处理 B.量取浓溶液时,仰视量筒刻度线
C.稀释、移液后的烧杯及玻璃棒未洗涤 D.移液时有少量洗涤液滴落到瓶外
E.定容时俯视容量瓶刻度线 F.摇匀后发现液面低于刻度线后未做处理
您最近一年使用:0次
名校
6 . 氧化还原反应是一类重要的反应,在工农业生产、实验室、日常生活中都有广泛的用途。
(1)广西南宁隆安县是全国知名的火龙果种植基地,火龙果富含的花肝素能够消耗活性氧,说明花青素可以作为___________ 剂(填“氧化”或“还原”)。
(2)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转化装置。在催化转化器中,汽车尾气中的CO和NO在催化剂、高温条件下发生反应,生成两种无毒气体。请写出该反应的化学方程式___________ 。
(3) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 和
和 反应的化学方程式
反应的化学方程式___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂B.作还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
(4)《天工开物》记载“凡火药以硝石、硫磺为主,草木灰为辅……魂散惊而魄齑粉”,其中涉及的主要反应为: ,该反应过程中转移6mol电子时,产生的
,该反应过程中转移6mol电子时,产生的 在标况下体积为
在标况下体积为___________ L。
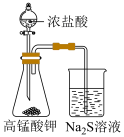
(5)实验室可以用高锰酸钾和浓盐酸反应制备氯气,请写出该反应的离子方程式:__________ 。现采用如图所示的装置探究物质氧化性强弱,若观察到右侧烧杯出现淡黄色沉淀,则说明 、
、 和S的氧化性由强到弱的顺序为:
和S的氧化性由强到弱的顺序为:___________ 。
(1)广西南宁隆安县是全国知名的火龙果种植基地,火龙果富含的花肝素能够消耗活性氧,说明花青素可以作为
(2)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转化装置。在催化转化器中,汽车尾气中的CO和NO在催化剂、高温条件下发生反应,生成两种无毒气体。请写出该反应的化学方程式
(3)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 和
和 反应的化学方程式
反应的化学方程式 在该反应中
在该反应中A.作氧化剂B.作还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
(4)《天工开物》记载“凡火药以硝石、硫磺为主,草木灰为辅……魂散惊而魄齑粉”,其中涉及的主要反应为:
 ,该反应过程中转移6mol电子时,产生的
,该反应过程中转移6mol电子时,产生的 在标况下体积为
在标况下体积为(5)实验室可以用高锰酸钾和浓盐酸反应制备氯气,请写出该反应的离子方程式:
 、
、 和S的氧化性由强到弱的顺序为:
和S的氧化性由强到弱的顺序为:
您最近一年使用:0次
名校
7 . 氢化铝锂(LiAlH4)是化工生产中的重要试剂,溶于水能放出氢气。下列叙述中正确的是
| A.氢化铝锂溶于水后溶液呈中性 |
| B.氢化铝锂与水反应的过程中,氢化铝锂中的氢被还原成氢气 |
| C.氢化铝锂中各微粒的半径大小关系为Al3+>H﹣>Li+ |
| D.氢化铝锂与水反应的过程中,氢化铝锂表现出强氧化性 |
您最近一年使用:0次
2024-01-05更新
|
118次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期12月考试化学试卷
名校
8 . NaCl是一种化工原料,可以制备多种物质,如下图所示。

请根据以上转化关系填写下列空白。
(1)写出反应①的离子方程式:___________ ,该反应中氧化产物与还原产物的质量比为___________ 。
(2)反应②可用于制取漂白粉,写出化学反应方程式并用双线桥法标出电子转移的方向和数目:___________ ;漂白粉需要密封保存,其原因是___________ (用化学方程式表示)
(3)反应③是侯氏制碱法的核心反应,写出化学反应方程式:___________ ;侯氏制碱法将___________ 和___________ 联合起来,也称联合制碱法。

请根据以上转化关系填写下列空白。
(1)写出反应①的离子方程式:
(2)反应②可用于制取漂白粉,写出化学反应方程式并用双线桥法标出电子转移的方向和数目:
(3)反应③是侯氏制碱法的核心反应,写出化学反应方程式:
您最近一年使用:0次
2024-01-01更新
|
115次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高一上学期10月考试化学试卷
解题方法
9 . 铬元素是一种重金属元素,工业上处理含铬废水并将其资源化的工艺有多种,其中还原法和氧化法的工艺流程如下图所示:

回答下列问题。
(1)①“还原”时,加入H2SO4酸化的目的是将废水中的 转化为
转化为 ,用硫酸而不用盐酸,原因是
,用硫酸而不用盐酸,原因是_____ 。
②“还原”时,加入Na2SO3溶液,发生反应的离子方程式为_____ 。下列溶液中可以代替上述流程中Na2SO3溶液的是_____ (填选项标号)。
A.NaHCO3溶液 B.FeSO4溶液 C.MnO2粉末 D.Na2S2O3溶液
(2)25°C时,Ksp[Cr(OH)3]=6.3×10-31。“中和”过程中,溶液中Cr3+离子浓度为6.3×10-7mol/L时,pH=_____ 。
(3)“调pH”时,为提高含铬废水中Cr3+离子沉淀速率,可采取的措施有_____ (任写两种)。
(4)写出“氧化”时发生反应的化学方程式为_____ 。
(5)“沉淀”时,加入的Ba(NO3)2溶液比理论值稍过量的目的是_____ 。

回答下列问题。
(1)①“还原”时,加入H2SO4酸化的目的是将废水中的
 转化为
转化为 ,用硫酸而不用盐酸,原因是
,用硫酸而不用盐酸,原因是②“还原”时,加入Na2SO3溶液,发生反应的离子方程式为
A.NaHCO3溶液 B.FeSO4溶液 C.MnO2粉末 D.Na2S2O3溶液
(2)25°C时,Ksp[Cr(OH)3]=6.3×10-31。“中和”过程中,溶液中Cr3+离子浓度为6.3×10-7mol/L时,pH=
(3)“调pH”时,为提高含铬废水中Cr3+离子沉淀速率,可采取的措施有
(4)写出“氧化”时发生反应的化学方程式为
(5)“沉淀”时,加入的Ba(NO3)2溶液比理论值稍过量的目的是
您最近一年使用:0次
10 . 至今为止,铁是人类冶炼和使用最多的金属。铁及其化合物在生产生活中,乃至国防建设等都发挥着重要作用。某校化学社成员对铁的部分重要化合物进行了系列实验。
Ⅰ.四氧化三铁的光热效应在热量感应、电磁波吸收和纳米材料加热方面具有广泛的应用。例如,在医学领域中,可以利用四氧化三铁的光热效应进行热疗,用于治疗肿瘤等疾病。该校化学社成员利用如图所示装置进行了“铁与水蒸气反应”的实验制备 ,请回答下列问题:
,请回答下列问题:
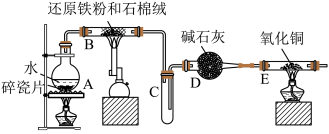
(1)装有碱石灰的仪器D的名称是________ ;装置A的作用是________ 。
(2)装置B中发生反应的化学方程式是________ 。
(3)实验结束后,某成员甲同学认为可以用磁铁吸引产物来确定产物中有未反应的铁粉,有另一成员乙同学认为用此方法判断不妥,你觉得乙同学的依据是________ 。
Ⅱ.氯化铁主要用于金属蚀刻,污水处理。该校化学社成员将Ⅰ中得到的产物溶于稀盐酸中得到溶液a,向溶液a中通入氯气后用此溶液制备 晶体。
晶体。
(4)检验溶液a中是否含 的具体操作及现象为
的具体操作及现象为________ 。
Ⅲ.胶体可以吸附水中悬浮颗粒并沉降而常用来作净水剂。该校化学社成员将得到的 晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
(5)制备方法:在小烧杯中加入50mL蒸馏水,加热至沸腾,向沸水中加入5~6滴饱和 溶液,继续煮沸至液体呈红褐色,停止加热,即可得到
溶液,继续煮沸至液体呈红褐色,停止加热,即可得到 胶体,其反应的化学方程式为
胶体,其反应的化学方程式为________ 。鉴别 胶体和
胶体和 溶液除了观察颜色外,最好的方法是通过
溶液除了观察颜色外,最好的方法是通过________ 判断。
(6)高铁酸钠溶液杀灭病菌后也可以得到氢氧化铁胶体,进而起到净水的作用。其化学反应主要为 (未配平),
(未配平), 的化学式为
的化学式为________ ,请写出配平的化学方程式:________ 。
Ⅰ.四氧化三铁的光热效应在热量感应、电磁波吸收和纳米材料加热方面具有广泛的应用。例如,在医学领域中,可以利用四氧化三铁的光热效应进行热疗,用于治疗肿瘤等疾病。该校化学社成员利用如图所示装置进行了“铁与水蒸气反应”的实验制备
 ,请回答下列问题:
,请回答下列问题:
(1)装有碱石灰的仪器D的名称是
(2)装置B中发生反应的化学方程式是
(3)实验结束后,某成员甲同学认为可以用磁铁吸引产物来确定产物中有未反应的铁粉,有另一成员乙同学认为用此方法判断不妥,你觉得乙同学的依据是
Ⅱ.氯化铁主要用于金属蚀刻,污水处理。该校化学社成员将Ⅰ中得到的产物溶于稀盐酸中得到溶液a,向溶液a中通入氯气后用此溶液制备
 晶体。
晶体。(4)检验溶液a中是否含
 的具体操作及现象为
的具体操作及现象为Ⅲ.胶体可以吸附水中悬浮颗粒并沉降而常用来作净水剂。该校化学社成员将得到的
 晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。(5)制备方法:在小烧杯中加入50mL蒸馏水,加热至沸腾,向沸水中加入5~6滴饱和
 溶液,继续煮沸至液体呈红褐色,停止加热,即可得到
溶液,继续煮沸至液体呈红褐色,停止加热,即可得到 胶体,其反应的化学方程式为
胶体,其反应的化学方程式为 胶体和
胶体和 溶液除了观察颜色外,最好的方法是通过
溶液除了观察颜色外,最好的方法是通过(6)高铁酸钠溶液杀灭病菌后也可以得到氢氧化铁胶体,进而起到净水的作用。其化学反应主要为
 (未配平),
(未配平), 的化学式为
的化学式为
您最近一年使用:0次



