解题方法
1 . 利用电解产生的 与
与 发生反应生成高活性的羟基自由基(
发生反应生成高活性的羟基自由基( ,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是
,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是
 与
与 发生反应生成高活性的羟基自由基(
发生反应生成高活性的羟基自由基( ,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是
,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是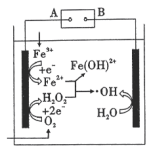
| A.电源的B极为负极 |
| B.生成羟基自由基的反应仅有一个 |
| C.利用羟基自由基来处理有机物,效率高、无污染 |
D.电解池外电路转移 电子,理论上可产生的 电子,理论上可产生的 为 为 |
您最近一年使用:0次
名校
解题方法
2 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: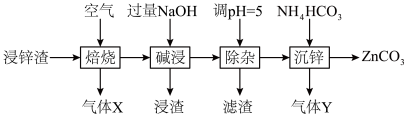
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):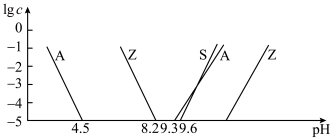
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
200次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
解题方法
3 . 选择性催化还原(SCR)脱硝技术可用于减少工业生产中氮氧化物( )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:
Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
(1)反应

___________ ,副反应化学方程式为___________ 。
(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图:___________ ,应选择的最佳催化剂为___________ ,选用合适的催化剂还能抑制催化剂表面出现铵盐结晶现象,结晶会导致___________ 。
Ⅱ.H2―SCR技术
主反应: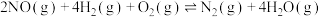
副反应:
(3)恒温下,向容积为1L的容器中充入2mol NO、4mol 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的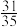 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为___________ ,主反应的
___________ (列出计算式即可)。
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:___________ ,随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是___________ 。
 )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
| 反应方程式 | 反应热 | |
| 吸附过程 | 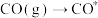 |  |
 |  | |
| 解离过程 |  |  |
| 缔结过程 | 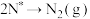 |  |
 |  | |
 | 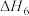 |
(1)反应


(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图: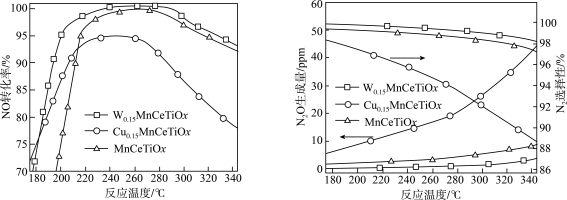
Ⅱ.H2―SCR技术
主反应:
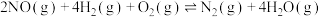
副反应:

(3)恒温下,向容积为1L的容器中充入2mol NO、4mol
 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的
 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
您最近一年使用:0次
名校
4 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
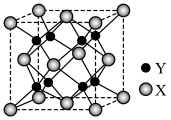
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
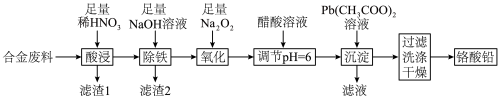
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
94次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
5 . 根据已学过的化学知识,回答下列问题:
(1)近日国家工业和信息化部等七部门发布关于加快推动制造业绿色化发展的指导意见明确氢能作为绿色低碳的清洁能源,数据显示,2023年我国氢燃料电池汽车累计产量为5631辆,销量为5791辆。若电解质溶液是强碱溶液,则氢氧燃料电池的负极反应式是____________ 。
(2)学校实验室有一瓶生产日期已模糊不清的Na2SO3固体,要检验其是否变质,请简述操作过程_________ 。
(3)实验室不用磨口玻璃塞试剂瓶盛装氢氧化钠溶液,请用化学方程式和必要的文字说明原因____________ 。
(4)在非金属及其化合物的学习中,我们认识了以下物质: NO2、SO3、SiO2、浓硫酸、NH3·H2O、NH4HCO3、水玻璃其中属于酸性氧化物的是____________ (写化学式,下同);属于电解质的是____________ 。
(5)根据下列实验事实:①X+Y2+=X2++Y;②Z+2H2O Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成原电池,电极反应为W2++2e-=W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成原电池,电极反应为W2++2e-=W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是____________ 。
(1)近日国家工业和信息化部等七部门发布关于加快推动制造业绿色化发展的指导意见明确氢能作为绿色低碳的清洁能源,数据显示,2023年我国氢燃料电池汽车累计产量为5631辆,销量为5791辆。若电解质溶液是强碱溶液,则氢氧燃料电池的负极反应式是
(2)学校实验室有一瓶生产日期已模糊不清的Na2SO3固体,要检验其是否变质,请简述操作过程
(3)实验室不用磨口玻璃塞试剂瓶盛装氢氧化钠溶液,请用化学方程式和必要的文字说明原因
(4)在非金属及其化合物的学习中,我们认识了以下物质: NO2、SO3、SiO2、浓硫酸、NH3·H2O、NH4HCO3、水玻璃其中属于酸性氧化物的是
(5)根据下列实验事实:①X+Y2+=X2++Y;②Z+2H2O
 Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成原电池,电极反应为W2++2e-=W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成原电池,电极反应为W2++2e-=W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是
您最近一年使用:0次
解题方法
6 . 按要求完成下面小题。
(1)有以下转化关系:
反应①:___________
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是___________ (填序号)。
(2) 。该反应中,生成物M是
。该反应中,生成物M是___________ (填化学式)。
(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是___________ (填序号,下同)。
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为___________ 。
(5) 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:___________ 。
(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平___________ 。
(1)有以下转化关系:

反应①:
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是(2)
 。该反应中,生成物M是
。该反应中,生成物M是(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为
(5)
 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平
您最近一年使用:0次
解题方法
7 . 乙醛是一种重要的工业原料,广泛应用于医药、农药、涂料、塑料、合成纤维、橡胶、树脂等领域。乙醛由乙烯在催化剂作用下直接氧化制得,乙烯氧化法制乙醛的原理如下图所示(部分相关离子未画出),下列说法正确的是


A. 在反应中是中间产物 在反应中是中间产物 |
B.乙烯催化氧化法制乙醛的化学方程式为 |
| C.转化过程中,Pd元素的化合价没有发生变化 |
| D.该转化过程中,有非极性键的断裂与极性键的形成 |
您最近一年使用:0次
名校
解题方法
8 . 锡酸钠 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为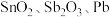 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体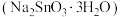 的工艺流程如下:
的工艺流程如下:
②锡酸钠晶体易溶于水,难溶于乙醇。
回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
(2)“高温真空蒸发”控制温度在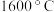 左右,目的是
左右,目的是___________ 。
(3)“高温碱熔”时,单质 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
(4)已知“溶浸”后溶液中的阴离子主要为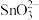 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为___________ 。
(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、___________ (填试剂名称)洗涤、___________ (填“低温”或“高温”)干燥。
(6)利用焦炭在 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为___________  。
。
 在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为
在电镀、印染、纺织、陶瓷等工业中具有重要作用。一种以含铅、锑、锡的复合渣(主要成分为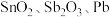 及
及 等)为原料制备锡酸钠晶体
等)为原料制备锡酸钠晶体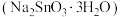 的工艺流程如下:
的工艺流程如下: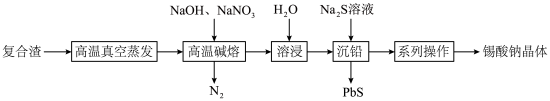
| 物质 |  |  |  |  |
沸点 | 1800 | 2260 | 1550 | 1740 |
回答下列问题:
(1)
 元素在周期表中的位置为
元素在周期表中的位置为(2)“高温真空蒸发”控制温度在
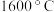 左右,目的是
左右,目的是(3)“高温碱熔”时,单质
 与
与 和
和 反应生成
反应生成 的化学方程式为
的化学方程式为(4)已知“溶浸”后溶液中的阴离子主要为
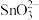 和少量
和少量 ,“沉铅”时发生反应的离子方程式为
,“沉铅”时发生反应的离子方程式为(5)获得锡酸钠晶体的“系列操作”是蒸发浓缩、冷却结晶、过滤、
(6)利用焦炭在
 高温下还原
高温下还原 可制得单质
可制得单质 。
。 存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为
存在白锡、灰锡和脆锡三种同素异形体,其中灰锡的晶体结构与金刚石相似。若晶胞参数为 ,则最近的两个锡原子间的距离为
,则最近的两个锡原子间的距离为 。
。
您最近一年使用:0次
2024-04-07更新
|
237次组卷
|
2卷引用:云南省昆明市2024届高三“三诊一模”教学质量检测(二模)理综-化学试题
9 . 如图是木炭与氧化铜反应的实验装置图,下列说法错误 的是
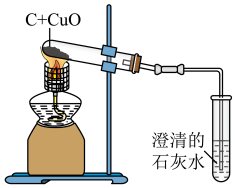

| A.进行实验前,应先检查装置的气密性 |
| B.实验过程中,可观察到试管里的黑色固体变为红色 |
| C.实验结束后,应先停止加热,再将导气管从澄清石灰水中撤出 |
D.加热时,试管中发生反应的化学方程式为C+2CuO 2Cu+CO2↑ 2Cu+CO2↑ |
您最近一年使用:0次
10 . 将赤铜矿(主要成分Cu2O)和辉铜矿(主要成分Cu2S)混合焙烧可得到铜,反应的方程式为2Cu2O+Cu2S 6Cu+X↑,则X的化学式是
6Cu+X↑,则X的化学式是
 6Cu+X↑,则X的化学式是
6Cu+X↑,则X的化学式是| A.O2 | B.SO2 | C.S | D.SO3 |
您最近一年使用:0次



