名校
1 . 以苦卤(海水晒盐后得到的母液,含 )为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
)为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
(1)步骤②苦卤中的 被
被 氧化的离子方程式为
氧化的离子方程式为___________ 。
(2)若步骤④使用 和
和 吸收吹出的
吸收吹出的 ,则化学方程式为
,则化学方程式为___________ ,接着骤⑤再次用 氧化吸收液,重新生成
氧化吸收液,重新生成 。
。
(3)若步骤④使用 溶液吸收吹出的
溶液吸收吹出的 ,请配平补全以下化学方程式:
,请配平补全以下化学方程式:___________ 。
___________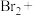 ___________
___________ ___________
___________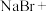 ___________
___________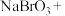 ___________
___________
则步骤⑤用硫酸酸化吸收液,得到 和
和 的混合溶液。相同条件下,若用盐酸酸化,则所得
的混合溶液。相同条件下,若用盐酸酸化,则所得 的质量减少,原因是
的质量减少,原因是___________ 。
(4)该工艺流程中,不直接对“含 的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得
的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得 单质,“步骤③④⑤”的作用是
单质,“步骤③④⑤”的作用是___________ 。
 )为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
)为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
(1)步骤②苦卤中的
 被
被 氧化的离子方程式为
氧化的离子方程式为(2)若步骤④使用
 和
和 吸收吹出的
吸收吹出的 ,则化学方程式为
,则化学方程式为 氧化吸收液,重新生成
氧化吸收液,重新生成 。
。(3)若步骤④使用
 溶液吸收吹出的
溶液吸收吹出的 ,请配平补全以下化学方程式:
,请配平补全以下化学方程式:___________
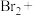 ___________
___________ ___________
___________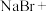 ___________
___________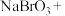 ___________
___________
则步骤⑤用硫酸酸化吸收液,得到
 和
和 的混合溶液。相同条件下,若用盐酸酸化,则所得
的混合溶液。相同条件下,若用盐酸酸化,则所得 的质量减少,原因是
的质量减少,原因是(4)该工艺流程中,不直接对“含
 的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得
的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得 单质,“步骤③④⑤”的作用是
单质,“步骤③④⑤”的作用是
您最近一年使用:0次
2022-11-16更新
|
315次组卷
|
4卷引用:云南省玉溪市第二中学2022-2023学年高一下学期期末考试 化学试题
云南省玉溪市第二中学2022-2023学年高一下学期期末考试 化学试题福建省厦门第一中学2022-2023学年高一上学期期中考试化学试题湖南省株洲市第八中学2023届高三上学期第一次月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)
名校
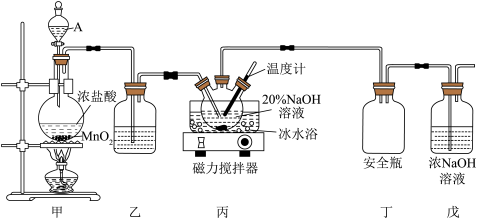
2 . “84消毒液”是以NaClO为主要成分的含氯消毒剂,由于其消毒效果理想、使用方便等特点被一直沿用至今。某化学兴趣小组利用如图所示装置制备含一定游离碱(NaOH)的“84消毒液”。
已知:①氯气与氢氧化钠溶液反应过程中有一定热量放出
②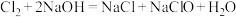 (温度低于35℃)
(温度低于35℃)
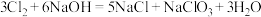 (温度70~80℃)
(温度70~80℃)
回答下列问题:
(1)仪器A的名称为_______ ,装置甲中发生反应的化学方程式为_______ 。
(2)装置乙中盛装试剂为_______ ,若省去装置乙,产生的后果是_______ 。
(3)制备NaClO的反应装置丙需要采用冰水浴且要用温度计控制反应温度,其原因为_______ 。
(4)装置戊的作用为_______ 。
(5)某游泳馆工作人员将“84消毒液”与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO_______  (填“>”或“<”);当有0.1 mol
(填“>”或“<”);当有0.1 mol  生成时,转移电子的物质的量为
生成时,转移电子的物质的量为_______ mol。

已知:①氯气与氢氧化钠溶液反应过程中有一定热量放出
②
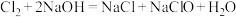 (温度低于35℃)
(温度低于35℃)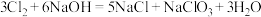 (温度70~80℃)
(温度70~80℃)回答下列问题:
(1)仪器A的名称为
(2)装置乙中盛装试剂为
(3)制备NaClO的反应装置丙需要采用冰水浴且要用温度计控制反应温度,其原因为
(4)装置戊的作用为
(5)某游泳馆工作人员将“84消毒液”与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当有0.1 mol
(填“>”或“<”);当有0.1 mol  生成时,转移电子的物质的量为
生成时,转移电子的物质的量为
您最近一年使用:0次
2022-11-16更新
|
400次组卷
|
4卷引用:云南省红河哈尼族彝族自治州2022-2023学年高一上学期1月期末考试化学试题
名校
解题方法
3 . 含氯物质在生产生活中有重要作用。
(1)与氯元素同族的短周期元素的原子结构示意图为_______ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_______(填序号)。
(3)实验室用强氧化剂 制取
制取 的化学方程式
的化学方程式_______ 。
(4)实验室制取干燥 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为_______ 。

(5)用NaClO溶液也可以吸收工业尾气中的NO。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

a.在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
b.NaClO溶液的初始pH越小,NO转化率越高,其原因是_______ 。
(6)某温度下,将 通入NaOH溶液中,反应生成NaCl、NaClO、
通入NaOH溶液中,反应生成NaCl、NaClO、 的混合液,若溶液中
的混合液,若溶液中 、
、 、
、 的物质的量分别为a、b、c,则a、b、c之间的关系为
的物质的量分别为a、b、c,则a、b、c之间的关系为_______ 。
(1)与氯元素同族的短周期元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_______(填序号)。
A. 、 、 、 、 的熔点 的熔点 | B. 、 、 、 、 的氧化性 的氧化性 |
| C.HCI、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
 制取
制取 的化学方程式
的化学方程式(4)实验室制取干燥
 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为
(5)用NaClO溶液也可以吸收工业尾气中的NO。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
a.在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为b.NaClO溶液的初始pH越小,NO转化率越高,其原因是
(6)某温度下,将
 通入NaOH溶液中,反应生成NaCl、NaClO、
通入NaOH溶液中,反应生成NaCl、NaClO、 的混合液,若溶液中
的混合液,若溶液中 、
、 、
、 的物质的量分别为a、b、c,则a、b、c之间的关系为
的物质的量分别为a、b、c,则a、b、c之间的关系为
您最近一年使用:0次
2022-11-13更新
|
131次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题
4 . 过氧化氢(H2O2)俗称双氧水,外观为无色透明液体,共水溶液适用于医用伤口消毒、环境消毒和食品消毒。请回答下列问题:
(1)用过氧化钡(BaO2)和硫酸溶液反应可以制备H2O2,该反应的化学方程式为_______ 。
(2)保存H2O2时,不能接触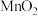 ,请用化学方程式说明其原因:
,请用化学方程式说明其原因:_______ ,该反应属于四大基本反应类型中的_______ 。
(3)H2O2是一种绿色氧化剂,可以用它除去酸性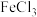 溶液中混有的少量
溶液中混有的少量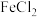 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ ,氧化剂与还原剂的物质的量之比为_______ 。
(4)H2O2能使酸性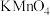 溶液(稀硫酸酸化)褪色,发生反应的化学方程式:
溶液(稀硫酸酸化)褪色,发生反应的化学方程式:
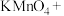
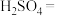
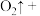
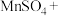
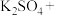 _____
_____
①请配平上述化学方程式,并用双线桥法表示电子的转移方向和数目_______ 。
②该反应中,H2O2作_______ (填“氧化剂”或“还原剂”)。
(1)用过氧化钡(BaO2)和硫酸溶液反应可以制备H2O2,该反应的化学方程式为
(2)保存H2O2时,不能接触
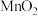 ,请用化学方程式说明其原因:
,请用化学方程式说明其原因:(3)H2O2是一种绿色氧化剂,可以用它除去酸性
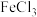 溶液中混有的少量
溶液中混有的少量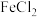 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)H2O2能使酸性
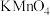 溶液(稀硫酸酸化)褪色,发生反应的化学方程式:
溶液(稀硫酸酸化)褪色,发生反应的化学方程式:
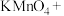
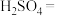
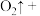
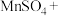
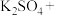 _____
_____①请配平上述化学方程式,并用双线桥法表示电子的转移方向和数目
②该反应中,H2O2作
您最近一年使用:0次
5 . 含氯化合物的应用越来越广泛,请完成下列有关问题:
(1)亚氯酸钠(NaClO2)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为_______ ,其水溶液显碱性的原因为_______ ,其水溶液中离子浓度由大到小的顺序为_______ 。
(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成ClO2和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式_______ 。
(3)ClO2是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为SO2通入NaClO3中可得ClO2,其氧化剂与还原剂的物质的量之比为_______ 。
(4)一定条件下,KClO3与硫酸酸化的草酸(H2C2O4)溶液反应可制备ClO2,该反应的离子方程式为_______ 。
(5)AgNO3溶液可以用来检验水溶液中的Cl-或Br-。若向AgCl悬浊液中加入NaBr溶液,可把AgCl转化为AgBr,已知AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=
AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=_______ 。(不写单位)
(1)亚氯酸钠(NaClO2)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为
(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成ClO2和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式
(3)ClO2是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为SO2通入NaClO3中可得ClO2,其氧化剂与还原剂的物质的量之比为
(4)一定条件下,KClO3与硫酸酸化的草酸(H2C2O4)溶液反应可制备ClO2,该反应的离子方程式为
(5)AgNO3溶液可以用来检验水溶液中的Cl-或Br-。若向AgCl悬浊液中加入NaBr溶液,可把AgCl转化为AgBr,已知AgCl(s)+Br-(aq)
 AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=
AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=
您最近一年使用:0次
名校
6 . 唐代李白《秋浦歌(第十四)》“炉火照天地,红星乱紫烟,赥郎明月夜,歌声动寒川”,展现了一幅瑰玮壮观的秋夜冶炼图。秋浦(今安徽省贵池县西)是唐代铜的产地,其铜矿含 ,在冶炼过程中存在主要反应:①
,在冶炼过程中存在主要反应:①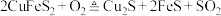 ②
②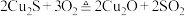
③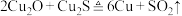 。下列有关叙述正确的是
。下列有关叙述正确的是
 ,在冶炼过程中存在主要反应:①
,在冶炼过程中存在主要反应:①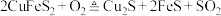 ②
②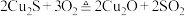
③
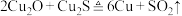 。下列有关叙述正确的是
。下列有关叙述正确的是A.上述冶炼方法属于热还原法,还原剂为 |
| B.反应①中铜元素化合价不变,铁元素的化合价降低 |
C.反应②中有2mol 发生反应时,共转移6mol 发生反应时,共转移6mol |
D.反应③中 是氧化剂, 是氧化剂, 既是氧化剂又是还原剂 既是氧化剂又是还原剂 |
您最近一年使用:0次
2022-10-01更新
|
273次组卷
|
2卷引用:云南省昆明市第一中学2022-2023学年高三上学期第二次双基检测化学试题
7 . 回答下列问题:
(1)化合价是学习氧化还原反应的基础。写出以下几种物质中加点元素 的化合价。
H2O 2____ ,H2C 2O4____ ,C r2O
____ ,M nO
____ 。
(2)自然界中的含硫物质在一定条件下能够相互转化,这种转化在人工条件下也能发生。最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。
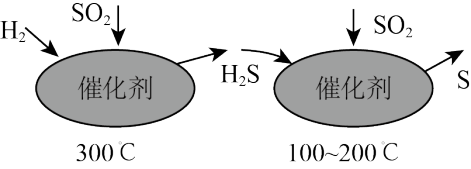
①第一步反应中被氧化的元素是____ (填元素符号)。
②写出第二步的化学方程式:____ 。
(3)将少量Cl2通入FeI2的溶液中,反应的离子方程式为2I—+Cl2=I2+2Cl—,比较还原性I—____ Fe2+(填“大于”、“小于”或“等于”)。
(4)按如图所示操作,充分反应后:
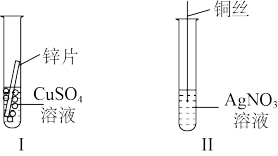
结合实验I、II反应原理推出Cu2+、Zn2+、Ag+的氧化性由弱到强的顺序为_____ 。
(1)化合价是学习氧化还原反应的基础。写出以下几种物质中
H2


(2)自然界中的含硫物质在一定条件下能够相互转化,这种转化在人工条件下也能发生。最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。

①第一步反应中被氧化的元素是
②写出第二步的化学方程式:
(3)将少量Cl2通入FeI2的溶液中,反应的离子方程式为2I—+Cl2=I2+2Cl—,比较还原性I—
(4)按如图所示操作,充分反应后:

结合实验I、II反应原理推出Cu2+、Zn2+、Ag+的氧化性由弱到强的顺序为
您最近一年使用:0次
名校
解题方法
8 . 请阅读下列资料,回答问题。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为 )与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为
)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为_______ 。某同学拟用该原理按如下装置制备并收集纯净的氯气,在虚线框内选用的发生装置_______ (填“甲”“乙”或“丙”)。_______ (填化学式),试剂X是_______ 。可用NaOH溶液吸收尾气,反应的离子方程式为_______ 。
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是_______ ,请在图2中画出氧气的体积随时间变化的趋势图__________ 。 溶液可制备新的绿色消毒剂二氧化氯
溶液可制备新的绿色消毒剂二氧化氯 ,反应中还可得到氯化钠。该反应的化学方程式为
,反应中还可得到氯化钠。该反应的化学方程式为_______ 。
(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为: 。在该反应中,氧化剂是
。在该反应中,氧化剂是_______ ,若有 生成,则转移的电子数为
生成,则转移的电子数为_______  。
。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为
 )与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为
)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。该反应的化学方程式为
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是

 溶液可制备新的绿色消毒剂二氧化氯
溶液可制备新的绿色消毒剂二氧化氯 ,反应中还可得到氯化钠。该反应的化学方程式为
,反应中还可得到氯化钠。该反应的化学方程式为(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为:
 。在该反应中,氧化剂是
。在该反应中,氧化剂是 生成,则转移的电子数为
生成,则转移的电子数为 。
。
您最近一年使用:0次
2022-09-11更新
|
308次组卷
|
3卷引用:云南省昆明市官渡区2021-2022学年高一上学期期末考试化学试题
解题方法
9 . 电路板广泛用于计算机、手机等电子产品中。我区某中学化学兴趣小组拟制作带有“COP15”标志的电路板并对铁及其化合物的性质进行探究。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。

(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为_______ 。取少量废液于试管中,滴加几滴KSCN溶液,溶液出现红色,则废液中含有_______ (填离子符号)。
II.探究铁及其化合物的性质
(2)填写下表。
III.回收废液
(3)对腐蚀废液进行回收可有效利用金属资源。一种回收利用金属铜并获得氯化铁晶体的部分工艺流程如下:
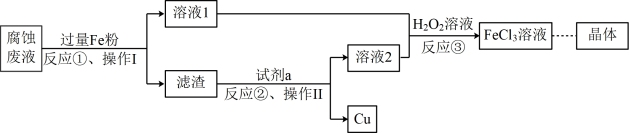
操作I为_______ ,试剂a是_______ 。反应③中加入 溶液的目的是
溶液的目的是_______ 。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入
 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为
II.探究铁及其化合物的性质
(2)填写下表。
| 实验 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| a | 取少量废液于试管中,加入足量Fe粉 | 铁粉部分溶解,溶液呈浅绿色 | ① | ② |
| b | 取少量实验a中反应后的上层清液于试管中,滴加几滴氯水 | ③ |  |  具有还原性 具有还原性 |
III.回收废液
(3)对腐蚀废液进行回收可有效利用金属资源。一种回收利用金属铜并获得氯化铁晶体的部分工艺流程如下:

操作I为
 溶液的目的是
溶液的目的是
您最近一年使用:0次
10 . 以银量法滴定产生的废液、废渣(主要含有 、
、 等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
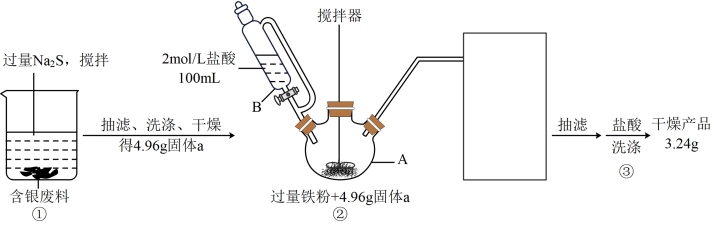
请回答下列问题:
(1)已知银是第五周期元素,与铜同族,写出基态银原子价层电子排布式___________ ;
(2)步骤①中加入过量 的目的是
的目的是___________ ;在获得沉淀时要多搅拌一段时间以获取团聚的沉淀物,该操作对后续处理的意义是___________ ;
(3)仪器B的名称为___________ ;
(4)仪器A中物质在搅拌下充分反应,有臭鸡蛋气味气体产生,并获得黑色不溶物,溶液呈现出浅绿色,写出该反应的离子方程式___________ ;
(5)步骤②图中缺失的尾气处理仪器与药品可选择___________(填序号);
(6)步骤③用盐酸洗涤的目的是___________ ,主要离子反应方程式为___________ ;
(7)利用实验中给出的数据计算本次实验从固体a获得银单质的收率为___________ 。
 、
、 等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
请回答下列问题:
(1)已知银是第五周期元素,与铜同族,写出基态银原子价层电子排布式
(2)步骤①中加入过量
 的目的是
的目的是(3)仪器B的名称为
(4)仪器A中物质在搅拌下充分反应,有臭鸡蛋气味气体产生,并获得黑色不溶物,溶液呈现出浅绿色,写出该反应的离子方程式
(5)步骤②图中缺失的尾气处理仪器与药品可选择___________(填序号);
A. | B.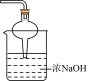 | C.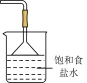 | D.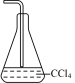 |
(7)利用实验中给出的数据计算本次实验从固体a获得银单质的收率为
您最近一年使用:0次
2022-09-08更新
|
615次组卷
|
3卷引用:云南省部分重点中学2022-2023学年高三上学期月考化学试题
云南省部分重点中学2022-2023学年高三上学期月考化学试题辽宁省鞍山市普通高中2022-2023学年高三第一次质量监测化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题



