名校
1 . 铁元素的价类二维图如图所示。下列说法错误的是
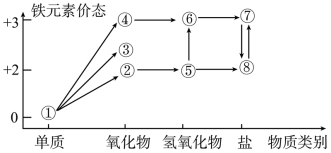

| A.④可用作红色涂料 |
| B.⑦的溶液可用于清洗青铜文物表面的锈迹 |
C.⑤被溶液中的氧气氧化为⑥的化学方程式为 |
D.③溶于过量稀硝酸的离子方程式为 |
您最近一年使用:0次
2023-05-05更新
|
379次组卷
|
3卷引用:云南省昆明市第三中学2023-2024学年高二上学期第一次综合测试化学试题
云南省昆明市第三中学2023-2024学年高二上学期第一次综合测试化学试题河北省保定市河北安国中学等3校2022-2023学年高三下学期2月月考化学试题(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
2 . 高温时,NH3在催化剂作用下还原氮氧化物可应用于烟气脱硝化,一种反应原理如图所示。下列说法正确的是
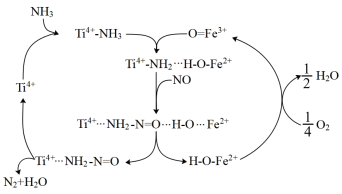

| A.反应前后Ti4+的总物质的量发生改变 |
| B.O=Fe3+在该过程中起催化作用,铁元素价态未发生变化 |
| C.反应的总方程式为4NH3+6NO=5N2 +6H2O |
| D.反应过程中,每产生1mol N2,转移3mol电子 |
您最近一年使用:0次
3 . 硫元素广泛存在于自然界中,是植物生长不可缺少的元素。图1是自然界中硫元素的存在示意图,图2是硫及其化合物的“价—类”二维图。
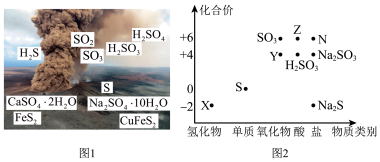
回答下列问题:
(1)图1中的 属于
属于_______ (填“纯净物”或“混合物”)。
(2)请写出图2中X和Y反应的化学方程式:_______ 。该反应中氧化产物和还原产物的质量之比为_______ 。
(3) 溶液很容易变质,请设计实验证明其已变质:
溶液很容易变质,请设计实验证明其已变质:_______ 。
(4)若N是 ,某同学设计了甲和乙两种方法制备:
,某同学设计了甲和乙两种方法制备:
甲: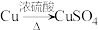
乙:
①写出甲方法反应的化学方程式:_______ 。
②甲和乙方法更合理的是_______ (填“甲”或“乙”),理由是_______ 。
(5)为测定硫酸工厂周围空气中 的含量,进行如下实验:取VL(标准状况)空气,缓慢通入碘水,充分反应后,向溶液中加入过量的
的含量,进行如下实验:取VL(标准状况)空气,缓慢通入碘水,充分反应后,向溶液中加入过量的 溶液,经过滤、洗涤、干燥,称重得白色沉淀mg。
溶液,经过滤、洗涤、干燥,称重得白色沉淀mg。
①写出 与碘水反应的离子方程式:
与碘水反应的离子方程式:_______ 。
②空气中 的体积分数是
的体积分数是_______ (用含V、m的代数式表示)。

回答下列问题:
(1)图1中的
 属于
属于(2)请写出图2中X和Y反应的化学方程式:
(3)
 溶液很容易变质,请设计实验证明其已变质:
溶液很容易变质,请设计实验证明其已变质:(4)若N是
 ,某同学设计了甲和乙两种方法制备:
,某同学设计了甲和乙两种方法制备:甲:
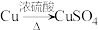
乙:

①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)为测定硫酸工厂周围空气中
 的含量,进行如下实验:取VL(标准状况)空气,缓慢通入碘水,充分反应后,向溶液中加入过量的
的含量,进行如下实验:取VL(标准状况)空气,缓慢通入碘水,充分反应后,向溶液中加入过量的 溶液,经过滤、洗涤、干燥,称重得白色沉淀mg。
溶液,经过滤、洗涤、干燥,称重得白色沉淀mg。①写出
 与碘水反应的离子方程式:
与碘水反应的离子方程式:②空气中
 的体积分数是
的体积分数是
您最近一年使用:0次
名校
解题方法
4 . 浓盐酸和高锰酸钾在室温下即可制备氯气,用如图装置制备少量的氯气并探究其性质。下列说法正确的是


A.高锰酸钾和浓盐酸反应的离子方程式为: |
B.根据溴化钠和碘化钠中的现象可证明氧化性: |
| C.紫色石蕊试液先变红后褪色,说明氯气具有酸性和强氧化性 |
| D.可用饱和食盐水代替NaOH溶液吸收多余的氯气 |
您最近一年使用:0次
2023-04-21更新
|
218次组卷
|
2卷引用:云南省宣威市第三中学2022-2023学年高二下学期第二次月考化学试题
解题方法
5 . 如图是中学化学中常见物质的转化关系。E为红棕色气体,单质G可被磁铁吸引, 和
和 的浓溶液靠近会出现白烟。
的浓溶液靠近会出现白烟。
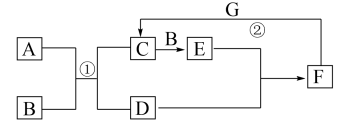
回答下列问题:
(1)D的电子式为_____ ,C的化学式是_____ 。
(2)实验室中常将F的浓溶液保存在_____ 色细口瓶中并置于阴凉处。用化学方程式解释原因______ 。
(3)过量G发生反应②后,向溶液中加入足量氢氧化钠溶液,现象为_____ 。
(4)为防止E污染环境,可用CH4与其反应生成无污染气体和水,写出该反应的化学方程式______ 。
 和
和 的浓溶液靠近会出现白烟。
的浓溶液靠近会出现白烟。
回答下列问题:
(1)D的电子式为
(2)实验室中常将F的浓溶液保存在
(3)过量G发生反应②后,向溶液中加入足量氢氧化钠溶液,现象为
(4)为防止E污染环境,可用CH4与其反应生成无污染气体和水,写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 绿水青山就是金山银山。燃烧煤的烟气含有SO2和NOx,直接排放会造成环境污染,排放前需要进行处理。试回答下列问题:
(1)某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·mol-l、283.0kJ·mol-l,试写出CO还原SO2生成CO2和S(s)的热化学方程式_________ 。
(2)采用Na2SO3溶液吸收法处理SO2,25℃时用1mol·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为_________ 。(已知25℃时:H2SO3的电离常数Kal=l.3×l0-2,Ka2=6.2×l0-8)
(3)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×l0-3mol·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
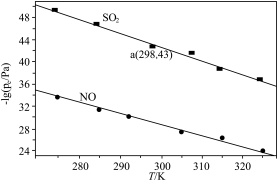
①写出NaClO2溶液脱硫过程中主要反应的离子方程式_________ 。脱硫、脱硝反应的△H_________ 0(填“<”“>”或“=”)。
②已知脱硝主要反应为;4NO+3 +4OH-=4
+4OH-=4 +3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
+3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________ (写出其中一个原因)。欲提高烟气中NO的脱硝反应速率,可以采用的措施是________ (写出其中一条措施)。
③脱硝主要反应的平衡表达式为: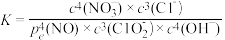 ,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=
,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=________ (只列算式代入数据,不作运算)
(4)如果采用Ca(ClO)2替代NaClO2,能得到更好的烟气脱硫效果,其原因是________ 。
(1)某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·mol-l、283.0kJ·mol-l,试写出CO还原SO2生成CO2和S(s)的热化学方程式
(2)采用Na2SO3溶液吸收法处理SO2,25℃时用1mol·L-1的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为
(3)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×l0-3mol·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。
| 离子 |  |  |  |  | Cl- |
| c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×l0-4 | l.2×10-5 | 3.4×10-3 |

①写出NaClO2溶液脱硫过程中主要反应的离子方程式
②已知脱硝主要反应为;4NO+3
 +4OH-=4
+4OH-=4 +3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
+3C1-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是③脱硝主要反应的平衡表达式为:
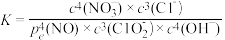 ,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=
,其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=(4)如果采用Ca(ClO)2替代NaClO2,能得到更好的烟气脱硫效果,其原因是
您最近一年使用:0次
2023-04-17更新
|
806次组卷
|
3卷引用:云南省昆明市第三中学2023-2024学年高二下学期开学化学试题
解题方法
7 . 硫酸羟胺[(NH3OH)2SO4]为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)三颈烧瓶中的试剂是___________ ,装置C中反应的化学方程式为___________ 。
(2)开始实验时,应最先打开___________ (填“K1”“K2”或“K3”)。
(3)流程中步骤I的化学方程式是___________ 。
(4)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是___________ (填“NH2OH·H2O”或“NH3·H2O”);再加入甲醇,析出___________ (填化学式)晶体,过滤,滤液经___________ (填“常压”或“减压”)蒸馏后,加入硫酸,得到硫酸羟胺产品。
(5)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=___________ mol。

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)三颈烧瓶中的试剂是
(2)开始实验时,应最先打开
(3)流程中步骤I的化学方程式是
(4)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是
(5)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
您最近一年使用:0次
名校
8 . 物质的量是宏观量与微观量相互联系的桥梁,回答下列问题。
(1)1mol NH 中含
中含___________ 个电子;34g OH- 中含___________ mol质子。
(2)等质量的O2和O3所含分子个数比为___________ 。等温等压下,等体积的O2和O3所含原子个数比为___________ ,质量比为___________ 。
(3)已知17g H2R中含1mol H,则R的摩尔质量为___________ 。
(4)酸性条件下,含I-的卤水发生如下反应。配平方程式并回答下列问题。__________________________________________________________
该反应当有1 I-参与反应时,转移了
I-参与反应时,转移了___________  电子,在标准状况下产生气体的体积是
电子,在标准状况下产生气体的体积是___________ L。
(1)1mol NH
 中含
中含(2)等质量的O2和O3所含分子个数比为
(3)已知17g H2R中含1mol H,则R的摩尔质量为
(4)酸性条件下,含I-的卤水发生如下反应。配平方程式并回答下列问题。
该反应当有1
 I-参与反应时,转移了
I-参与反应时,转移了 电子,在标准状况下产生气体的体积是
电子,在标准状况下产生气体的体积是
您最近一年使用:0次
名校
9 .  (硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以
(硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以 (氰氨)与
(氰氨)与 溶液等为原料,在约50℃、
溶液等为原料,在约50℃、 为10~11条件下制取,发生的反应为
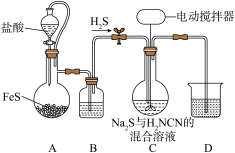
为10~11条件下制取,发生的反应为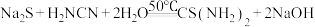 ,实验装置(夹持及加热装置已略)如图,下列说法错误的是
,实验装置(夹持及加热装置已略)如图,下列说法错误的是
 (硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以
(硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以 (氰氨)与
(氰氨)与 溶液等为原料,在约50℃、
溶液等为原料,在约50℃、 为10~11条件下制取,发生的反应为
为10~11条件下制取,发生的反应为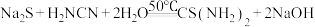 ,实验装置(夹持及加热装置已略)如图,下列说法错误的是
,实验装置(夹持及加热装置已略)如图,下列说法错误的是
A.装置A中的离子方程式为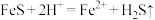 |
| B.装置B中盛放的试剂是浓硫酸 |
C.向装置C中通入 可调节 可调节 |
| D.装置D的主要作用是吸收尾气 |
您最近一年使用:0次
2023-03-26更新
|
107次组卷
|
2卷引用:云南省部分名校2022-2023学年高二下学期3月大联考(B2)化学试题
10 . 在下列实验中,解释或结论正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向某无色溶液中加入稀盐酸 | 生成的无色气体能使品红褪色 | 该无色溶液中存在 |
| B | 向FeBr3溶液中加入足量H2O2 | 生成大量气泡 | FeBr3作氧化剂且氧化性: Fe3+>H2O2 |
| C | 一定温度下,向某容器中充入HI气体,一段时间后压缩容器体积为原来的一半 | 气体颜色变深 | 气体压强增大使平衡正向移动 |
| D | 将溴乙烷制备乙烯生成的气体依次通过足量蒸馏水、酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙烯能被酸性高锰酸钾氧化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



