名校
解题方法
1 . 硫代硫酸钠晶体( )俗称海波或大苏打,易溶于水,难溶于乙醇。可用于鞣制皮革、矿石中提取银、水产养殖中除去自来水中的氯气;临床用于治疗皮肤搔痒症、氰化物、铊中毒和砷中毒等。其制备原理如下:
)俗称海波或大苏打,易溶于水,难溶于乙醇。可用于鞣制皮革、矿石中提取银、水产养殖中除去自来水中的氯气;临床用于治疗皮肤搔痒症、氰化物、铊中毒和砷中毒等。其制备原理如下:
 、
、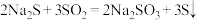 、
、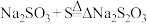
总反应: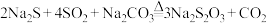
简要实验步骤如下:
①将一定量碳酸钠和硫化钠固体置于锥形瓶中,加入100mL40℃蒸馏水,使其溶解,置于恒温磁力搅拌器上,保持40℃。
②在圆底烧瓶中加入25g亚硫酸钠和25mL蒸馏水,打开分液漏斗活塞,使分液漏斗中15mL浓硫酸顺利流入圆底烧瓶中,产生 。
。
③ 进入锥形瓶中反应制备硫代硫酸钠。
进入锥形瓶中反应制备硫代硫酸钠。
④反应结束后,将所得溶液蒸发浓缩、冷却结晶、过滤、洗涤,低温干燥得到 。回答下列问题:
。回答下列问题:
(1)实验所需仪器、装置如下图,连接顺序为a___________ (填接口标号,可重复)。

(2)装置Ⅰ中制备 气体的化学方程式为
气体的化学方程式为___________ 。
(3)圆底烧瓶适宜的规格为下列中的___________ (填标号);装置Ⅳ的作用是___________ 。
A.50mL B.100 mL C.250 mL D.500 mL
(4)反应过程中,锥形瓶中溶液先产生色浑浊,一段时间后又变澄清。若再继续通入 使溶液呈酸性,溶液又会变浑浊,写出
使溶液呈酸性,溶液又会变浑浊,写出 与
与 溶液发生反应的离子方程式
溶液发生反应的离子方程式___________ 。
(5)步骤④中,过滤后洗涤硫代硫酸钠晶体的试剂是___________ 。
(6) 可看作是
可看作是 中的一个O被一个S替代,其空间结构为
中的一个O被一个S替代,其空间结构为___________ ,中心原子的轨道杂化类型为___________ 。
 )俗称海波或大苏打,易溶于水,难溶于乙醇。可用于鞣制皮革、矿石中提取银、水产养殖中除去自来水中的氯气;临床用于治疗皮肤搔痒症、氰化物、铊中毒和砷中毒等。其制备原理如下:
)俗称海波或大苏打,易溶于水,难溶于乙醇。可用于鞣制皮革、矿石中提取银、水产养殖中除去自来水中的氯气;临床用于治疗皮肤搔痒症、氰化物、铊中毒和砷中毒等。其制备原理如下: 、
、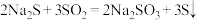 、
、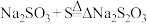
总反应:
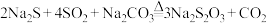
简要实验步骤如下:
①将一定量碳酸钠和硫化钠固体置于锥形瓶中,加入100mL40℃蒸馏水,使其溶解,置于恒温磁力搅拌器上,保持40℃。
②在圆底烧瓶中加入25g亚硫酸钠和25mL蒸馏水,打开分液漏斗活塞,使分液漏斗中15mL浓硫酸顺利流入圆底烧瓶中,产生
 。
。③
 进入锥形瓶中反应制备硫代硫酸钠。
进入锥形瓶中反应制备硫代硫酸钠。④反应结束后,将所得溶液蒸发浓缩、冷却结晶、过滤、洗涤,低温干燥得到
 。回答下列问题:
。回答下列问题:(1)实验所需仪器、装置如下图,连接顺序为a

(2)装置Ⅰ中制备
 气体的化学方程式为
气体的化学方程式为(3)圆底烧瓶适宜的规格为下列中的
A.50mL B.100 mL C.250 mL D.500 mL
(4)反应过程中,锥形瓶中溶液先产生色浑浊,一段时间后又变澄清。若再继续通入
 使溶液呈酸性,溶液又会变浑浊,写出
使溶液呈酸性,溶液又会变浑浊,写出 与
与 溶液发生反应的离子方程式
溶液发生反应的离子方程式(5)步骤④中,过滤后洗涤硫代硫酸钠晶体的试剂是
(6)
 可看作是
可看作是 中的一个O被一个S替代,其空间结构为
中的一个O被一个S替代,其空间结构为
您最近一年使用:0次
名校
2 . 高纯度硝酸高铈铵主要用作有机合成的催化剂和氧化剂、集成电路的腐蚀剂等。它的化学式为(NH4)2Ce(NO3)6,易溶于水,几乎不溶于浓硝酸。实验室用CeCl3溶液制备硝酸高铈铵的主要步骤如下:
Ⅰ.CeCl3与NH4HCO3反应制备Ce2(CO3)3。
制备Ce2(CO3)3的装置如图所示:

将装置A和D中所产生的气体通入B装置一段时间,再将CeCl3溶液滴入下方反应后的溶液中,从而制备Ce2(CO3)3固体。
已知:Ce3+易被空气氧化成Ce4+。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为___________ ,装置C的作用是___________ 。
(2)若装置A和装置D中所产生的气体体积比超过1:1,则B中会产生一种含铈的沉淀杂质,其化学式为___________ 。
(3)装置B中制备Ce2(CO3)3反应的离子方程式为___________ 。
(4)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品Ce2(CO3)3.检验是否洗涤干净的方法为___________ 。
Ⅱ.制备硝酸高铈铵。
取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黄色难溶物)。将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体从而生成硝酸高铈铵沉淀,经过悲、洗涤、(自然烘无后得到产异。
(5)①写出生成Ce(OH)4的离子方程式___________ 。
②“氧化沉淀”时,加热的温度不宜过高,原因是___________ 。
Ⅰ.CeCl3与NH4HCO3反应制备Ce2(CO3)3。
制备Ce2(CO3)3的装置如图所示:

将装置A和D中所产生的气体通入B装置一段时间,再将CeCl3溶液滴入下方反应后的溶液中,从而制备Ce2(CO3)3固体。
已知:Ce3+易被空气氧化成Ce4+。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为
(2)若装置A和装置D中所产生的气体体积比超过1:1,则B中会产生一种含铈的沉淀杂质,其化学式为
(3)装置B中制备Ce2(CO3)3反应的离子方程式为
(4)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品Ce2(CO3)3.检验是否洗涤干净的方法为
Ⅱ.制备硝酸高铈铵。
取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黄色难溶物)。将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体从而生成硝酸高铈铵沉淀,经过悲、洗涤、(自然烘无后得到产异。
(5)①写出生成Ce(OH)4的离子方程式
②“氧化沉淀”时,加热的温度不宜过高,原因是
您最近一年使用:0次
2024-01-03更新
|
344次组卷
|
4卷引用:云南省曲靖市第一中学2023-2024学年高三上学期12月月考理综试题
名校
3 . 根据题给信息,回答相关问题:
(1)FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为___________ 。
(2)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___________ 
(3)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为___________ 。
(4)请配平下列反应的化学方程式:___________
 NaBO2+
NaBO2+ SiO2+
SiO2+ Na+
Na+ H2―→
H2―→ NaBH4+
NaBH4+ Na2SiO3.
Na2SiO3.
(1)FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为(2)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:

(3)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为
(4)请配平下列反应的化学方程式:
 NaBO2+
NaBO2+ SiO2+
SiO2+ Na+
Na+ H2―→
H2―→ NaBH4+
NaBH4+ Na2SiO3.
Na2SiO3.
您最近一年使用:0次
名校
解题方法
4 . 已知铁屑和氯气在500~600℃下可制取无水 ,如图是制取氯化铁粉末所需的装置。经查阅资料得知:无水
,如图是制取氯化铁粉末所需的装置。经查阅资料得知:无水 在空气中易潮解,加热易升华。请回答下列问题。
在空气中易潮解,加热易升华。请回答下列问题。

(1)A装置中,盛装浓盐酸仪器的名称为______ ;烧瓶中发生反应的离子方程式为______ 。
(2)按照气体流向从左到右的顺序连接仪器(填仪器的接口编号):
①接______ ,______接______,______接②。
(3)B装置中,不用玻璃导管,而是硬质玻璃管与收集器直接相连的原因是______ .
(4)C装置的作用是______ .
(5)下列操作步骤的正确顺序为______。
①体系冷却后,停止通入
②赶尽装置中的空气
③在铁屑下方加热至反应完成
④加热,生成氯气
⑤组装装置,检验装置的气密性,并装入药品和试剂
(6)该实验装置存在的明显缺陷是______ 。
(7)该实验中消耗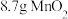 ,则有
,则有______ 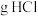 被氧化。
被氧化。
 ,如图是制取氯化铁粉末所需的装置。经查阅资料得知:无水
,如图是制取氯化铁粉末所需的装置。经查阅资料得知:无水 在空气中易潮解,加热易升华。请回答下列问题。
在空气中易潮解,加热易升华。请回答下列问题。
(1)A装置中,盛装浓盐酸仪器的名称为
(2)按照气体流向从左到右的顺序连接仪器(填仪器的接口编号):
①接
(3)B装置中,不用玻璃导管,而是硬质玻璃管与收集器直接相连的原因是
(4)C装置的作用是
(5)下列操作步骤的正确顺序为______。
①体系冷却后,停止通入

②赶尽装置中的空气
③在铁屑下方加热至反应完成
④加热,生成氯气
⑤组装装置,检验装置的气密性,并装入药品和试剂
| A.⑤④③①② | B.⑤④②③① | C.⑤③④②① | D.⑤④①②③ |
(6)该实验装置存在的明显缺陷是
(7)该实验中消耗
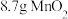 ,则有
,则有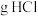 被氧化。
被氧化。
您最近一年使用:0次
名校
解题方法
5 . 铂铼双金属催化剂是石油化工行业的高活性催化剂,使用时,催化剂表面的积炭和铂晶粒的烧结使催化剂逐渐失效。从失效催化剂(主要成分为Al2O3,含少量SiO2、Fe2O3、Pt、Re和积炭)中回收金属铼(Re)、铂(Pt)的工艺流程如下:

回答下列问题:
(1)铂铼双金属催化剂中A12O3的作用是__________________ 。
(2)利用空气“氧化焙烧”时,生成气体的分子式为______________ ,同时铼被氧化为酸性氧化物Re2O7。
(3)“碱焙烧”时,多种成分都能与NaOH反应,其中生成NaReO4的化学方程式为_______________ 。
(4)“滤渣1”回收铂时,先用王水溶解铂生成H2PtC16,再用氯化铵生成(NH4)2PtCl6沉淀,最后煅烧(NH4)2PtC16使其分解生成单质Pt和氮气等产物,该分解反应的化学方程式为_______________ 。
(5)“滤渣2”主要成分的化学式是_______________ 。
(6)“冷冻结晶”时析出含杂质的高铼酸钾(KReO4)晶体,可用_______________ (填方法的名称)提纯。
(7)用氢气高温还原KReO4的化学方程式为_______________ 。

回答下列问题:
(1)铂铼双金属催化剂中A12O3的作用是
(2)利用空气“氧化焙烧”时,生成气体的分子式为
(3)“碱焙烧”时,多种成分都能与NaOH反应,其中生成NaReO4的化学方程式为
(4)“滤渣1”回收铂时,先用王水溶解铂生成H2PtC16,再用氯化铵生成(NH4)2PtCl6沉淀,最后煅烧(NH4)2PtC16使其分解生成单质Pt和氮气等产物,该分解反应的化学方程式为
(5)“滤渣2”主要成分的化学式是
(6)“冷冻结晶”时析出含杂质的高铼酸钾(KReO4)晶体,可用
(7)用氢气高温还原KReO4的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 在汽车尾气系统中安装催化转化器可将污染物CO、NO转化为无毒的 和
和 ,发生的反应为
,发生的反应为
 。下列说法错误的是
。下列说法错误的是
 和
和 ,发生的反应为
,发生的反应为
 。下列说法错误的是
。下列说法错误的是A.该反应中,催化剂不能改变 的大小 的大小 |
| B.高温条件下,有利于该反应自发进行 |
| C.每转移0.2mol电子,同时消耗2.8gCO |
| D.适当升高温度,该反应的正、逆反应速率一定均增大 |
您最近一年使用:0次
2023-11-30更新
|
91次组卷
|
2卷引用:云南省楚雄州2023-2024学年高二上学期期中教育学业质量监测化学试题
名校
7 .  可用于处理含
可用于处理含 的污水,其反应方程式为:
的污水,其反应方程式为: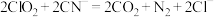 ,
, 中
中 元素为-3价。下列说法正确的是
元素为-3价。下列说法正确的是
 可用于处理含
可用于处理含 的污水,其反应方程式为:
的污水,其反应方程式为: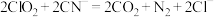 ,
, 中
中 元素为-3价。下列说法正确的是
元素为-3价。下列说法正确的是A.该反应中 被氧化 被氧化 |
B.该反应中氧化产物只有 |
C.由该反应可判断还原性强弱: |
D.如图可表示反应中电子转移情况: |
您最近一年使用:0次
2023-11-28更新
|
187次组卷
|
2卷引用:云南师范大学实验中学2023-2024学年高一上学期12月月考化学试题
8 . 某研究小组为了探究硫黄熏蒸法加工的中药材中的 残留量,将常见的干山药片研磨成粉末进行实验探究。按要求回答下列问题:
残留量,将常见的干山药片研磨成粉末进行实验探究。按要求回答下列问题:
(1)研究小组设计图1装置对 进行定性探究,A中盛有少量品红溶液,B中盛有足量
进行定性探究,A中盛有少量品红溶液,B中盛有足量 溶液。
溶液。
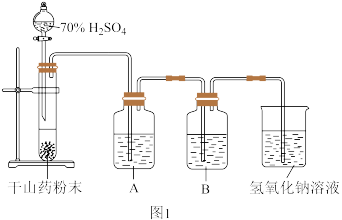
预测A中出现的现象:___________ 。B中发生反应的化学方程式为___________ ,该反应体现了 的
的___________ 性。
实验观察到的现象:A中颜色变浅,B中无明显现象。
(2)研究小组需进一步进行定量研究。通过查阅资料并结合实验室条件,选用酸蒸馏—碱滴定的方法,部分实验装置如图2,主要步骤如下:

步骤一:配制 滴定液。
滴定液。
步骤二:取干山药粉末10.0g置于仪器A中,并加入300~400mL蒸馏水,打开回流冷凝管开关供冷凝水,冷凝管的上端E口处连接橡胶导气管,并将橡胶导气管另一端伸入100mL锥形瓶底部,锥形瓶内加入50mL 3%的 溶液作吸收液(足量)。从D处先通入
溶液作吸收液(足量)。从D处先通入 ,一段时间后再将C中
,一段时间后再将C中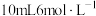 盐酸放入A中(将亚硫酸盐转化为
盐酸放入A中(将亚硫酸盐转化为 ),加热两颈烧瓶微沸1.5h,停止加热,待锥形瓶中的溶液冷却至室温时用
),加热两颈烧瓶微沸1.5h,停止加热,待锥形瓶中的溶液冷却至室温时用 滴定液滴定。
滴定液滴定。
①用 固体配制
固体配制 溶液,需要用到的仪器有托盘天平、药匙、烧杯、玻璃盖片、量筒、玻璃棒、
溶液,需要用到的仪器有托盘天平、药匙、烧杯、玻璃盖片、量筒、玻璃棒、___________ 。
②先通 再加盐酸的目的是
再加盐酸的目的是___________ 。
③ 溶液需要现配现用,分析可能原因:
溶液需要现配现用,分析可能原因:___________ 。锥形瓶内发生的主要反应的离子方程式为___________ 。
④经多次重复测定,滴定终点时,消耗 溶液的体积的平均值为
溶液的体积的平均值为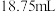 ,则干山药粉末中的
,则干山药粉末中的 残留量为
残留量为___________ 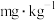 。
。
 残留量,将常见的干山药片研磨成粉末进行实验探究。按要求回答下列问题:
残留量,将常见的干山药片研磨成粉末进行实验探究。按要求回答下列问题:(1)研究小组设计图1装置对
 进行定性探究,A中盛有少量品红溶液,B中盛有足量
进行定性探究,A中盛有少量品红溶液,B中盛有足量 溶液。
溶液。
预测A中出现的现象:
 的
的实验观察到的现象:A中颜色变浅,B中无明显现象。
(2)研究小组需进一步进行定量研究。通过查阅资料并结合实验室条件,选用酸蒸馏—碱滴定的方法,部分实验装置如图2,主要步骤如下:

步骤一:配制
 滴定液。
滴定液。步骤二:取干山药粉末10.0g置于仪器A中,并加入300~400mL蒸馏水,打开回流冷凝管开关供冷凝水,冷凝管的上端E口处连接橡胶导气管,并将橡胶导气管另一端伸入100mL锥形瓶底部,锥形瓶内加入50mL 3%的
 溶液作吸收液(足量)。从D处先通入
溶液作吸收液(足量)。从D处先通入 ,一段时间后再将C中
,一段时间后再将C中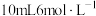 盐酸放入A中(将亚硫酸盐转化为
盐酸放入A中(将亚硫酸盐转化为 ),加热两颈烧瓶微沸1.5h,停止加热,待锥形瓶中的溶液冷却至室温时用
),加热两颈烧瓶微沸1.5h,停止加热,待锥形瓶中的溶液冷却至室温时用 滴定液滴定。
滴定液滴定。①用
 固体配制
固体配制 溶液,需要用到的仪器有托盘天平、药匙、烧杯、玻璃盖片、量筒、玻璃棒、
溶液,需要用到的仪器有托盘天平、药匙、烧杯、玻璃盖片、量筒、玻璃棒、②先通
 再加盐酸的目的是
再加盐酸的目的是③
 溶液需要现配现用,分析可能原因:
溶液需要现配现用,分析可能原因:④经多次重复测定,滴定终点时,消耗
 溶液的体积的平均值为
溶液的体积的平均值为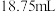 ,则干山药粉末中的
,则干山药粉末中的 残留量为
残留量为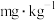 。
。
您最近一年使用:0次
名校
9 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取 H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为_______ 。
②有同学认为 2
2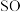 3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:
3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:_______ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中)
对人类健康会产生危害,为了降低饮用水中) 的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下
的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下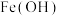 2还原
2还原 生成
生成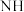 3,反应中氧化剂和还原剂物质的量之比为
3,反应中氧化剂和还原剂物质的量之比为_______ ;方案二,在碱性条件下,用铝粉处理,已知反应时Al与 为5∶3,且Al转化为
为5∶3,且Al转化为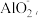 被氧化的元素是
被氧化的元素是_______ ,还原产物是_______ ,请写出反应的离子方程式:_______ 。
(3)已知 3+可以氧化
3+可以氧化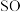 2,则向
2,则向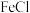 3和
3和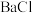 2中通入
2中通入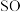 2会产生白色沉淀,该沉淀是
2会产生白色沉淀,该沉淀是_______ (填化学式)。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取
 H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为②有同学认为
 2
2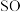 3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:
3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中)
对人类健康会产生危害,为了降低饮用水中) 的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下
的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下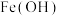 2还原
2还原 生成
生成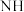 3,反应中氧化剂和还原剂物质的量之比为
3,反应中氧化剂和还原剂物质的量之比为 为5∶3,且Al转化为
为5∶3,且Al转化为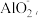 被氧化的元素是
被氧化的元素是(3)已知
 3+可以氧化
3+可以氧化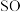 2,则向
2,则向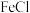 3和
3和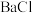 2中通入
2中通入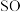 2会产生白色沉淀,该沉淀是
2会产生白色沉淀,该沉淀是
您最近一年使用:0次
名校
10 . NaClO是一种常用的消毒剂和漂白剂,某实验小组设计如下实验制备NaClO溶液、测定其含量,并探究其漂白棉布效果。制备NaClO的装置如图所示,请回答下列问题:

(1)盛装浓盐酸的仪器名称为_______ ,装置B的作用是_______ 。
(2)写出装置A中反应的化学方程式并用双线桥标出电子转移情况:_______ 。装置D中反应的离子方程式为_______ 。
(3)有同学提出四点意见:①装置A不需要加热;②装置C没有必要;③装置D后再连一个装置装碱石灰做尾气处理;④把装置D中冰水换成沸腾的热水以加快反应速率。合理的是_______ 。
(4)漂白液中NaClO含量测定:取50mL制得的漂白液样品于锥形瓶中,加过量KI溶液,发生反应生成NaCl和I2;再用Na2S2O3去测定I2的量,原理为 2
2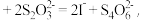 消耗Na2S2O3
消耗Na2S2O3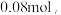 则漂白液中NaClO的含量为
则漂白液中NaClO的含量为_______ g/L。
(5)已知:①棉布被次氯酸钠漂白时都会受到一定的损伤;②织物断裂强度是指织物在被拉断时所能承受的最大荷重,单位为kg;③强酸性环境下漂白液中会逸出黄绿色气体。探究次氯酸钠漂白棉布的pH后,得出不同pH与漂白速率的关系、不同pH与被漂白棉布断裂强度的关系分别如图所示:

由图可知,pH越小漂白速率越_______ (填“快”“慢”或“无影响”),实际漂白时pH的最佳范围是9~11,不宜选择酸性、中性的原因是_______ 。

(1)盛装浓盐酸的仪器名称为
(2)写出装置A中反应的化学方程式并用双线桥标出电子转移情况:
(3)有同学提出四点意见:①装置A不需要加热;②装置C没有必要;③装置D后再连一个装置装碱石灰做尾气处理;④把装置D中冰水换成沸腾的热水以加快反应速率。合理的是
(4)漂白液中NaClO含量测定:取50mL制得的漂白液样品于锥形瓶中,加过量KI溶液,发生反应生成NaCl和I2;再用Na2S2O3去测定I2的量,原理为
 2
2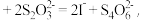 消耗Na2S2O3
消耗Na2S2O3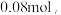 则漂白液中NaClO的含量为
则漂白液中NaClO的含量为(5)已知:①棉布被次氯酸钠漂白时都会受到一定的损伤;②织物断裂强度是指织物在被拉断时所能承受的最大荷重,单位为kg;③强酸性环境下漂白液中会逸出黄绿色气体。探究次氯酸钠漂白棉布的pH后,得出不同pH与漂白速率的关系、不同pH与被漂白棉布断裂强度的关系分别如图所示:

由图可知,pH越小漂白速率越
您最近一年使用:0次



