名校
解题方法
1 . 锰酸锂 是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。
是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。 中的三种元素位于元素周期表的共
中的三种元素位于元素周期表的共___________ 个区。
A.1 B.2 C.3
2.O元素的第一电离能比N小,但电负性却比N大,原因分别是___________ ,___________ 。
3.“酸浸”可将难溶的 转化为
转化为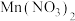 、
、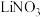 等产物。写出对应的离子方程式
等产物。写出对应的离子方程式___________
4.如果以盐酸代替 和
和 ,会产生一种有毒气体,该气体可能是
,会产生一种有毒气体,该气体可能是___________ 。(填化学式)
5.加入NaOH的目的是使得 转化为
转化为 ,过滤分离,避免后续
,过滤分离,避免后续 中混有
中混有___________ ,常温下, 的
的 是
是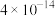 ,为使
,为使 沉淀完全(浓度
沉淀完全(浓度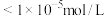 ),溶液的pH应大于
),溶液的pH应大于___________
6.过滤出的 往往用乙醇洗涤,写出用乙醇洗涤的两个优点
往往用乙醇洗涤,写出用乙醇洗涤的两个优点___________ 、___________ 。
 是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。
是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。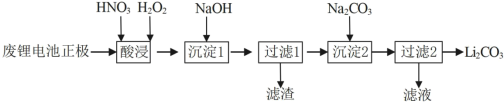
 中的三种元素位于元素周期表的共
中的三种元素位于元素周期表的共A.1 B.2 C.3
2.O元素的第一电离能比N小,但电负性却比N大,原因分别是
3.“酸浸”可将难溶的
 转化为
转化为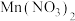 、
、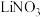 等产物。写出对应的离子方程式
等产物。写出对应的离子方程式4.如果以盐酸代替
 和
和 ,会产生一种有毒气体,该气体可能是
,会产生一种有毒气体,该气体可能是5.加入NaOH的目的是使得
 转化为
转化为 ,过滤分离,避免后续
,过滤分离,避免后续 中混有
中混有 的
的 是
是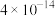 ,为使
,为使 沉淀完全(浓度
沉淀完全(浓度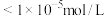 ),溶液的pH应大于
),溶液的pH应大于6.过滤出的
 往往用乙醇洗涤,写出用乙醇洗涤的两个优点
往往用乙醇洗涤,写出用乙醇洗涤的两个优点
您最近一年使用:0次
名校
2 . 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
1.氯离子结构示意图为___________ ,碘在元素周期表中的位置是___________ 。
2.氯气可用来制取漂白粉,漂白粉的有效成分是___________ 。
3.次氯酸钠可用于去除废水中的铵态氮,配平离子方程式并标出电子转移方向和数目。___________
___________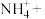 ___________
___________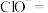 ___________
___________ ___________
___________ ___________
___________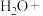 ___________
___________
1.氯离子结构示意图为
2.氯气可用来制取漂白粉,漂白粉的有效成分是
3.次氯酸钠可用于去除废水中的铵态氮,配平离子方程式并标出电子转移方向和数目。
___________
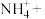 ___________
___________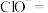 ___________
___________ ___________
___________ ___________
___________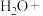 ___________
___________
您最近一年使用:0次
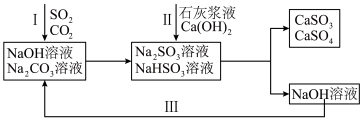
3 . 工业废气、汽车尾气排放的氮氧化物、二氧化硫等是形成雾霾的主要物质,需要进行综合治理。
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目___________ 。
处理汽车尾气的反应为: △H
△H
2.已知:CO的燃烧热△H1=-283.0kJ·mol-1
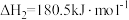
则△H=___________ 。该反应的△S___________ 0(填“>”或“<”)。
3.上述反应自发进行的条件是
工业上对二氧化硫的处理有多种方法。I:用NaOH溶液或氨水吸收废气中少量SO2气体,以防污染环境。4.若用0.1mol·L-1的NaOH溶液或同浓度的氨水处理相同量的废气,两种方法所需吸收液的体积关系是___________
5.用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化如下表所示。
根据以上信息推断NaHSO3溶液的酸碱性,结合方程式解释其原因:___________ 。
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO ]的值将
]的值将___________ 。
A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:___________ 。
己知: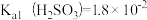 ,
,
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目
处理汽车尾气的反应为:
 △H
△H2.已知:CO的燃烧热△H1=-283.0kJ·mol-1

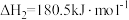
则△H=
3.上述反应自发进行的条件是
| A.任何温度 | B.任何温度都不能 | C.高温 | D.低温 |
| A.NaOH溶液的体积大于氨水 | B.NaOH溶液的体积等于氨水 |
| C.NaOH溶液的体积小于氨水 | D.无法判断 |
n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,溶液中c(HSO )增大 )增大 |
B.加入少量Na2SO3固体,则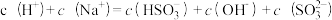 |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
D.加入氨水至中性,则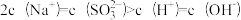 |
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO
 ]的值将
]的值将A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO
 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:己知:
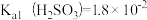 ,
,
您最近一年使用:0次
名校
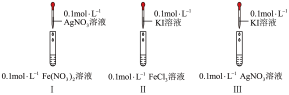
4 . 通过如下实验,比较 、
、 、
、 的氧化性。
的氧化性。
(1)实验室 溶液通常盛放在
溶液通常盛放在___________ 试剂瓶中。
(2)Ⅱ中反应的离子方程式为___________ 。
(3)I、Ⅱ中的现象说明___________。
(4)实验后,I试管壁上的黑色沉淀可用___________洗去。
(5)写出检验I中是否含有 的方法。
的方法。___________ 。
(6)检验Ⅱ中是否含有 不可选用:___________。(不定项)
不可选用:___________。(不定项)
(7)推测Ⅲ中未发生 氧化
氧化 的原因
的原因___________ 。
 、
、 、
、 的氧化性。
的氧化性。
| 实验现象 |
I中产生黑色沉淀,滴加 溶液,变红 溶液,变红 | |
| Ⅱ中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| Ⅲ中产生黄色沉淀,滴加淀粉溶液,未变蓝 |
(1)实验室
 溶液通常盛放在
溶液通常盛放在(2)Ⅱ中反应的离子方程式为
(3)I、Ⅱ中的现象说明___________。
A.氧化性顺序: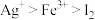 | B.氧化性顺序: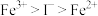 |
C.还原性顺序: | D.还原性顺序: |
(4)实验后,I试管壁上的黑色沉淀可用___________洗去。
| A.酒精 | B.二硫化碳 | C.浓硝酸 | D.热盐酸 |
(5)写出检验I中是否含有
 的方法。
的方法。(6)检验Ⅱ中是否含有
 不可选用:___________。(不定项)
不可选用:___________。(不定项)| A.氢氧化钠溶液 | B.酸性高辒酸钾溶液 | C.硫氰化钾溶液 | D.稀氨水 |
(7)推测Ⅲ中未发生
 氧化
氧化 的原因
的原因
您最近一年使用:0次
名校
5 . 将半导体光催化剂浸入电解质溶液中,光照,可在表面得到产物。下图为原理示意图。 光解过程中断裂的化学键是___________。
光解过程中断裂的化学键是___________。
(2)若将该催化剂置于 溶液中,产物之一为
溶液中,产物之一为 ,另一产物为
,另一产物为___________ 。
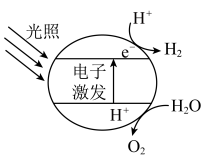
 光解过程中断裂的化学键是___________。
光解过程中断裂的化学键是___________。| A.离子键 | B.共价键 | C.离子键和共价键 | D.氢键 |
(2)若将该催化剂置于
 溶液中,产物之一为
溶液中,产物之一为 ,另一产物为
,另一产物为
您最近一年使用:0次
名校
6 . 过量使用尿素[CO(NH2)2]会造成水体中氨氮(以 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法
(1)写出上述反应的离子方程式。___________ 。
(2)若收集到标况下 气体,转移电子的数目为
气体,转移电子的数目为___________ 。
(3)氨氮去除率随 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是___________ 。
(4)某废水中氨氮浓度(以 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为______ ?(写出计算过程)
 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法(1)写出上述反应的离子方程式。
(2)若收集到标况下
 气体,转移电子的数目为
气体,转移电子的数目为(3)氨氮去除率随
 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是(4)某废水中氨氮浓度(以
 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为
您最近一年使用:0次
名校
解题方法
7 . 活性炭吸附脱硝法的工艺流程如图所示。___________ ,若入口烟气中 以
以 形式参加反应,则相应的化学方程式为
形式参加反应,则相应的化学方程式为___________ 。
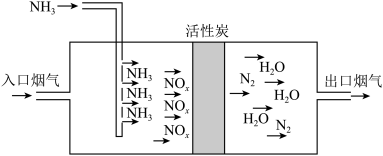
 以
以 形式参加反应,则相应的化学方程式为
形式参加反应,则相应的化学方程式为
您最近一年使用:0次
名校
8 . 双碱法是一种用于燃煤尾气脱硫的工艺,其具有脱硫效率高、成本低等优点,以下是一种脱硫工艺简要流程。 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。
1.等浓度的 和
和 溶液,
溶液,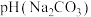
___________ 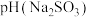 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:___________ 。
2.过程I中, 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数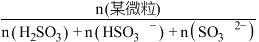 与pH的关系如图所示。
与pH的关系如图所示。___________ 。
②等浓度 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是___________ 。
A.
B.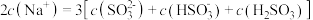
C.
D.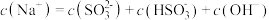
3.生成的 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:___________ 。
4.工业上也可以用氨水吸收尾气中的 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。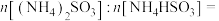
___________ 。
 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。 |  |
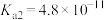 | |
 |  |
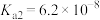 |
1.等浓度的
 和
和 溶液,
溶液,
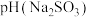 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:2.过程I中,
 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数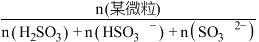 与pH的关系如图所示。
与pH的关系如图所示。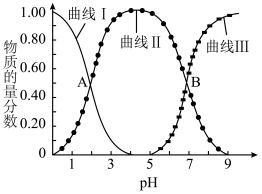
②等浓度
 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是A.

B.
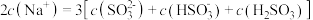
C.

D.
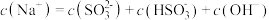
3.生成的
 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:4.工业上也可以用氨水吸收尾气中的
 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
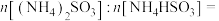
您最近一年使用:0次
名校
解题方法
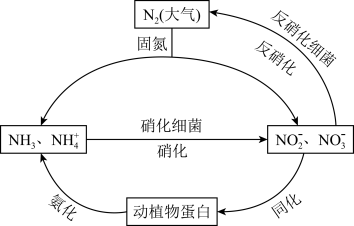
9 . 氮循环是自然界中一种重要的物质循环方式:
(1)化学与生产、生活和科技都密切相关。下列有关说法不正确的是___________ 。
A.硝化过程无需氧化剂参与
B.含有新冠病毒的飞沫分散在空气中形成的分散系为气溶胶
C.固氮过程中, 只做氧化剂
只做氧化剂
D.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
E.反硝化过程有助于弥补人工固氮对氮循环造成的影响
F.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
(2)写出氮循环中 的电子式
的电子式___________ ,其空间构型是___________ 。写出 的检验方法
的检验方法___________ 。
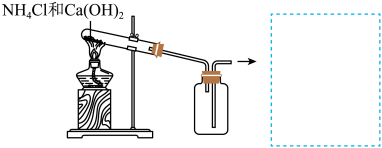
(3)实验室用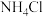 与
与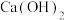 反应来制备
反应来制备 ,原理:
,原理:___________ (化学反应方程式)。在图中补上尾气处理装置(注明所用的化学物质的化学式)。___________
(4)通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有3种途径。如上① 称为
称为___________ ,②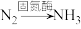 称为生物固氮,还有1种是工业固氮,其反应的化学方程式是
称为生物固氮,还有1种是工业固氮,其反应的化学方程式是___________ 。
(5)反硝化过程中, (C化合价:
(C化合价: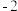 )可作为反应的还原剂。请将该反应的离子方程式补充完整:
)可作为反应的还原剂。请将该反应的离子方程式补充完整:___________ 。
___________ ___________
___________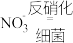 ___________
___________ ___________
___________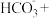 ___________
___________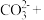 ___________。
___________。

(1)化学与生产、生活和科技都密切相关。下列有关说法不正确的是
A.硝化过程无需氧化剂参与
B.含有新冠病毒的飞沫分散在空气中形成的分散系为气溶胶
C.固氮过程中,
 只做氧化剂
只做氧化剂D.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
E.反硝化过程有助于弥补人工固氮对氮循环造成的影响
F.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
(2)写出氮循环中
 的电子式
的电子式 的检验方法
的检验方法(3)实验室用
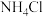 与
与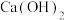 反应来制备
反应来制备 ,原理:
,原理:
(4)通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有3种途径。如上①
 称为
称为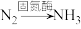 称为生物固氮,还有1种是工业固氮,其反应的化学方程式是
称为生物固氮,还有1种是工业固氮,其反应的化学方程式是(5)反硝化过程中,
 (C化合价:
(C化合价: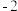 )可作为反应的还原剂。请将该反应的离子方程式补充完整:
)可作为反应的还原剂。请将该反应的离子方程式补充完整:___________
 ___________
___________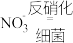 ___________
___________ ___________
___________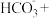 ___________
___________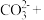 ___________。
___________。
您最近一年使用:0次
名校
解题方法
10 . 硫代硫酸钠 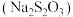 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。
(1)除了以上原料可以制备 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:___________ ;过程主要表现了浓硫酸的哪些性质___________ 。
(3)直到反应完毕,最后发现烧瓶中还有一定量的 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是___________ ,足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是___________ ,___________ 。(填两类不同的化学物质)
A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
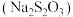 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。(1)除了以上原料可以制备
 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。A. | B.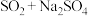 | C. | D.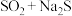 |
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:
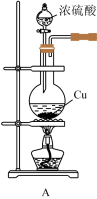
(3)直到反应完毕,最后发现烧瓶中还有一定量的
 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
您最近一年使用:0次