1 . Ⅰ.卤素单质及其化合物在科研和工农业生产中有着广泛的应用。
(1)下列叙述错误 的是______
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法错误 的是______
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的___________ 倍(保留2位小数)。
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目___________ 。
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为___________ 。
(6)除去食盐水中少量的KNO3,实验步骤依次为:___________ 、___________ 、___________ 。
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式___________ 。
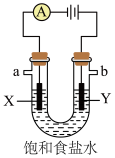
②检验Y极产物的试剂为___________ ,涉及的离子方程式为___________ 。
(1)下列叙述
| A.使用含氟牙膏能预防龋齿 | B.食盐不可作食品防腐剂 |
| C.碘酒可用于皮肤外用消毒 | D.“84”消毒液具有漂白性 |
(2)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:

下列说法
A.加入的 在还原工序中被还原 在还原工序中被还原 |
B.还原工序逸出的 可用 可用 溶液吸收 溶液吸收 |
| C.除杂工序中可用过滤操作除去产生的滤渣 |
D.中和工序中的化学反应为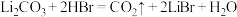 |
(3)二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。消毒效率常以单位质量的消毒剂得到的电子数表示,ClO2的消毒效率是Cl2的
Ⅱ.氯气产量是衡量国家工业发展的一个重要指标。
(4)1774年,瑞典化学家舍勒发现软锰矿与浓盐酸混合加热,会产生一种令人感到窒息的黄绿色气体。请据此写出相关的化学反应方程式并标出电子转移的方向和数目
Ⅲ.工业上采取电解饱和食盐水制备氯气。
(5)配制饱和食盐水的食盐必须精制,精制过程中需要除去Ca2+、Mg2+、
 等杂质离子,先后加入的除杂试剂依次为
等杂质离子,先后加入的除杂试剂依次为(6)除去食盐水中少量的KNO3,实验步骤依次为:
(7)①下图是电解饱和食盐水示意图,写出其化学反应方程式

②检验Y极产物的试剂为
您最近一年使用:0次
2 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
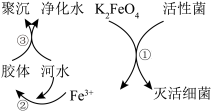
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
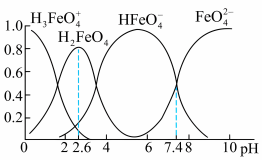
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
解题方法
3 . Cu2O溶于浓氨水中形成无色的[Cu(NH3)2]+,该无色溶液接触空气会很快变成深蓝色。
(1)[Cu(NH3)2]+中NH3的N原子提供___________,与中心离子形成___________。
| A.空轨道、离子键 | B.孤电子对、离子键 |
| C.空轨道、配位键 | D.孤电子对、配位键 |
| A.大于107° | B.小于107° | C.等于107° | D.等于120° |
完成并配平上述离子方程式。
您最近一年使用:0次
解题方法
4 . “太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生H2.如常见的铁氧化物循环制氢过程如图所示。

(1)写出反应Ⅰ的化学方程式:
(2)若该反应生成标准状况下5.6 L氢气,转移电子数目为:
您最近一年使用:0次
名校
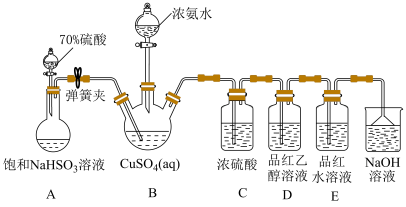
5 . NH4CuSO3(亚硫酸亚铜铵)是一种白色难溶于水、难溶于酒精的化工产品。某小组设计如下实验装置制备NH4CuSO3并探究SO2的漂白性。
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为_____ 。
(2)装置C的目的是_____ 。
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为_____ 。
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是_____ 。
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是 ;
;
猜想ⅱ:乙同学认为使品红褪色的微粒主要是 ;。
;。
为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的_____ 溶液(填化学式,下同)和0.1mol·L-1_____ 溶液,发现前者褪色快,后者褪色慢,说明上述猜想i比ⅱ合理。
(6)测定产品中 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是_____ %(结果保留三位有效数字)。下列操作使测得的NH4CuSO3质量分数偏大的为_____ (填字母)。
a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
ⅱ.然后向三颈烧瓶中通入SO2直至不再产生白色沉淀;
ⅲ.反应完毕后,将装置B中混合物过滤、酒精洗涤、干燥,即得成品。
已知:实验中还观察到装置D中溶液无明显现象,装置E中溶液红色褪去。
请回答下列问题:
(1)检查装置A气密性的操作方法为
(2)装置C的目的是
(3)实验步骤ⅱ中生成白色沉淀的离子方程式为
(4)实验步骤ⅲ中用酒精替代水洗涤的优点是
(5)为探究装置D、E中实验现象,化学兴趣小组对装置E中品红褪色的原因猜想如下:
猜想ⅰ:甲同学认为使品红褪色的微粒主要是
 ;
;猜想ⅱ:乙同学认为使品红褪色的微粒主要是
 ;。
;。为了验证猜想ⅰ和ⅱ,进行以下实验:
将10mL品红水溶液分成两份,在两份溶液中分别加入0.1mol·L-1的
(6)测定产品中
 的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是
的含量:称取0.4200g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL0.1000mol·L-1H2SO4溶液全部吸收,用0.0900mol·L-1标准NaOH溶液滴定过量的H2SO4,消耗NaOH溶液22.00mL,则样品中NH4CuSO3的质量分数是a.滴定前仰视滴定管读数,滴定后读数正确
b.NaOH标准溶液使用前敞口放置于空气中一段时间
c.滴定结束读数时,发现滴定管尖嘴处还悬有一滴标准氢氧化钠溶液
d.用H2SO4溶液吸收NH3操作缓慢,导致部分NH3外逸到空气中
您最近一年使用:0次
名校
6 . 实验室制备 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目_______ 。

 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的_______ 倍(保留小数点后2位,消毒能力可以用氧化剂转移电子数来衡量)。
 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的
您最近一年使用:0次
名校
7 . 氯气和一些含氯化合物常用作消毒剂。 制备流程可表述如下:
制备流程可表述如下:
① 与
与 作用生成
作用生成 ;
;
②在75℃左右, 进一步完全转化为
进一步完全转化为 ,
,
此步方程式为 (未配平)
(未配平)
(1)写出①生成 的化学方程式
的化学方程式_______ 。漂粉精久置空气中会变质,在变质过程中不会涉及的性质是_______
A. 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
(2)若某学生在上述流程中发现某含钙离子盐的化学式为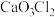 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号_______ 。
(3)若每一步反应均完全进行,且没有其他副产物,最终 与
与 的物质的量之比为
的物质的量之比为_______ 。
 制备流程可表述如下:
制备流程可表述如下:①
 与
与 作用生成
作用生成 ;
;②在75℃左右,
 进一步完全转化为
进一步完全转化为 ,
,此步方程式为
 (未配平)
(未配平)(1)写出①生成
 的化学方程式
的化学方程式A.
 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性(2)若某学生在上述流程中发现某含钙离子盐的化学式为
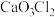 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号(3)若每一步反应均完全进行,且没有其他副产物,最终
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
8 . 碘量法测定维生素C的含量
利用I2的氧化性,以I2溶液为滴定剂进行分析的方法,称为直接碘量法。某研究小组用碘量法测定维生素C样品中维生素C 的含量并撰写如下实验报告。
碘量法测定维生素C的含量
实验目的:利用碘量法测定维生素C样品中维生素C的含量
实验原理:C6H8O6(维生素C)+I2=C6H6O6+2HI, 。
。
已知:维生素C样品中其余成分不与I2反应。
实验步骤:
①初配浓度约为0.0500mol·L-1的I2溶液
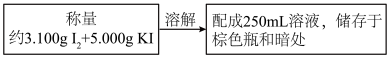
②准确配制0.1000mol·L-1的Na2S2O3溶液
③准确标定I2标准液的准确浓度
④测定维生素C的含量
每次测定时称维生素C样品2.000g于洁净锥形瓶中,加入室温除氧蒸馏水100.00mL、2.000mol·L-1的CH3COOH溶液10.00mL以调节pH,摇动溶解完全,加淀粉指示剂,摇匀,立即用I2标准溶液滴定到滴定终点,平行滴定3份,平均每份用去标准I2液90.00 mL。
⑤计算维生素C的质量分数
回答问题。
(1)本实验中无需用到的定量仪器是_______ 。
(2)已知I2+I-
 ,I2微溶于水,则配制I2溶液时,结合平衡移动原理解释加入KI的目的是
,I2微溶于水,则配制I2溶液时,结合平衡移动原理解释加入KI的目的是___________ 。
(3)标准I2溶液的准确浓度是________ (保留3位小数)。
(4)溶解维生素C样品时,要用新煮沸并冷却到室温的蒸馏水的原因是_______ ,直接用常温下未煮沸的蒸馏水溶解样品,则会使得测定结果________ (选填“偏大”、“偏小”或“无影响”)。溶解维生素C样品时,加入CH3COOH 的作用是_________ 。
(5)标准I2溶液滴定维生素C样品,确定滴定终点的现象是_________ 。维生素C样品中维生素C的质量分数为________ 。
(6)碘离子易与氧气发生反应:4I-+O2+4H+=2I2+2H2O。若用保存较久的标准I2溶液来滴定,则会使得最终测定的维生素C的质量分数_______ (选填“偏大”、“偏小”或“无影响”)。
利用I2的氧化性,以I2溶液为滴定剂进行分析的方法,称为直接碘量法。某研究小组用碘量法测定维生素C样品中维生素C 的含量并撰写如下实验报告。
碘量法测定维生素C的含量
实验目的:利用碘量法测定维生素C样品中维生素C的含量
实验原理:C6H8O6(维生素C)+I2=C6H6O6+2HI,
 。
。已知:维生素C样品中其余成分不与I2反应。
实验步骤:
①初配浓度约为0.0500mol·L-1的I2溶液

②准确配制0.1000mol·L-1的Na2S2O3溶液
③准确标定I2标准液的准确浓度

④测定维生素C的含量
每次测定时称维生素C样品2.000g于洁净锥形瓶中,加入室温除氧蒸馏水100.00mL、2.000mol·L-1的CH3COOH溶液10.00mL以调节pH,摇动溶解完全,加淀粉指示剂,摇匀,立即用I2标准溶液滴定到滴定终点,平行滴定3份,平均每份用去标准I2液90.00 mL。
⑤计算维生素C的质量分数
回答问题。
(1)本实验中无需用到的定量仪器是
 |  |  |  |
| A.电子天平 | B.滴定管 | C.250mL容量瓶 | D.温度计 |
(2)已知I2+I-

 ,I2微溶于水,则配制I2溶液时,结合平衡移动原理解释加入KI的目的是
,I2微溶于水,则配制I2溶液时,结合平衡移动原理解释加入KI的目的是(3)标准I2溶液的准确浓度是
(4)溶解维生素C样品时,要用新煮沸并冷却到室温的蒸馏水的原因是
(5)标准I2溶液滴定维生素C样品,确定滴定终点的现象是
(6)碘离子易与氧气发生反应:4I-+O2+4H+=2I2+2H2O。若用保存较久的标准I2溶液来滴定,则会使得最终测定的维生素C的质量分数
您最近一年使用:0次
名校
9 . “价类二维图”是学习元素及其化合物知识的重要模型,是氧化还原理论和物质分类思想在元素化合物知识学习过程中的具体体现和应用。氯元素的“价类二维图”如图所示。

(1)写出中子数为18的氯原子的化学符号:_______ ,“价类二维图”中有两种元素的简单离子电子层结构相同。写出正离子的结构示意图_______ ,负离子的电子式_______ 。
(2)下列关于a、Cl2、b的说法正确的是_______。

(1)写出中子数为18的氯原子的化学符号:
(2)下列关于a、Cl2、b的说法正确的是_______。
| A.相互间转化都是氧化还原反应 | B.a→Cl2一定要加入氧化剂 |
| C.Cl2→b一定要加入氧化剂 | D.都能用于杀菌消毒 |
您最近一年使用:0次
解题方法
10 . 回答下列问题。
I.酸雨是指 pH<5.6 的降水。
(1)下列气体中,与形成酸雨无关的是___________ 。
A.CO2 B.SO2 C.NOx
(2)从硫元素的化合价看,下列物质不具有氧化性的是___________。
Ⅱ.揭开浓硫酸的“神秘面纱”。
(3)在化工生产的过程中,一些试剂需要特殊的运输方式,比如具有强氧化性、强还原性、强腐蚀性等性质的试剂。通常情况下,下列物质可用铁制槽车装运的是___________。
I.酸雨是指 pH<5.6 的降水。
(1)下列气体中,与形成酸雨无关的是
A.CO2 B.SO2 C.NOx
(2)从硫元素的化合价看,下列物质不具有氧化性的是___________。
| A.Na2S | B.S | C.SO2 | D.H2SO4 |
Ⅱ.揭开浓硫酸的“神秘面纱”。
(3)在化工生产的过程中,一些试剂需要特殊的运输方式,比如具有强氧化性、强还原性、强腐蚀性等性质的试剂。通常情况下,下列物质可用铁制槽车装运的是___________。
| A.浓盐酸 | B.浓硫酸 | C.稀硫酸 | D.浓氢氧化钠溶液 |
您最近一年使用:0次



