名校
解题方法
1 . NaNO2在酸性条件下具有一定氧化性,工业提碘生产中有时也用其代替Cl2来氧化I-,自身被还原为NO,同时只能生成碘单质。
(1)已知误食亚硝酸钠后会导致人体血红蛋白中的Fe2+转化为Fe3+从而引起中毒,服用维生素C即可解毒,下列说法正确的是___________
(2)与Cl2相比,NaNO2在提碘时作为氧化剂使用也存在一定不足,例如___________ 因此在工业提碘过程中更多情况下还是采用Cl2作为氧化剂。
(3) NaNO2同样具有一定的还原性,实验室若以NaNO2为原料快速制备纯净的NaNO3溶液,下列适宜选择的氧化剂有___________
(4)请写出亚硝酸钠氧化I-的离子方程式。___________
(5)根据上述信息,请对①I2,②HIO3,③Cl2,④NaNO2这四个物质的氧化性由小到大进行排序(用序号表示)___________ 。
(1)已知误食亚硝酸钠后会导致人体血红蛋白中的Fe2+转化为Fe3+从而引起中毒,服用维生素C即可解毒,下列说法正确的是___________
| A.亚硝酸钠在此过程中被还原 |
| B.维生素C在此过程中被氧化 |
| C.Fe2+在中毒过程中作为氧化剂,在解毒过程中作为氧化产物 |
| D.Fe3+在中毒过程中作为还原产物,在解毒过程中作为还原剂 |
(3) NaNO2同样具有一定的还原性,实验室若以NaNO2为原料快速制备纯净的NaNO3溶液,下列适宜选择的氧化剂有___________
| A.氯水 | B.KMnO4 | C.O2 | D.H2O2 |
(5)根据上述信息,请对①I2,②HIO3,③Cl2,④NaNO2这四个物质的氧化性由小到大进行排序(用序号表示)
您最近一年使用:0次
名校
解题方法
2 . 漂白粉的效能是以有效氯的含量来衡量的。有效氯是指漂白粉与浓盐酸生成氯气的质量与漂白粉的质量之比。
(1)为了制备可用于测量有效氯的浓盐酸,将常温常压下39.6L的HCl气体溶于100mL的水中。已知,常温常压下,气体的摩尔体积为 ,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度
,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度________ (用小数表示,保留小数点后1位)。
(2)取10g漂白粉,向其中滴加足量所配制的浓盐酸,产生的气体在常温常压下的体积为1.225L,则漂白粉中次氯酸钙的质量分数为多少________ (用百分数表示)?
(3)已知,漂白粉中的有效氯一般为35%,请计算出这个批次的漂白粉的有效氯含量(用百分数表示),并判断其是否合格。________
(1)为了制备可用于测量有效氯的浓盐酸,将常温常压下39.6L的HCl气体溶于100mL的水中。已知,常温常压下,气体的摩尔体积为
 ,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度
,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度(2)取10g漂白粉,向其中滴加足量所配制的浓盐酸,产生的气体在常温常压下的体积为1.225L,则漂白粉中次氯酸钙的质量分数为多少
(3)已知,漂白粉中的有效氯一般为35%,请计算出这个批次的漂白粉的有效氯含量(用百分数表示),并判断其是否合格。
您最近一年使用:0次
3 . 为了从海带浸取液中提取碘,某同学设计了如图实验方案,解答下列问题:
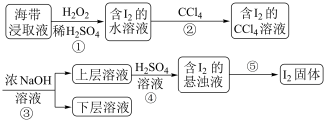
(1) 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因_______ ;_______
(2)实验操作②的名称为_______ ,操作②需要的仪器除烧杯、玻璃棒外,尚缺少的玻璃仪器有_______ ,碘的 溶液位于
溶液位于_______ 层(填“上”或“下”),呈_______ 色。检验水层是否仍含碘单质的方法是_______ 。
(3)③是将富集在 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为_______ 。
(4)本实验中可以循环利用的物质是_______ 。

(1)
 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因(2)实验操作②的名称为
 溶液位于
溶液位于(3)③是将富集在
 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为(4)本实验中可以循环利用的物质是
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.硫元素在人类生命活动以及生产生活中均发挥了重要作用,常见的硫磺皂、二硫化硒洗发水、葡萄酒中都有硫元素的身影。人类对硫元素的探索也在历史上留下了浓墨重彩的一笔,例如黑火药的发明、“绿矾油”的提炼……
(1)硫磺皂的主要成分是脂肪酸钠、硫单质,硫磺皂是最便宜的除螨杀菌药皂。请猜测硫磺皂的颜色___________ ,写出硫离子的电子式___________ 。
(2)下列各反应中,能证明氯气的氧化性比硫的氧化性强的反应是________
①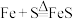

②
③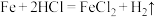
 跟浓
跟浓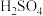 常温下发生钝化
常温下发生钝化
(3)在酿酒时人工添加 有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入
有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入 ,请用化学方程式表示该反应机理
,请用化学方程式表示该反应机理___________ 。
(4)发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总 小于
小于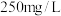 ,若在室温下,每升溶液中最多通入
,若在室温下,每升溶液中最多通入___________  。(室温下
。(室温下 )
)
(5)向 溶液中通入
溶液中通入 至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________
至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________
(6)在古代中国,稀硫酸被称为“绿矾油”。关于浓硫酸和稀硫酸的说法,错误的是_______
(7)常温下, 在浓硫酸中钝化,浓硫酸表现了______
在浓硫酸中钝化,浓硫酸表现了______
Ⅱ.某校化学兴趣小组同学取锌粒与浓 充分反应制取
充分反应制取 气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究。
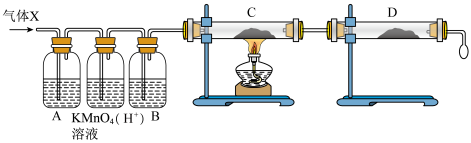
(8)杂质气体可能是___________ ,酸性 溶液的作用
溶液的作用___________ ;B中添加的试剂是___________ 。
(9)装置C中所装药品为___________ ,D中所装药品为___________ ,可证实气体X中混有较多量某杂质气体的实验现象是___________ 。
(1)硫磺皂的主要成分是脂肪酸钠、硫单质,硫磺皂是最便宜的除螨杀菌药皂。请猜测硫磺皂的颜色
(2)下列各反应中,能证明氯气的氧化性比硫的氧化性强的反应是________
①
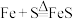

②

③
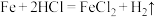
 跟浓
跟浓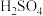 常温下发生钝化
常温下发生钝化| A.只有① | B.只有② | C.①② | D.①②③ |
(3)在酿酒时人工添加
 有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入
有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入 ,请用化学方程式表示该反应机理
,请用化学方程式表示该反应机理(4)发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总
 小于
小于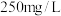 ,若在室温下,每升溶液中最多通入
,若在室温下,每升溶液中最多通入 。(室温下
。(室温下 )
)(5)向
 溶液中通入
溶液中通入 至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________
至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是_________A. | B. | C. | D. |
(6)在古代中国,稀硫酸被称为“绿矾油”。关于浓硫酸和稀硫酸的说法,错误的是_______
A.都有 分子 分子 | B.都有氧化性 |
| C.都能和铁、铝反应 | D.密度都比水大 |
(7)常温下,
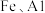 在浓硫酸中钝化,浓硫酸表现了______
在浓硫酸中钝化,浓硫酸表现了______| A.难挥发性 | B.吸水性 | C.脱水性 | D.强氧化性 |
Ⅱ.某校化学兴趣小组同学取锌粒与浓
 充分反应制取
充分反应制取 气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究。

(8)杂质气体可能是
 溶液的作用
溶液的作用(9)装置C中所装药品为
您最近一年使用:0次
名校
解题方法
5 . 氧化铁黄(化学式为 )是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾
)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾 为原料制备
为原料制备 。
。
(1)下列关于铁元素的认识正确的是___________。
(2)制备氧化铁黄的关键步骤是 溶液的氧化。为探究影响氧化
溶液的氧化。为探究影响氧化 溶液快慢的因素,现利用
溶液快慢的因素,现利用 、蒸馏水和稀
、蒸馏水和稀 配制四组溶液进行实验,实验结果如下表:
配制四组溶液进行实验,实验结果如下表:
①对比实验Ⅰ和Ⅱ可知,实验中影响氧化快慢的因素是___________ ;
②综合对比分析四组实验,简述影响氧化 溶液快慢的决定因素。
溶液快慢的决定因素。___________ 。
制备 的工艺流程包含如下环节
的工艺流程包含如下环节
(4)模拟氧化时,相关 变化记录如图。
变化记录如图。 时段,
时段, 逐渐减小的原因是反应生成了
逐渐减小的原因是反应生成了 ,配平下列化学方程式:
,配平下列化学方程式:___________ 。
________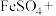 _______
_______ _______=______
_______=______ ______
______
 时段,经历的反应为:
时段,经历的反应为: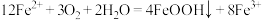 ,该过程
,该过程 继续平缓下降的原因可能是:
继续平缓下降的原因可能是:___________ 。(任写一条)
(5)判断流程中产品是否洗涤干净的方法是:___________ 。
氧化铁黄( )纯度可以通过产品的耗酸量确定,如下图所示。
)纯度可以通过产品的耗酸量确定,如下图所示。 (配合离子),
(配合离子),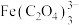 不与稀碱液反应。
不与稀碱液反应。
(6)①在溶液 中滴加
中滴加 标准溶液时,发生反应的离子方程式为
标准溶液时,发生反应的离子方程式为___________ ;
②若实验时加入了 的
的 ,消耗
,消耗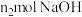 ,设氧化铁黄的式量为
,设氧化铁黄的式量为 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ ;(用含 、
、 、
、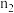 、
、 的代数式表示)
的代数式表示)
③测定时,若滴入 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”、“偏小”或“无影响”)。
 )是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾
)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾 为原料制备
为原料制备 。
。(1)下列关于铁元素的认识正确的是___________。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
(2)制备氧化铁黄的关键步骤是
 溶液的氧化。为探究影响氧化
溶液的氧化。为探究影响氧化 溶液快慢的因素,现利用
溶液快慢的因素,现利用 、蒸馏水和稀
、蒸馏水和稀 配制四组溶液进行实验,实验结果如下表:
配制四组溶液进行实验,实验结果如下表:| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
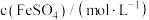 | 0.5 | 0.25 | 0.25 | 0.5 |
| 溶液pH | 2.9 | 2.9 | 3.5 | 3.3 |
| 初始颜色 | 浅绿色 | 浅绿色,较Ⅰ浅 | 浅绿色,同Ⅱ | 浅绿色,同Ⅰ |
 后颜色 后颜色 | 浅绿色 | 浅绿色 | 黄绿色 | 浅绿色 |
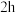 后颜色 后颜色 | 黄绿色 | 浅绿色 | 黄色 | 黄绿色 |
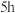 后颜色 后颜色 | 浅黄色 | 浅黄色,较I浅 | 黄色,较Ⅳ浅 | 黄色 |
②综合对比分析四组实验,简述影响氧化
 溶液快慢的决定因素。
溶液快慢的决定因素。制备
 的工艺流程包含如下环节
的工艺流程包含如下环节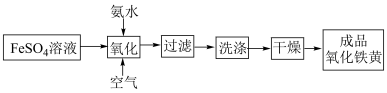
| A.烧杯 | B.漏斗 | C.玻璃棒 | D.蒸发皿 |
(4)模拟氧化时,相关
 变化记录如图。
变化记录如图。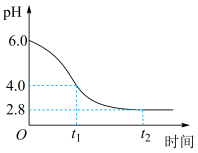
 时段,
时段, 逐渐减小的原因是反应生成了
逐渐减小的原因是反应生成了 ,配平下列化学方程式:
,配平下列化学方程式:________
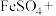 _______
_______ _______=______
_______=______ ______
______
 时段,经历的反应为:
时段,经历的反应为: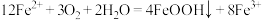 ,该过程
,该过程 继续平缓下降的原因可能是:
继续平缓下降的原因可能是:(5)判断流程中产品是否洗涤干净的方法是:
氧化铁黄(
 )纯度可以通过产品的耗酸量确定,如下图所示。
)纯度可以通过产品的耗酸量确定,如下图所示。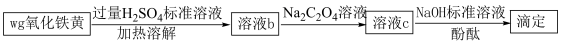
 (配合离子),
(配合离子),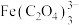 不与稀碱液反应。
不与稀碱液反应。(6)①在溶液
 中滴加
中滴加 标准溶液时,发生反应的离子方程式为
标准溶液时,发生反应的离子方程式为②若实验时加入了
 的
的 ,消耗
,消耗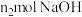 ,设氧化铁黄的式量为
,设氧化铁黄的式量为 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为 、
、 、
、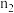 、
、 的代数式表示)
的代数式表示)③测定时,若滴入
 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
2024-01-13更新
|
428次组卷
|
3卷引用:上海市浦东新区2023-2024学年高三上学期一模化学试卷
上海市浦东新区2023-2024学年高三上学期一模化学试卷上海市闵行区多校联考2023-2024学年高三下学期三模考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
6 . 消毒剂因能杀灭病原微生物、切断传染病的传播途径而在生活中广泛应用。过氧乙酸(一元弱酸)、“84”消毒液、二氧化氯 、
、 、
、 等均是生活中常见消毒剂。
等均是生活中常见消毒剂。
(1)下列消毒剂属于电解质的是_______。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)解释“84”消毒液与洁厕灵(主要成分是盐酸)不能混合使用的原因_______ 。
(4)将氯气转化为液氯的过程中,说法错误的是_______。
(5)氯气与下列物质反应时,氯原子只得到电子的是_______。
(6)下列实验现象的“解释或结论”正确的是_______。
(7)在酸性介质中,次氯酸根与碘离子反应,析出碘。反应如下:
请标出电子转移的方向和数目_______ 。
(8)消毒效率可用单位质量消毒剂的得电子数来表示。计算 的消毒效率约是氯气的
的消毒效率约是氯气的_______ 倍。(保留到小数点后两位)
(9)用固体 通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。
通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。

已知:过程中锰元素最终转化为
 、
、 、
、 等均是生活中常见消毒剂。
等均是生活中常见消毒剂。(1)下列消毒剂属于电解质的是_______。
A. | B.过氧乙酸 | C. | D.“84”消毒液 |
(2)写出
 的电离方程式
的电离方程式(3)解释“84”消毒液与洁厕灵(主要成分是盐酸)不能混合使用的原因
(4)将氯气转化为液氯的过程中,说法错误的是_______。
| A.需要降温或加压 | B.氯分子间的平均距离减小 |
| C.氯分子数目减小 | D.氯分子间的作用力减小 |
(5)氯气与下列物质反应时,氯原子只得到电子的是_______。
| A.Cu | B. | C. | D. |
(6)下列实验现象的“解释或结论”正确的是_______。
| 选项 | 实验现象 | 解释或结论 |
| A | 氯气能使湿润的淀粉KI试纸变蓝:氯气能使 溶液变橙色 溶液变橙色 | 氧化性: |
| B | 氧气能使湿润的蓝色石蕊试纸先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | 氯气通入 的水溶液中,溶液的导电能力增强 的水溶液中,溶液的导电能力增强 | 氯气是强电解质 |
| D | 氧气通入 溶液中,溶液变棕黄色 溶液中,溶液变棕黄色 | 氧化性: |
| A.A | B.B | C.C | D.D |
(7)在酸性介质中,次氯酸根与碘离子反应,析出碘。反应如下:

请标出电子转移的方向和数目
(8)消毒效率可用单位质量消毒剂的得电子数来表示。计算
 的消毒效率约是氯气的
的消毒效率约是氯气的(9)用固体
 通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。
通过下列转化过程能制得某种具有消毒作用的气体。下列说法错误的是_______。
已知:过程中锰元素最终转化为

| A.G与H均为氧化产物 | B.实验中 只作氧化剂 只作氧化剂 |
| C.实验中浓盐酸体现出酸性和还原性 | D.G与H的物质的量之和可能为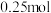 |
您最近一年使用:0次
名校
7 . 海水中溴元素以 形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
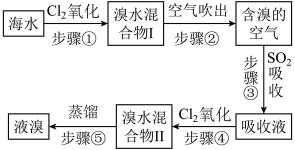
(1)步骤②用热空气将溴吹出,是因为___________。
(2)步骤③反应所得吸收液中溴元素以_______ (填微粒符号)形式存在,在反应中 体现
体现_______ (填“氧化性”或“还原性”)。
(3)在海水提溴生产工艺中,分离出溴常用蒸馏法。在蒸馏的过程中,温度应控制在80至90℃,温度过高或过低都不利于生产,请解释其原因:___________ 。
(4)流程中利用热空气将 吹出,也可用浓
吹出,也可用浓 溶液吸收,反应方程式为:
溶液吸收,反应方程式为:
①用单线桥标出上述反应电子转移的方向和数目________ 。
②该反应的氧化产物是_______ ,反应中若有 电子发生转移,则吸收了
电子发生转移,则吸收了_____  。
。
 形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
(1)步骤②用热空气将溴吹出,是因为___________。
A. 的化学性质稳定 的化学性质稳定 | B. 沸点低,易挥发 沸点低,易挥发 |
C. 易升华 易升华 | D. 不溶于水 不溶于水 |
(2)步骤③反应所得吸收液中溴元素以
 体现
体现(3)在海水提溴生产工艺中,分离出溴常用蒸馏法。在蒸馏的过程中,温度应控制在80至90℃,温度过高或过低都不利于生产,请解释其原因:
(4)流程中利用热空气将
 吹出,也可用浓
吹出,也可用浓 溶液吸收,反应方程式为:
溶液吸收,反应方程式为:
①用单线桥标出上述反应电子转移的方向和数目
②该反应的氧化产物是
 电子发生转移,则吸收了
电子发生转移,则吸收了 。
。
您最近一年使用:0次
8 . 氧化还原反应原理在生产生活和科学研究中应用广泛,反应的发生往往伴随着能量的转变。
(1)某同学取10mL0.1mol•L﹣1KI溶液,加入6mL0.1mol•L﹣1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡静置,CCl4层显紫色。
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;(已知:3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓蓝色)。
③第三支试管中加入1滴KSCN溶液,溶液变红。
氯化铁溶液呈___ 色;实验②检验的离子是________ (填离子符号);通过3个实验能得出该反应的离子方程式___________ 。
(2)FeCl3溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示:

①写出FeCl3溶液蚀刻铜箔的反应的离子方程式___________ 。
②从固体中分离出铜,试剂X是什么物质?___________ 。
③若要使滤液再生为蚀刻液,可采用什么办法?___________ 。
人类利用化学反应不仅可以创造新物质,还可以实现不同形式能量之间的转化。
(3)下列反应中,生成物总能量低于反应物总能量的是_______。
(4)为探究反应过程中的能量变化,某小组同学用如下装置进行实验。

①装置Ⅰ中,正极的电极反应式为________ 。
②关于装置Ⅰ和Ⅱ,下列叙述正确的是_______ 。
A.装置Ⅰ和Ⅱ均为化学能转化为电能 B.Ⅱ中电流从Zn片经导线流向Cu片
C.Ⅰ和Ⅱ中的实验现象一样 D.Ⅰ和Ⅱ中的金属铜都参与了电极反应
(1)某同学取10mL0.1mol•L﹣1KI溶液,加入6mL0.1mol•L﹣1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡静置,CCl4层显紫色。
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;(已知:3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓蓝色)。
③第三支试管中加入1滴KSCN溶液,溶液变红。
氯化铁溶液呈
(2)FeCl3溶液在工业上用于蚀刻铜箔电路板。从蚀刻后的废液中可回收铜并使蚀刻液再生,流程如图所示:

①写出FeCl3溶液蚀刻铜箔的反应的离子方程式
②从固体中分离出铜,试剂X是什么物质?
③若要使滤液再生为蚀刻液,可采用什么办法?
人类利用化学反应不仅可以创造新物质,还可以实现不同形式能量之间的转化。
(3)下列反应中,生成物总能量低于反应物总能量的是_______。
| A.碳酸钙受热分解 | B.灼热的碳与二氧化碳反应 |
| C.酒精燃烧 | D.煤与高温下的水蒸气反应 |
(4)为探究反应过程中的能量变化,某小组同学用如下装置进行实验。

①装置Ⅰ中,正极的电极反应式为
②关于装置Ⅰ和Ⅱ,下列叙述正确的是
A.装置Ⅰ和Ⅱ均为化学能转化为电能 B.Ⅱ中电流从Zn片经导线流向Cu片
C.Ⅰ和Ⅱ中的实验现象一样 D.Ⅰ和Ⅱ中的金属铜都参与了电极反应
您最近一年使用:0次
名校
9 . 稀土是一种重要的战略资源,我国是稀土储量最大的国家。铈( )是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为
)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为 )形式存在。工业上利用氟碳铈矿制取
)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:

下列说法错误的是
 )是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为
)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为 )形式存在。工业上利用氟碳铈矿制取
)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:
下列说法错误的是
A.倍烧过程中氧化剂与还原剂的物质的量之比为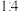 |
B.通过操作Ⅱ(包含酸溶、蒸发结晶)即可得到纯净的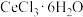 |
| C.酸浸过程中用稀硫酸和双氧水替代盐酸可体现环境友好 |
D. 中阴离子的空间构型为正四面体 中阴离子的空间构型为正四面体 |
您最近一年使用:0次
2024-01-09更新
|
409次组卷
|
4卷引用:上海市宜川中学2023-2024学年高三上学期期中考试卷(化学)
名校
解题方法
10 . 通过化学方法,人们不仅能从大自然中提取物质,还能制备出性质更佳优良的材料。氨是一种重要的化工原料,工业上常用浓氨水检验输送氯气的管道是否泄漏。其反应原理为:
___________NH3+___________Cl2=___________NH4Cl+___________N2
(1)配平上述反应方程式,并标出电子转移的方向及数目___________ 。
(2)实验室使用浓盐酸和MnO2制备Cl2,其化学方程式为:___________ 。
(3)NH3的电子式为___________ ,其中心原子的杂化类型为 ___________ 。
(4)N2分子中含___________ 个π键。
(5)向饱和氯水中加入少量亚硫酸钠固体,该溶液的性质会发生多种变化。请举例说明:
物理性质的变化:___________ 。
化学性质的变化:___________ 。
___________NH3+___________Cl2=___________NH4Cl+___________N2
(1)配平上述反应方程式,并标出电子转移的方向及数目
(2)实验室使用浓盐酸和MnO2制备Cl2,其化学方程式为:
(3)NH3的电子式为
(4)N2分子中含
(5)向饱和氯水中加入少量亚硫酸钠固体,该溶液的性质会发生多种变化。请举例说明:
物理性质的变化:
化学性质的变化:
您最近一年使用:0次



