名校
解题方法
1 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
名校
2 . 汽车尾气中主要含有 、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
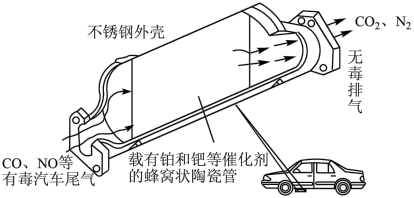
(1)下列关于汽车尾气处理的说法正确的是___________
(2)汽车尾气中的NO来源不合理的是___________ 。
A.氨和氧气在催化剂的作用下转化而成
B.氮气和氧气在火花塞放电时反应生成
C.氮气和氧气在高温条件下转化而成
(3)尽管催化转化器可以处理CO、NO,但是催化剂也容易将 转化为
转化为 ,从而引起酸雨问题。
,从而引起酸雨问题。 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
 、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
、CO、NO等物质,治理方法之一是在汽车的排气管上安装“催化转化器”,其中CO和NO可以转化为两种无毒的气体,如图所示。
(1)下列关于汽车尾气处理的说法正确的是___________
A.这是一个产生 的置换反应 的置换反应 |
B.汽车尾气的主要污染成分包括CO、NO和 |
| C.尾气进入催化转化器前,必须有措施控制NO和CO的排出比例 |
| D.铂和钯等催化剂能够催化所有气体之间的反应 |
(2)汽车尾气中的NO来源不合理的是
A.氨和氧气在催化剂的作用下转化而成
B.氮气和氧气在火花塞放电时反应生成
C.氮气和氧气在高温条件下转化而成
(3)尽管催化转化器可以处理CO、NO,但是催化剂也容易将
 转化为
转化为 ,从而引起酸雨问题。
,从而引起酸雨问题。 转化为
转化为 的化学方程式为
的化学方程式为
您最近一年使用:0次
3 . 联氨(N2H4)又称“肼”,具高吸湿性、沸点386.5K、毒性强、还原性强等特性,燃烧释放出大量的热,常用于做火箭的燃料以及分析试剂中的还原剂。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式___________ ;此反应中,被氧化的元素是_____ 。每生成1mol肼,转移的电子数为________ 。
Ⅱ .联氨的结构
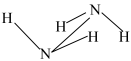
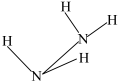
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是________ 。
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是_____ 。
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是_____ 。
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是_____ (填写化学式)。实验发现0.1mol·L-1N2H6SO4溶液显酸性,原因是_____ (用离子方程式表示),溶液中各种含氮微粒存在关系c(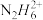 )+c(N2H6OH+)
)+c(N2H6OH+)____ 0.1-c(N2H4·2H2O)(选填“>”,“<”或“=”)。
(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是_______ 。肼有剧毒,但目前仍被普遍用作火箭的燃料,原因是________ 。
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
室温下,则同浓度的HNO2和HN3,其pH值:HNO2____ HN3(选填“>”、“<”或“=”),  反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为_________ 。
(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
并已知1molN2H4(l)→N2H4(g)与2molH2O2(l)→H2O2(g)共吸热23.76kJ,据此估算化学反应N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)的焓变ΔH=_______ kJ·mol-1,反应的熵变ΔS _____ 0(选填“>”、“<”)。研究小组利用此反应设计出如下电池,负极电极反应式:N2H4+4OH-−4e-=N2+4H2O。则正极电极反应式:________ 。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是
|
|
| A. 反式结构 | B. 顺式结构 |
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是
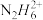 )+c(N2H6OH+)
)+c(N2H6OH+)(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
| 酸名 | 亚硝酸(HNO2) | 叠氮酸(HN3) |
| 电离平衡常数 | 5.1 x 10-4 | 1.8 x 10-5 |
 反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
| 化学键 | N-H | O-H | O-O | N-N | N≡N |
| 键能(kJ·mol-1) | 391 | 467 | 138 | 159 | 945 |
您最近一年使用:0次
名校
解题方法
4 . 下列由实验现象所得结论正确的是
A.向 溶液中滴入稀硫酸酸化的 溶液中滴入稀硫酸酸化的 溶液,溶液由浅绿色变为黄色,证明 溶液,溶液由浅绿色变为黄色,证明 氧化性大于 氧化性大于 |
B.向某无色溶液中滴加1—2滴酚酞试液,一段时间后溶液仍呈无色,证明该溶液的 |
C.常温下将带火星的木条放入浓 加热分解生成的气体中,木条复燃,证明 加热分解生成的气体中,木条复燃,证明 支持燃烧 支持燃烧 |
D.将某气体通入淀粉和 的混合溶液,蓝色褪去,证明该气体具有漂白性 的混合溶液,蓝色褪去,证明该气体具有漂白性 |
您最近一年使用:0次
2024-02-11更新
|
367次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期11月考化学试卷
名校
5 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
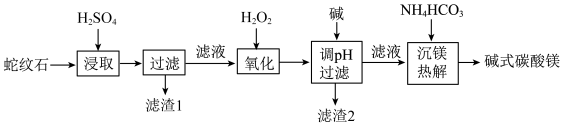
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
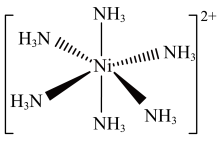
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
228次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
名校
6 . I.人类活动中的碳排放无可避免。
(1)配平下列反应,并标出电子转移的方向和数目。___________
___________CH4+___________NO2 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O
(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在___________ 生成H2O2。
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:___________ 。
Ⅱ.一种富集CO2的原电池模拟装置如下图。
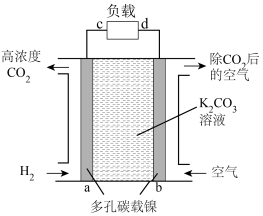
(3)b极为___________ 极(填“正”或“负”),a电极上发生的电极反应为___________ 。
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
(1)配平下列反应,并标出电子转移的方向和数目。
___________CH4+___________NO2
 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:
Ⅱ.一种富集CO2的原电池模拟装置如下图。

(3)b极为
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
您最近一年使用:0次
名校
7 . 氨气是重要的化工原料,氨水、硝酸盐、铵盐等均可作化肥产品。
(1)在VL浓度为 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为___________  。
。
(2)在自然界的氮循环过程中,硝化细菌将土壤中的 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为___________ ,写出 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式___________ 。
(1)在VL浓度为
 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为 。
。(2)在自然界的氮循环过程中,硝化细菌将土壤中的
 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式
您最近一年使用:0次
8 . 氯及其化合物在日常生活中有广泛应用。某实验小组设计多组实验,对氯气及氯的化合物的性质进行研究
I.氯气的制备与性质研究
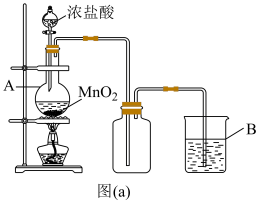
(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为___________ 。
(2)图中仪器A的名称是___________ 。
(3)装置B内的溶液可以是___________ 。
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。
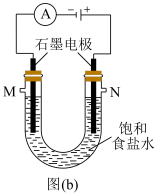
①图(b)反应的化学方程式为___________ 。
②检验制得的烧碱溶液中是否含有NaCl的实验方法是___________ 。
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有___________ ;若其它操作不变,将A与C连接,②中观察到的现象有___________ 。
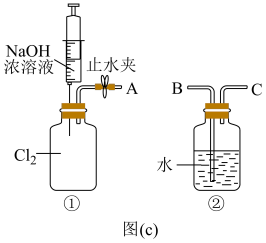
Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。
i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
(6)各装置的连接顺序为___________ 。
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为___________ 。
(8)装置④的作用有___________ 。(至少写出2点)
I.氯气的制备与性质研究

(1)实验室中常用如图(a)所示的装置制备氯气,反应的化学方程式为
(2)图中仪器A的名称是
(3)装置B内的溶液可以是
(4)实验室中常用图(b)所示的装置制备氯气,并同时得到较浓的烧碱溶液。

①图(b)反应的化学方程式为
②检验制得的烧碱溶液中是否含有NaCl的实验方法是
③用图(c)所示的组合装置验证氯气与烧碱溶液的反应。将A与B连接,打开止水夹,用注射器注入过量NaOH浓溶液,观察到的现象有

Ⅱ.次氯酸是重要的含氯化合物,应用于杀菌消毒、漂白等领域。学习小组以Cl2O为原料制备HClO。

i.常温常压下Cl2O是一种黄绿色气体
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2
 =2I-+
=2I-+
(5)装置③中的液体不可燃、不助燃也不导电,关于其用途正确的是___________。
| A.可浮于水溶液上方——隔绝空气 | B.与水互不相溶——萃取剂 |
| C.可隔绝空气——灭火剂 | D.遇碘变色——指示剂 |
(6)各装置的连接顺序为
①→___________→___________→___________→___________
(7)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
(8)装置④的作用有
您最近一年使用:0次
9 . 目前支原体肺炎流行,及时消毒有利于降低感染几率。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂等,其中含氯消毒剂的家族最庞大、应用最广泛。
(1)次氯酸钠( )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为___________ 。
(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是___________ ,若生成标况下44.8L的 ,转移电子的数目为
,转移电子的数目为___________ 。
(3)如果在不同温度、浓度的条件下, 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,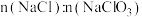 为
为___________ ,整个过程,参加反应所需 与氯气的物质的量之比为
与氯气的物质的量之比为___________ 。
若将 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:
(4) 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法___________ 。
A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
亚氯酸钠( )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。 在发生器中发生
在发生器中发生________ (氧化或还原)反应,该反应的还原产物为_________ ,吸收塔中温度不宜过高,否则会导致 产率下降,原因是
产率下降,原因是___________ 。
(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为___________ 。(保留两位小数)。
(1)次氯酸钠(
 )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是
 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是 ,转移电子的数目为
,转移电子的数目为(3)如果在不同温度、浓度的条件下,
 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,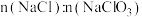 为
为 与氯气的物质的量之比为
与氯气的物质的量之比为若将
 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:(4)
 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
A. amol amol | B. amol amol | C. amol amol | D.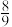 amol amol |
亚氯酸钠(
 )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。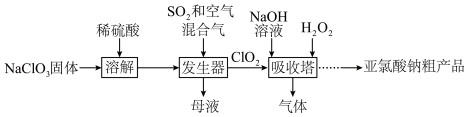
 在发生器中发生
在发生器中发生 产率下降,原因是
产率下降,原因是(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克
 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2024-02-02更新
|
0次组卷
|
2卷引用:上海交通大学附属中学2023-2024学年高一上学期期末化学试卷
名校
解题方法
10 . Ⅰ.完成下列问题
(1)下列有关次氯酸钠的说法错误的是___________ 。
a.次氯酸钠可用于游泳池的消毒 b.次氯酸钠可由 溶液与氯气反应制得
溶液与氯气反应制得
c.次氯酸钠属于弱电解质 d.次氯酸钠水溶液呈碱性
(2)下列物质均可用于漂白,漂白原理不同于其它的是___________ 。
a.次氯酸钙 b.次氯酸钠 c.氯水 d.二氧化硫
(3)次氯酸钠固体在一定条件下发生分解反应,可能形成的产物是___________ 。
a. 和
和 b.
b. 和
和 c.
c. 和
和 d.
d. 和
和
Ⅱ. 可用于除去印刷电路板工业废水中的氨氮
可用于除去印刷电路板工业废水中的氨氮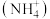 ,加入过量次氯酸钠可使废水中的
,加入过量次氯酸钠可使废水中的 完全转化为
完全转化为 ,而本身被还原为
,而本身被还原为 。反应如下:
。反应如下:
(4)配平上述反应的方程式,并标出电子转移的方向和数目___________ 。
(5)检验废水中是否存在 的方法是
的方法是___________ 。
(6)若处理废水产生了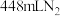 (标准状况),则转移的电子数为
(标准状况),则转移的电子数为___________ 。
Ⅲ.用 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为的转化率随
转化为的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。

(7)在酸性 溶液中,
溶液中, 能氧化
能氧化 生成
生成 和
和 ,写出
,写出 氧化
氧化 的离子方程式
的离子方程式___________ 。
(8) 溶液的初始
溶液的初始 越小,
越小, 转化率越高。其原因是
转化率越高。其原因是___________ 。
(1)下列有关次氯酸钠的说法错误的是
a.次氯酸钠可用于游泳池的消毒 b.次氯酸钠可由
 溶液与氯气反应制得
溶液与氯气反应制得c.次氯酸钠属于弱电解质 d.次氯酸钠水溶液呈碱性
(2)下列物质均可用于漂白,漂白原理不同于其它的是
a.次氯酸钙 b.次氯酸钠 c.氯水 d.二氧化硫
(3)次氯酸钠固体在一定条件下发生分解反应,可能形成的产物是
a.
 和
和 b.
b. 和
和 c.
c. 和
和 d.
d. 和
和
Ⅱ.
 可用于除去印刷电路板工业废水中的氨氮
可用于除去印刷电路板工业废水中的氨氮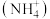 ,加入过量次氯酸钠可使废水中的
,加入过量次氯酸钠可使废水中的 完全转化为
完全转化为 ,而本身被还原为
,而本身被还原为 。反应如下:
。反应如下:
(4)配平上述反应的方程式,并标出电子转移的方向和数目
(5)检验废水中是否存在
 的方法是
的方法是(6)若处理废水产生了
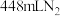 (标准状况),则转移的电子数为
(标准状况),则转移的电子数为Ⅲ.用
 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为的转化率随
转化为的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。
(7)在酸性
 溶液中,
溶液中, 能氧化
能氧化 生成
生成 和
和 ,写出
,写出 氧化
氧化 的离子方程式
的离子方程式(8)
 溶液的初始
溶液的初始 越小,
越小, 转化率越高。其原因是
转化率越高。其原因是
您最近一年使用:0次