1 . 实验室用 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: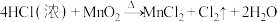
(1)该反应中被氧化的元素是___________ ,还原产物是___________ ;
(2)用单线桥标明电子转移的方向与数目___________ 。
(3)该反应中,氧化剂与还原剂的物质的量之比为___________ (前者比后者);盐酸在反应中表现出来的性质是___________ 。
(4)当生成标准状况下 时,转移的电子数目为
时,转移的电子数目为___________ ,被氧化的还原剂的物质的量为___________ 。
(5)也可以用 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:___________ 。
(6)举例说明氯气的氧化性比硫单质强,___________ 。
 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: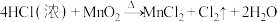
(1)该反应中被氧化的元素是
(2)用单线桥标明电子转移的方向与数目
(3)该反应中,氧化剂与还原剂的物质的量之比为
(4)当生成标准状况下
 时,转移的电子数目为
时,转移的电子数目为(5)也可以用
 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:(6)举例说明氯气的氧化性比硫单质强,
您最近一年使用:0次
名校
解题方法
2 . 炼铁的原理是利用CO还原铁的氧化物。以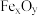 代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:___________ 。
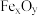 代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
您最近一年使用:0次
名校
3 . 氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂为___________ 。(写化学式)
您最近一年使用:0次
名校
4 . 硫酸亚铁铵 是分析化学中的重要试剂。隔绝空气加热至
是分析化学中的重要试剂。隔绝空气加热至 时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、硫的氧化物、氨气和水蒸气等。
时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、硫的氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用如图所示部分装置进行实验(夹持装置略)
(2)有关硫酸亚铁铵所含的元素,下列说法正确的是___________。
实验I:探究分解产物中硫的氧化物,连接装置A-E-F-B进行实验。
(3)实验现象:E中没有明显现象,F中溶液褪色,据此得出的结论是___________ 。
实验Ⅱ:验证分解产物中含有氨气和水蒸气、探究残留固体成分。连接A-C-B-D进行实验。
(4)关于氨气和水,下列说法错误的是___________。
(5)装置B在实验Ⅱ中的作用是___________ 。
(6)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3
,而不含 或
或 :
:___________ 。
(7)实验证明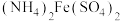 受热分解除生成上述两个实验中的产物外,还有
受热分解除生成上述两个实验中的产物外,还有 产生,写出A中反应的化学方程式
产生,写出A中反应的化学方程式___________ 。
实验Ⅲ:为测定硫酸亚铁铵 晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成
晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成 溶液,取
溶液,取 硫酸亚铁铵溶液进行如下实验:
硫酸亚铁铵溶液进行如下实验:___________ (用含w、m的式子表示)。
(9)若缺少“洗涤”步骤,最终结果会___________ (填偏大、偏小或不变)。
 是分析化学中的重要试剂。隔绝空气加热至
是分析化学中的重要试剂。隔绝空气加热至 时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、硫的氧化物、氨气和水蒸气等。
时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、硫的氧化物、氨气和水蒸气等。[实验探究]某化学小组选用如图所示部分装置进行实验(夹持装置略)
| A.溶于水部分电离 | B.固体中只有离子键 |
| C.固体中既含离子键又含共价键 | D.能发生复分解反应或氧化还原反应 |
(2)有关硫酸亚铁铵所含的元素,下列说法正确的是___________。
| A.都位于短周期 | B.只有一个副族元素 |
C.同主族元素非金属性: | D.同周期元素原子半径: |
实验I:探究分解产物中硫的氧化物,连接装置A-E-F-B进行实验。
(3)实验现象:E中没有明显现象,F中溶液褪色,据此得出的结论是
实验Ⅱ:验证分解产物中含有氨气和水蒸气、探究残留固体成分。连接A-C-B-D进行实验。
(4)关于氨气和水,下列说法错误的是___________。
| A.都是弱电解质 | B.都是共价化合物 | C.都是以分子构成物质 | D.氨水中只有两种离子 |
(5)装置B在实验Ⅱ中的作用是
(6)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3
,而不含
 或
或 :
:(7)实验证明
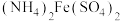 受热分解除生成上述两个实验中的产物外,还有
受热分解除生成上述两个实验中的产物外,还有 产生,写出A中反应的化学方程式
产生,写出A中反应的化学方程式实验Ⅲ:为测定硫酸亚铁铵
 晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成
晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成 溶液,取
溶液,取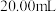 硫酸亚铁铵溶液进行如下实验:
硫酸亚铁铵溶液进行如下实验:
(9)若缺少“洗涤”步骤,最终结果会
您最近一年使用:0次
名校
5 . 通过如下实验,比较 、
、 、
、 的氧化性。
的氧化性。
(1)实验室 溶液通常盛放在
溶液通常盛放在___________ 试剂瓶中。
(2)Ⅱ中反应的离子方程式为___________ 。
(3)I、Ⅱ中的现象说明___________。
(4)实验后,I试管壁上的黑色沉淀可用___________洗去。
(5)写出检验I中是否含有 的方法。
的方法。___________ 。
(6)检验Ⅱ中是否含有 不可选用:___________。(不定项)
不可选用:___________。(不定项)
(7)推测Ⅲ中未发生 氧化
氧化 的原因
的原因___________ 。
 、
、 、
、 的氧化性。
的氧化性。
| 实验现象 |
I中产生黑色沉淀,滴加 溶液,变红 溶液,变红 | |
| Ⅱ中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| Ⅲ中产生黄色沉淀,滴加淀粉溶液,未变蓝 |
(1)实验室
 溶液通常盛放在
溶液通常盛放在(2)Ⅱ中反应的离子方程式为
(3)I、Ⅱ中的现象说明___________。
A.氧化性顺序: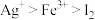 | B.氧化性顺序: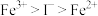 |
C.还原性顺序: | D.还原性顺序: |
(4)实验后,I试管壁上的黑色沉淀可用___________洗去。
| A.酒精 | B.二硫化碳 | C.浓硝酸 | D.热盐酸 |
(5)写出检验I中是否含有
 的方法。
的方法。(6)检验Ⅱ中是否含有
 不可选用:___________。(不定项)
不可选用:___________。(不定项)| A.氢氧化钠溶液 | B.酸性高辒酸钾溶液 | C.硫氰化钾溶液 | D.稀氨水 |
(7)推测Ⅲ中未发生
 氧化
氧化 的原因
的原因
您最近一年使用:0次
6 . 一定条件下,Co2+与肼在碱性环境中反应制得高纯度纳米钴。请完成相应的离子方程式_______ :
N2H4+Co2++ Co+N2↑+
Co+N2↑+
检验产品的颗粒尺寸是否为纳米级的简易方案是:_____________ 。
N2H4+Co2++
 Co+N2↑+
Co+N2↑+ 检验产品的颗粒尺寸是否为纳米级的简易方案是:
您最近一年使用:0次
解题方法
7 . 实验室模拟工业法用软锰矿(主要成分为MnO2,杂质不参与反应)制KMnO4,主要流程如下:
(1)补全“焙烧”时发生的化学反应方程式,并用单线桥标出电子转移方向和数目_____ 。_____ (填写范围)之间,理由是_____ 。
(3)有同学建议操作Ⅰ中用盐酸代替通CO2,分析是否合理_____ (选填“合理”或“不合理”),并说出理由_____ 。
(4)操作Ⅱ包括蒸发浓缩、_____ 、过滤、洗涤、干燥,为进一步提纯KMnO4晶体,应采用的实验方法是_____ 。
(5)为提高原料利用率,能循环利用的物质是_____ 。
A. KClO3 B. KOH C. K2MnO4 D. MnO2
(6)假设软锰矿中MnO2质量分数为52.2%,不考虑物质循环与制备过程中的损失,1t软锰矿理论上可制得KMnO4固体_____ kg。
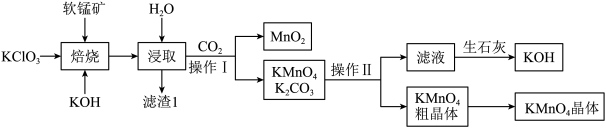
(1)补全“焙烧”时发生的化学反应方程式,并用单线桥标出电子转移方向和数目
 MnO2+
MnO2+ KClO3+
KClO3+ KOH
KOH
 K2MnO4+
K2MnO4+ KCl+
KCl+
(3)有同学建议操作Ⅰ中用盐酸代替通CO2,分析是否合理
(4)操作Ⅱ包括蒸发浓缩、
(5)为提高原料利用率,能循环利用的物质是
A. KClO3 B. KOH C. K2MnO4 D. MnO2
(6)假设软锰矿中MnO2质量分数为52.2%,不考虑物质循环与制备过程中的损失,1t软锰矿理论上可制得KMnO4固体
您最近一年使用:0次
解题方法
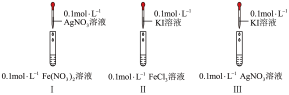
8 . 为探究+1价Ag的氧化性,开展如下活动。
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为_______ 、操作②为_______ 。_______ g固体。
③实验室AgNO3溶液通常盛放在_______ 试剂瓶中。
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:_______ 。
②I、II中的现象说明:_______ 。
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因_______ 。
(3)利用如下图所示装置,探究Ag+氧化I–的反应。_______ 。
A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作_______ 。
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是 氧化了I–,将装置中的
氧化了I–,将装置中的_______ 溶液换成_______ ,闭合K,指针未发生偏转,确认Ag+氧化了I–。
取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。_______ 。
(5)为得到光亮的银镜,实验时应做到:_______ (任写2点)。若黑色沉淀全部转化为银镜,理论上需要乙醛_______ mol。
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为

③实验室AgNO3溶液通常盛放在
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
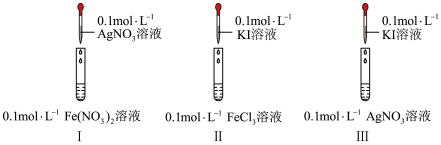
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:
②I、II中的现象说明:
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因
(3)利用如下图所示装置,探究Ag+氧化I–的反应。

A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是
 氧化了I–,将装置中的
氧化了I–,将装置中的取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。
(5)为得到光亮的银镜,实验时应做到:
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
您最近一年使用:0次
解题方法
9 . Fe/Fe3O4复合物是一种高密度磁记录材料,磁记录材料有记录和存储信息的功能。制备该材料的一种流程如下:
Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为_____ 。该“反应”中通入氩气的原因_____ 。
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
3.已知参加反应的FeCl2溶液浓度为lmol·L−1。由题给信息分析,25℃时,当pH<2时,Fe/Fe3O4产率极低的原因_____ 。
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。_____ 。
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
6.从绿色化学角度评价该循环过程(说一点)。_____

Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
| A.SO2 | B.铁粉 |
| C.KSCN溶液 | D.KSCN溶液新制氯水 |
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。

通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
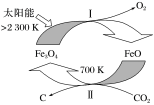
| A.反应物 | B.中间产物 | C.催化剂 | D.产物 |
您最近一年使用:0次
10 . 选择性催化还原法(SCR)是指在一定温度和催化剂下,适当通入空气,以氨为还原剂,将氮氧化物转化为无毒气体。_____ 。
2.此法仅限于低硫煤烟气脱硝,中高硫煤产生的高浓度二氧化硫会影响脱硝速率,可能的原因是_____ 。

2.此法仅限于低硫煤烟气脱硝,中高硫煤产生的高浓度二氧化硫会影响脱硝速率,可能的原因是
您最近一年使用:0次