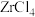解题方法
1 . 利用热镀锌厂在生产过程中产生的副产品锌灰(主要成分为ZnO、 及少量
及少量 、CuO、PbO等)为原料制备氧化锌或皓矾(
、CuO、PbO等)为原料制备氧化锌或皓矾( )工艺流程如下:
)工艺流程如下: 、
、 进入溶液;
进入溶液;
②25℃时, ,
, ;
;
③深度除杂标准:溶液中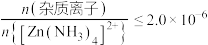 ;
;
④有机萃取剂(用HR表示)可萃取出 ,其萃取原反应为:
,其萃取原反应为: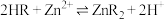 。
。
(1)浸渣中含有的物质包括PbOCl、______ 。
(2)除砷时, 转化为
转化为 沉淀,写出该反应的离子方程式
沉淀,写出该反应的离子方程式______ 。
(3)若深度除铜所得滤液中 的浓度为0.2
的浓度为0.2 ,则溶液中
,则溶液中 (不考虑水解)浓度至少为
(不考虑水解)浓度至少为______  ,才能达到深度除杂标准。
,才能达到深度除杂标准。
(4)反萃取加入的X最佳物质为______ 。
(5)“沉锌”过程获得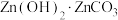 ,离子方程式为
,离子方程式为______ 。
(6)获取皓矾的一系列操作包括______ 、过滤、洗涤、干燥。取28.7g产品加热至不同温度,剩余固体的质量变化如图所示。已知B→D的过程中产生两种气体,分析数据,写出该过程的化学方程式______ 。
 及少量
及少量 、CuO、PbO等)为原料制备氧化锌或皓矾(
、CuO、PbO等)为原料制备氧化锌或皓矾( )工艺流程如下:
)工艺流程如下:
 、
、 进入溶液;
进入溶液;②25℃时,
 ,
, ;
;③深度除杂标准:溶液中
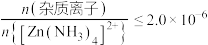 ;
;④有机萃取剂(用HR表示)可萃取出
 ,其萃取原反应为:
,其萃取原反应为: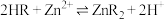 。
。(1)浸渣中含有的物质包括PbOCl、
(2)除砷时,
 转化为
转化为 沉淀,写出该反应的离子方程式
沉淀,写出该反应的离子方程式(3)若深度除铜所得滤液中
 的浓度为0.2
的浓度为0.2 ,则溶液中
,则溶液中 (不考虑水解)浓度至少为
(不考虑水解)浓度至少为 ,才能达到深度除杂标准。
,才能达到深度除杂标准。(4)反萃取加入的X最佳物质为
(5)“沉锌”过程获得
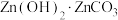 ,离子方程式为
,离子方程式为(6)获取皓矾的一系列操作包括
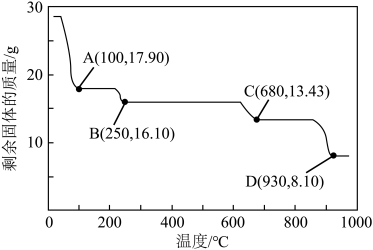
您最近一年使用:0次
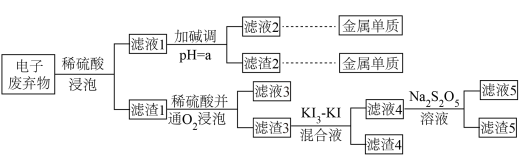
2 . 以电子废弃物(主要含Au、Cu、Co、Ni等金属单质)为原料绿色化回收这些金属的工艺流程如下。 (离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(1)滤渣3的主要成分是_______ 。
(2)Co(OH)₂的酸式电离方程式为_______ ,其平衡常数为_______ ,滤液1中金属离子的浓度均为10⁻³mol⋅L⁻¹,加碱调pH的过程中溶液体积变化忽略平计,则a=_______ ,此时Ni²⁺的浓度为_______ mol·L⁻¹。
(3)滤液4的主要阴离子是Aul ,加入Na2S2O5溶液反应的离子方程式是
,加入Na2S2O5溶液反应的离子方程式是_______ 。
(4)已知: 滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是_______ 。
 (离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。(1)滤渣3的主要成分是
(2)Co(OH)₂的酸式电离方程式为
(3)滤液4的主要阴离子是Aul
 ,加入Na2S2O5溶液反应的离子方程式是
,加入Na2S2O5溶液反应的离子方程式是(4)已知:
 滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
您最近一年使用:0次
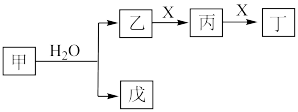
3 . I.某些常见无机物质存在如图的化学转化关系(部分生成物和反应条件略去),回答下列问题:________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为________ ,当 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为________ 。
(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式________ 。戊是氢氧化物,既能和强酸反应又能和强碱反应,则甲的化学式为________ 。
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:____________ 。
(5)X的化学式为________ ,X能和浓盐酸反应生成黄绿色气体,X在反应中作________ (填“氧化剂”或“还原剂”),若反应了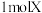 ,该反应转移电子的个数为
,该反应转移电子的个数为________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为
 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水
 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题: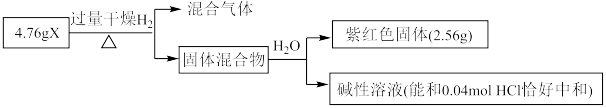
(5)X的化学式为
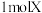 ,该反应转移电子的个数为
,该反应转移电子的个数为
您最近一年使用:0次
4 . 实验室可用干燥的氯气与亚氯酸钠 固体反应来制备
固体反应来制备 ,装置如图所示,已知
,装置如图所示,已知 常温下为黄绿色气体,熔点
常温下为黄绿色气体,熔点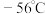 ,沸点
,沸点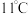 ,极易溶于水且不与水反应,高浓度的
,极易溶于水且不与水反应,高浓度的 受热时易爆炸,下列说法正确的是
受热时易爆炸,下列说法正确的是
 固体反应来制备
固体反应来制备 ,装置如图所示,已知
,装置如图所示,已知 常温下为黄绿色气体,熔点
常温下为黄绿色气体,熔点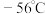 ,沸点
,沸点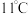 ,极易溶于水且不与水反应,高浓度的
,极易溶于水且不与水反应,高浓度的 受热时易爆炸,下列说法正确的是
受热时易爆炸,下列说法正确的是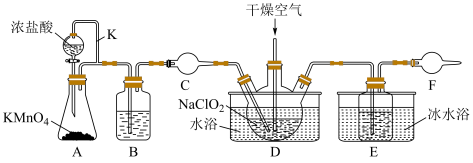
| A.导气管K的作用是平衡气压,保证液体顺利流下 |
| B.C和F中可选用同一种物质 |
C.D中通入一定量的干燥空气,目的主要是将生成的 带入到E中,便于收集. 带入到E中,便于收集. |
D.D中发生的化学反应中氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
5 . 某科研小组通过以下方案制备连二亚硫酸钠( )并测定其纯度。
)并测定其纯度。
资料: 具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时
具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时 在水溶液中以
在水溶液中以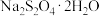 形态结晶,高于52℃时
形态结晶,高于52℃时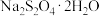 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。
回答下列问题:
(1)无氧条件下,用锌粉还原 和
和 的混合液,即可制得连二亚硫酸钠;
的混合液,即可制得连二亚硫酸钠;

操作步骤:连接装置,关闭三通阀→___________ (填操作名称)→称取一定质量Zn置于三颈烧瓶中→___________ (填标号)pH传感→搅拌直至完全溶解。 和
和 的混合液→充入
的混合液→充入 →抽真空
→抽真空
B.抽真空→注入 和
和 的混合液→充入
的混合液→充入
C.抽真空→充入 →注入
→注入 和
和 的混合液
的混合液
(2)在上述所得溶液中滴加稍过量NaOH溶液控制pH在8.2~10.5之间,使 转化为
转化为 沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→
沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→___________ →用乙醇洗涤→干燥,可获得 。
。
(3)隔绝空气加热 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和
和 ,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有
,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有 :
:___________ 。
(4)下图是硫的四种含氧酸根的结构推断具有强氧化性的是___________ (填标号); 转化为
转化为 的离子反应方程式为
的离子反应方程式为___________ 。
(5) 含量的测定
含量的测定
实验原理: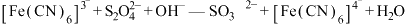 (未配平)。
(未配平)。
实验过程:称取0.25g产品加入三颈烧瓶中,维持氮气氛围,加入适量NaOH溶液,再滴加0.10
 标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中
标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中 的质量分数为
的质量分数为
___________ %(杂质不参与反应,保留四位有效数字)。
 )并测定其纯度。
)并测定其纯度。资料:
 具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时
具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时 在水溶液中以
在水溶液中以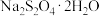 形态结晶,高于52℃时
形态结晶,高于52℃时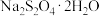 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。回答下列问题:
(1)无氧条件下,用锌粉还原
 和
和 的混合液,即可制得连二亚硫酸钠;
的混合液,即可制得连二亚硫酸钠;
操作步骤:连接装置,关闭三通阀→
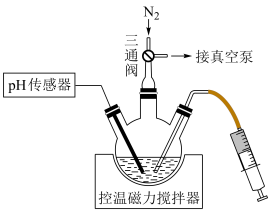
 和
和 的混合液→充入
的混合液→充入 →抽真空
→抽真空B.抽真空→注入
 和
和 的混合液→充入
的混合液→充入
C.抽真空→充入
 →注入
→注入 和
和 的混合液
的混合液(2)在上述所得溶液中滴加稍过量NaOH溶液控制pH在8.2~10.5之间,使
 转化为
转化为 沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→
沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→ 。
。(3)隔绝空气加热
 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和
和 ,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有
,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有 :
:(4)下图是硫的四种含氧酸根的结构推断具有强氧化性的是
A.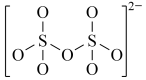 B.
B.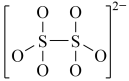 C.
C.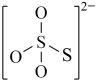 D.
D.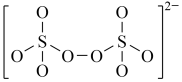
 转化为
转化为 的离子反应方程式为
的离子反应方程式为(5)
 含量的测定
含量的测定实验原理:
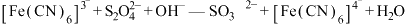 (未配平)。
(未配平)。实验过程:称取0.25g产品加入三颈烧瓶中,维持氮气氛围,加入适量NaOH溶液,再滴加0.10

 标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中
标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
6 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,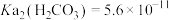 ,
,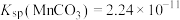
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: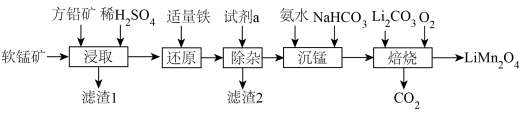
 ,
,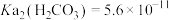 ,
,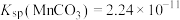
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
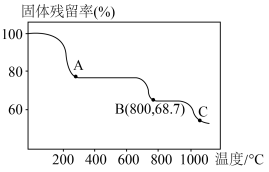
您最近一年使用:0次
2024·山西·二模
名校
7 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为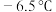 ,沸点为
,沸点为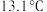 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,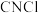 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到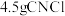 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为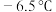 ,沸点为
,沸点为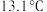 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。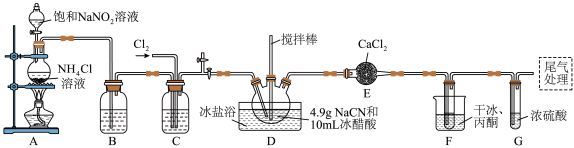
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为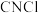 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到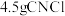 ,则产率为
,则产率为
您最近一年使用:0次
名校
解题方法
8 . 某科研团队以溴苯与catB—Br的偶联联反应构建C-B键,反应机理如图,下列说法正确的是

| A.过程中Ni的化合价未发生改变 |
| B.L-Ni-Br为中间产物 |
| C.catB·为催化剂 |
D.理论上产生1mol  消耗Zn与溴苯的物质的量之比为1∶1 消耗Zn与溴苯的物质的量之比为1∶1 |
您最近一年使用:0次
名校
9 . 锆是一种稀有金属,广泛用在航空航天、军工、核反应、原子能领域。一种以锆英砂(主要含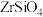 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: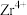 、
、 、
、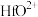 、
、 ;
;
②25℃时, ,
,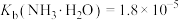 ;
;
③部分氯化物的沸点数据如表所示:
回答下列问题:
(1)“碱熔”时有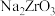 生成,则
生成,则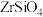 发生反应的化学方程式为
发生反应的化学方程式为______ ,温度和时间对锆英砂碱熔分解率的影响如图所示,应采取的条件为______ 。______ ,流程中可循环利用的物质除TOPO外,还有______ (填化学式)。
(3)“氨沉”时产物为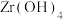 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中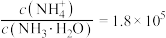 ,则
,则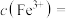
______  ,“滤液2”中主要成分是
,“滤液2”中主要成分是______ (填化学式)。
(4)“煅烧”时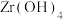 分解生成
分解生成 ,“沸腾氯化”时
,“沸腾氯化”时 发生反应的化学方程式为
发生反应的化学方程式为______ ,氯化反应结束通入 ,目的是
,目的是______ 。
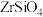 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: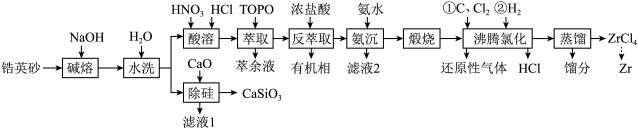
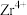 、
、 、
、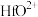 、
、 ;
;②25℃时,
 ,
,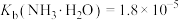 ;
;③部分氯化物的沸点数据如表所示:
物质 |
|
|
|
|
沸点/℃ | 331 | 1300 | 316 | 700 |
(1)“碱熔”时有
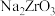 生成,则
生成,则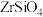 发生反应的化学方程式为
发生反应的化学方程式为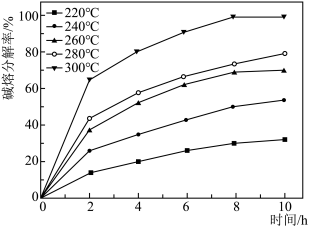
(3)“氨沉”时产物为
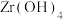 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中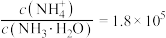 ,则
,则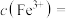
 ,“滤液2”中主要成分是
,“滤液2”中主要成分是(4)“煅烧”时
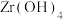 分解生成
分解生成 ,“沸腾氯化”时
,“沸腾氯化”时 发生反应的化学方程式为
发生反应的化学方程式为 ,目的是
,目的是
您最近一年使用:0次
解题方法
10 . 垃圾是放错位置的资源。从某废旧钾离子电池(主要含石墨、 、铝箔、醚类有机物等)回收部分有价金属的流程如图。
、铝箔、醚类有机物等)回收部分有价金属的流程如图。 中
中 为+3价;
为+3价;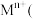 水相
水相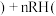 有机相
有机相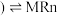 (有机相
(有机相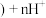 (水相
(水相 。
。
回答下列问题:
(1)为符合“双碳”战略,将“焙烧”后的气体 通入“滤液Ⅰ”至过量,除
通入“滤液Ⅰ”至过量,除 外,还可获得的副产品有
外,还可获得的副产品有______ (填化学式)。
(2)“酸溶”时主要反应的离子方程式为______ 。“酸溶”时不能用 替代双氧水,原因是
替代双氧水,原因是______ 。
(3)“萃取”过程萃取剂与溶液的体积比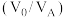 对溶液中金属元素的萃取率影响如图2所示。则
对溶液中金属元素的萃取率影响如图2所示。则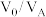 最佳取值为
最佳取值为______ ;“反萃取”时应选择的试剂为______ (填化学式)。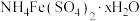 中
中 测定。方法一:称取一定质量晶体加水溶解后,加入足量
测定。方法一:称取一定质量晶体加水溶解后,加入足量 溶液并加热,产生气体全部被一定量的
溶液并加热,产生气体全部被一定量的 吸收,反应结束后,加入指示剂
吸收,反应结束后,加入指示剂______ (填“甲基橙”、“酚酸”或“石蕊”),再用 标准溶液滴定剩余
标准溶液滴定剩余 。方法二:称取一定质量晶体,加水溶解并加入过量的
。方法二:称取一定质量晶体,加水溶解并加入过量的 溶液,沉淀经过滤、水洗、醇洗、烘干、称重。若烘干不彻底,导致
溶液,沉淀经过滤、水洗、醇洗、烘干、称重。若烘干不彻底,导致 测量结果
测量结果______ (填“偏高”、“偏低”或“不影响”);方法三:采用热重分析法测定时,当样品加热到150℃时,失掉1.5个结晶水,失重 ,则
,则
______ 。
 、铝箔、醚类有机物等)回收部分有价金属的流程如图。
、铝箔、醚类有机物等)回收部分有价金属的流程如图。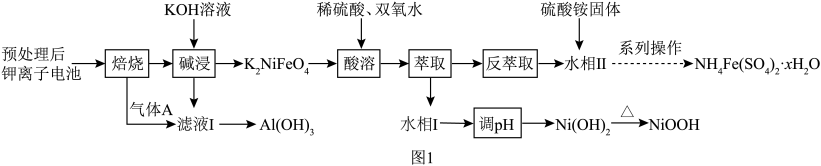
 中
中 为+3价;
为+3价;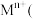 水相
水相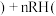 有机相
有机相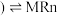 (有机相
(有机相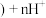 (水相
(水相 。
。回答下列问题:
(1)为符合“双碳”战略,将“焙烧”后的气体
 通入“滤液Ⅰ”至过量,除
通入“滤液Ⅰ”至过量,除 外,还可获得的副产品有
外,还可获得的副产品有(2)“酸溶”时主要反应的离子方程式为
 替代双氧水,原因是
替代双氧水,原因是(3)“萃取”过程萃取剂与溶液的体积比
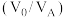 对溶液中金属元素的萃取率影响如图2所示。则
对溶液中金属元素的萃取率影响如图2所示。则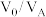 最佳取值为
最佳取值为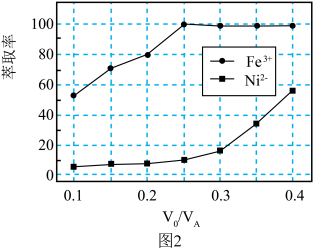
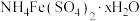 中
中 测定。方法一:称取一定质量晶体加水溶解后,加入足量
测定。方法一:称取一定质量晶体加水溶解后,加入足量 溶液并加热,产生气体全部被一定量的
溶液并加热,产生气体全部被一定量的 吸收,反应结束后,加入指示剂
吸收,反应结束后,加入指示剂 标准溶液滴定剩余
标准溶液滴定剩余 。方法二:称取一定质量晶体,加水溶解并加入过量的
。方法二:称取一定质量晶体,加水溶解并加入过量的 溶液,沉淀经过滤、水洗、醇洗、烘干、称重。若烘干不彻底,导致
溶液,沉淀经过滤、水洗、醇洗、烘干、称重。若烘干不彻底,导致 测量结果
测量结果 ,则
,则
您最近一年使用:0次