名校
解题方法
1 . 溴主要用于制造汽油抗爆剂、照相感光材料、药物、试剂和农药等。空气吹出法工艺利用制盐后的卤水提取溴。这种卤水含溴离子的浓度很低,在生产中用下列方法制取液溴。 、
、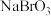
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含 的海水”中溴的质量分数
的海水”中溴的质量分数___________ (填“高”、“低”)。
(2)步骤③的操作是:___________________ ;经过该操作获得含 的空气,利用了
的空气,利用了
_________________ 的性质。
步骤⑥的蒸馏过程中,溴出口温度要控制在 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:_______________________ 。
(3)步骤④和⑤的目的是:__________________ ;步骤④用浓的 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:___________________ 。
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:___________ ,然后操作名称是:___________ 。
 、
、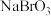
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含
 的海水”中溴的质量分数
的海水”中溴的质量分数(2)步骤③的操作是:
 的空气,利用了
的空气,利用了
步骤⑥的蒸馏过程中,溴出口温度要控制在
 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:(3)步骤④和⑤的目的是:
 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:
您最近一年使用:0次
名校
解题方法
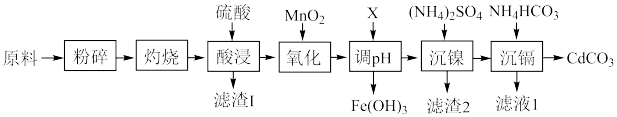
2 . 镍-镉电池是一种非常理想的直流供电电池。废旧镍-镉电池中含有镍、镉、铁及少量钴和有机质等。回收利用废旧镍-镉电池的一种工艺流程如图所示。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是_____ 。
(2)“氧化”工序发生主要反应的离子方程式为_____ 。
(3)试剂X可选择_____(填标号)。
(4)已知: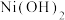 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中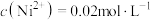 ,则应控制pH小于
,则应控制pH小于_____ 。
(5)滤渣2可表示为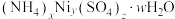 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为_____ 。
(6)滤液1经处理之后可循环至_____ 工序中使用。
(7)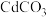 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的_____ (填“阳极”或“阴极”)产生纯镉。
(8)一项研究表明,采用溶剂萃取法可将 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为_____ 。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是
(2)“氧化”工序发生主要反应的离子方程式为
(3)试剂X可选择_____(填标号)。
| A.氨水 | B.NaOH溶液 | C.NiO | D. 溶液 溶液 |
(4)已知:
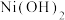 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中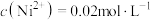 ,则应控制pH小于
,则应控制pH小于(5)滤渣2可表示为
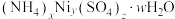 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为(6)滤液1经处理之后可循环至
(7)
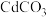 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的(8)一项研究表明,采用溶剂萃取法可将
 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为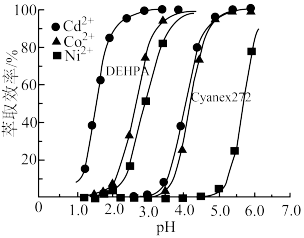
您最近一年使用:0次
2024-04-24更新
|
390次组卷
|
6卷引用:T18-工业流程题
名校
3 . 某同学为测定 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体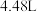 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是
 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体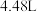 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是| A.反应后有固体剩余 | B.反应后的溶液中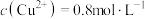 |
C. 单质在混合粉末中的质量分数约为 单质在混合粉末中的质量分数约为 | D.在反应后的溶液中加入足量铁粉,可置换出 |
您最近一年使用:0次
2024-04-11更新
|
158次组卷
|
4卷引用:山东省烟台市龙口第一中学东校2023-2024学年高二下学期6月月考化学试题
山东省烟台市龙口第一中学东校2023-2024学年高二下学期6月月考化学试题辽宁省部分高中2023-2024学年高一下学期4月月考化学试题吉林省白山市抚松县第一中学2023-2024学年高一下学期4月月考化学试题(已下线)第二章 化学计量及应用(测试)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
4 . 已知转化Ⅰ: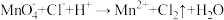 ;转化Ⅱ:
;转化Ⅱ: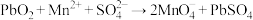 。下列说法错误的是
。下列说法错误的是
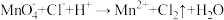 ;转化Ⅱ:
;转化Ⅱ: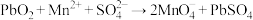 。下列说法错误的是
。下列说法错误的是A.氧化性:PbO2> >Cl2 >Cl2 |
B.转化Ⅰ、Ⅱ消耗或生成等物质的量的 ,转移电子数相同 ,转移电子数相同 |
C. 做氧化剂时,酸性越强,氧化性越强 做氧化剂时,酸性越强,氧化性越强 |
D.PbO2与FeSO4溶液反应: |
您最近一年使用:0次
2024-04-10更新
|
227次组卷
|
2卷引用:山东省青岛市2023-2024学年高一上学期期末统考化学试卷
名校
解题方法
5 . 取某铁铝铜合金9.34g,溶于足量的稀硝酸中,金属无剩余,收集到的一种气体是唯一还原产物。向溶液中加过量的氢氧化钠溶液,小心收集沉淀洗涤干净称重11.23g,加热分解至衡重,得固体质量为8.80g。则下列说法不正确的是
| A.参加反应的氢氧化钠不一定比参加反应的硝酸的物质的量多 |
| B.合金中铁铝的物质的量之比为1:2 |
| C.收集到的气体在标准状况下为4.256L |
| D.与铁铝铜合金反应的硝酸的物质的量是0.57mol |
您最近一年使用:0次
6 . 化学基本概念和研究方法要准确掌握,下列是某同学对有关物质进行分类的列表:
(1)上述三组分类中的错误物质有______ 种。
(2)砷是与磷相邻同主族元素,则其在周期表的位置是______ ;砷化氢的电子式:______ ,它是一种有剧毒恶臭的无色气体,还原性极强,能与硝酸银反应生成Ag和砒霜(As2O3),反应的离子方程式为______ 。
(3)已知: ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出______ 克I2(小数点后保留2位)。
(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是______ 。
(5)依据化学方程式,回答下列问题: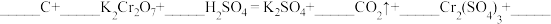
①配平完善化学方程式:_______________ 。
②H2SO4在上述反应中表现出来的性质是______ 。
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______ L。
| 组序号 | 单质 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| ① | 灰砷(α-As) | Na2CO3 | H2C2O4 | K2SO4 | Na2O2 | SO3 |
| ② | 臭氧 | Fe(OH)3胶体 | H37Cl | KAl(SO4)2 | CaO | As2O3 |
| ③ | I2 | Al(OH)3 | CH3OH | K2Cr2O7 | Al2O3 | NO2 |
(2)砷是与磷相邻同主族元素,则其在周期表的位置是
(3)已知:
 ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是
(5)依据化学方程式,回答下列问题:
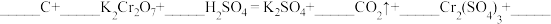
①配平完善化学方程式:
②H2SO4在上述反应中表现出来的性质是
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
名校
7 . 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下。
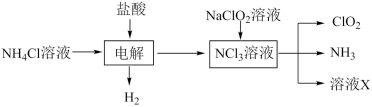
已知整个过程中氮元素的化合价没有发生变化,则下列说法错误的是

已知整个过程中氮元素的化合价没有发生变化,则下列说法错误的是
| A.电解时发生反应的氧化产物和还原产物物质的量之比为3∶1 |
| B.流程涉及到的物质中有三种离子化合物 |
| C.NaClO2(亚氯酸钠)参与的反应中氧化剂和还原剂物质的量之比是1∶6 |
| D.质量相同时,二氧化氯(ClO2)的消毒效率是Cl2的2.63倍 |
您最近一年使用:0次
8 . 无细胞化学酶系统催化CO2合成淀粉,其中开始部分核心反应转化关系如图所示。下列说法正确的是
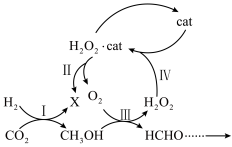

| A.该部分核心反应的反应物是H2和CO2 |
| B.整个反应中的“cat”是催化剂,而O2是中间产物 |
| C.反应Ⅰ和反应Ⅲ的电子转移数为之比一定是3∶1 |
| D.CH3OH和HCHO分子中共用电子对之比是5∶3 |
您最近一年使用:0次
名校
9 . 应用元素周期律的有关知识,可以预测元素的单质及其化合物的性质,下列预测中正确的是
①离子的氧化性: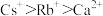 ②热稳定性:
②热稳定性: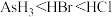
③Tl(OH)3是两性氢氧化物 ④碳酸锶(SrSO4)是难溶于水的白色固体,受热能发生分解反应
⑤Ge是一种半导体材料 ⑥氢硒酸(H2Se)还原性强,其长期露置于空气中易变质出现浑浊
①离子的氧化性:
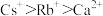 ②热稳定性:
②热稳定性: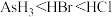
③Tl(OH)3是两性氢氧化物 ④碳酸锶(SrSO4)是难溶于水的白色固体,受热能发生分解反应
⑤Ge是一种半导体材料 ⑥氢硒酸(H2Se)还原性强,其长期露置于空气中易变质出现浑浊
| A.①②④⑤ | B.①②④⑤⑥ | C.②③④⑤ | D.②④⑤⑥ |
您最近一年使用:0次
2024-04-08更新
|
82次组卷
|
2卷引用:山东省济南市山东省实验中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
10 . 某工厂采用废弃矿渣(主要含FeO、Cr2O3)制备Cr(OH)3,涉及工艺流程如图。测知在制备过程中Cr元素化合价发生了变化,下列说法错误的是
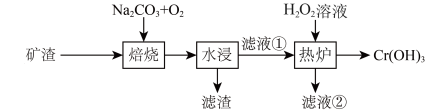
| A.该制备过程中主要涉及到三个氧化还原反应 | B.滤液①主要溶质是铬酸钠 |
| C.H2O2在热炉反应中作还原剂 | D.在焙烧和热炉两个环节电子转移数是相等的 |
您最近一年使用:0次



