解题方法
1 . 下列物质应用体现其氧化性的是
| A.甲酸可用作医疗器械的消毒剂 |
| B.山梨酸钾、山梨酸、NaNO2等常用作食品防腐剂 |
| C.浸泡过高锰酸钾溶液的硅藻土可用于水果的保鲜剂 |
| D.用H2SO4和双氧水混合液可溶解Co2O3制得CoSO4溶液 |
您最近一年使用:0次
2 . 锰是生产各种合金的重要元素。工业上以含锰矿石(主要成分为 ,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
表一
表二
回答下列问题:
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有_______ (写两种)。
(2)“氧化”步骤发生反应的离子方程式为_______ 。
(3)滤渣1的主要成分是_______ ,实验室中为了加快固液混合物的分离,常采用的操作是_______ 。
(4)有同学提出,加入(NH4)2S除钴、除镍的步骤可以放在“除杂1”之前,你是否赞同?请说明理由:_______ 。
(5)由 晶体制备CuCl2的方法是
晶体制备CuCl2的方法是_______ 。
(6)25℃时,分离出滤渣3所得的滤液中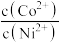 =
=_______ ,欲使沉钴后的溶液中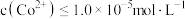 ,需要控制溶液的pH至少为
,需要控制溶液的pH至少为_______ 。(已知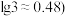
(7)电解废液中还含有少量Mn2+,向其中加入饱和N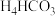 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为_______ 。
 ,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
表一
| 物质 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 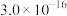 | 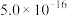 |  | 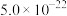 | 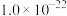 |
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有
(2)“氧化”步骤发生反应的离子方程式为
(3)滤渣1的主要成分是
(4)有同学提出,加入(NH4)2S除钴、除镍的步骤可以放在“除杂1”之前,你是否赞同?请说明理由:
(5)由
 晶体制备CuCl2的方法是
晶体制备CuCl2的方法是(6)25℃时,分离出滤渣3所得的滤液中
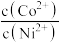 =
=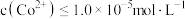 ,需要控制溶液的pH至少为
,需要控制溶液的pH至少为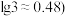
(7)电解废液中还含有少量Mn2+,向其中加入饱和N
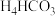 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为
您最近一年使用:0次
2024-05-07更新
|
67次组卷
|
2卷引用:山东省普通高中2024届高三下学期学业水平等级考试预测卷化学试题
名校
解题方法
3 . 氧化钇( )广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、
)广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、 ,还含有一定量的
,还含有一定量的 、
、 、MgO)等)为原料生产
、MgO)等)为原料生产 的工艺流程如图所示:
的工艺流程如图所示: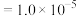 mol⋅L
mol⋅L 时,认为已沉淀完全。
时,认为已沉淀完全。
②常温下,相关金属离子开始沉淀和沉淀完全时的pH如图所示:
(1)“酸浸”时需适当提高浸取液的温度,其目的是_______ ;
采用离子浓度传感器测得相同时间内 的浸取率与浸取溶液温度的关系如图所示,
的浸取率与浸取溶液温度的关系如图所示, ℃后,
℃后, 的浸取率随温度升高而减小的原因是
的浸取率随温度升高而减小的原因是_______ 。_______ (填化学式)。
(3)“沉钇”后的滤液中浓度最大的金属离子是_______ (填离子符号);若常温下测得 恰好沉淀完全时滤液中
恰好沉淀完全时滤液中 mol⋅L
mol⋅L ,则
,则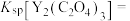
_______ mol⋅L (保留两位有效数字)。
(保留两位有效数字)。
(4)“沉钇”后所得晶体为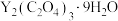 ,其中C元素的化合价为
,其中C元素的化合价为_______ 。
(5)“焙烧”时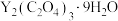 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
 )广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、
)广泛应用于微波、军工、光学玻璃、陶瓷、激光、超导等许多尖端行业。利用废荧光粉(主要成分为ZnO、 ,还含有一定量的
,还含有一定量的 、
、 、MgO)等)为原料生产
、MgO)等)为原料生产 的工艺流程如图所示:
的工艺流程如图所示: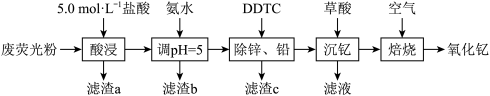
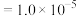 mol⋅L
mol⋅L 时,认为已沉淀完全。
时,认为已沉淀完全。②常温下,相关金属离子开始沉淀和沉淀完全时的pH如图所示:

(1)“酸浸”时需适当提高浸取液的温度,其目的是
采用离子浓度传感器测得相同时间内
 的浸取率与浸取溶液温度的关系如图所示,
的浸取率与浸取溶液温度的关系如图所示, ℃后,
℃后, 的浸取率随温度升高而减小的原因是
的浸取率随温度升高而减小的原因是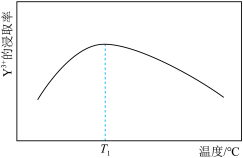
(3)“沉钇”后的滤液中浓度最大的金属离子是
 恰好沉淀完全时滤液中
恰好沉淀完全时滤液中 mol⋅L
mol⋅L ,则
,则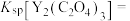
 (保留两位有效数字)。
(保留两位有效数字)。(4)“沉钇”后所得晶体为
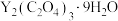 ,其中C元素的化合价为
,其中C元素的化合价为(5)“焙烧”时
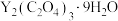 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
2024-05-07更新
|
131次组卷
|
3卷引用:T18-工业流程题
名校
解题方法
4 . 钙钛矿材料转换效率高,制作工艺简单,在太阳能电池领域有着较好的应用, 是一类钙钛矿,某实验小组利用等物质的量的
是一类钙钛矿,某实验小组利用等物质的量的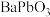 、
、 制备
制备 的工艺流程如图所示。
的工艺流程如图所示。
下列说法正确的是
 是一类钙钛矿,某实验小组利用等物质的量的
是一类钙钛矿,某实验小组利用等物质的量的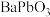 、
、 制备
制备 的工艺流程如图所示。
的工艺流程如图所示。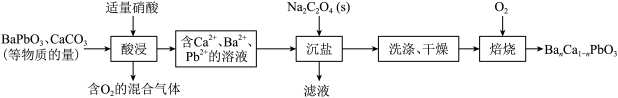
| 草酸盐 |  |  | 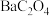 |
 | 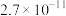 | 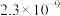 | 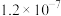 |
A.“酸浸”后的混合气体中还含有 |
B.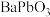 与硝酸的反应中氧化剂与氧化产物的物质的量之比为2∶1 与硝酸的反应中氧化剂与氧化产物的物质的量之比为2∶1 |
| C.“洗涤”用到的玻璃仪器有烧杯、玻璃棒、酒精灯 |
D.“沉盐”反应中,加入 时,先析出 时,先析出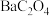 |
您最近一年使用:0次
2024-05-07更新
|
82次组卷
|
3卷引用:不定选择题11-15
名校
5 . 二氧化氯( )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是
 )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是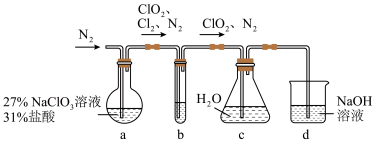
A.装置a的反应产物中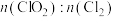 的比值一定为2:1 的比值一定为2:1 |
| B.装置b的主要作用是除去混合气体中的HCl |
C.通入氮气的目的为稀释装置a中产生的 并使其中产生的气体全部进入后续装置 并使其中产生的气体全部进入后续装置 |
D.装置d可除去多余的 |
您最近一年使用:0次
解题方法
6 . 锂离子电池正极材料(主要成分为 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: ,
, ,
, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入 溶液中,其目的是
溶液中,其目的是________ 。
(2)滤液1的主要成分是________ (填化学式,下同)。滤液2的主要成分是________ 。
(3)“酸溶”时发生的主要反应的离子方程式________ ;不用盐酸替代硫酸的原因是________ 。
(4)不宜使用 沉钴的原因是
沉钴的原因是________ 。
(5) ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
________ 。
(6)若最终得到产品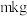 ,则可以重新制备
,则可以重新制备________  正极材料(含钴
正极材料(含钴 )。
)。
 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: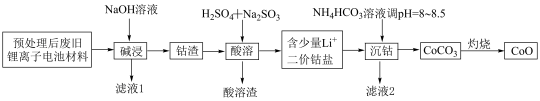
 ,
, ,
, 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入
 溶液中,其目的是
溶液中,其目的是(2)滤液1的主要成分是
(3)“酸溶”时发生的主要反应的离子方程式
(4)不宜使用
 沉钴的原因是
沉钴的原因是(5)
 ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
(6)若最终得到产品
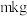 ,则可以重新制备
,则可以重新制备 正极材料(含钴
正极材料(含钴 )。
)。
您最近一年使用:0次
7 . 以废料铅膏( 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: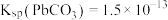 ,
,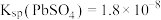 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
 、
、 、
、 、
、 等)为原料,制备超细
等)为原料,制备超细 ,实现铅循环再利用的流程如下:
,实现铅循环再利用的流程如下: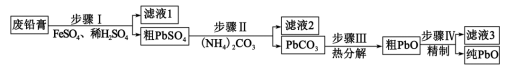
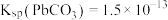 ,
,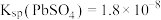 。②
。② 溶解在
溶解在 溶液中(杂质不溶于
溶液中(杂质不溶于 )的溶解度曲线如图所示:
)的溶解度曲线如图所示:
A.步骤Ⅰ发生的主要反应有 |
B.步骤Ⅱ,若滤出的 沉淀中混有 沉淀中混有 ,该滤液中 ,该滤液中 |
| C.过程中为提高产品产率,滤液3应循环使用 |
D.精制的操作是在 用碱溶解,然后趁热过滤、洗涤、干燥 用碱溶解,然后趁热过滤、洗涤、干燥 |
您最近一年使用:0次
8 . 盐酸在中学阶段用途广泛,下列关于盐酸用法错误的是
| A.硫酸根离子的检验 | B.氯化铁溶液的配制 |
| C.高锰酸钾溶液的酸化 | D.氯化镁的结晶 |
您最近一年使用:0次
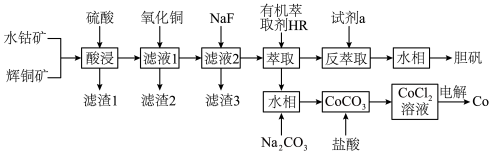
9 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
10 . 环己酮是无色油状液体, 时在水中的溶解度为
时在水中的溶解度为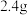 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。
【实验原理】 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
Ⅱ.在室温下继续搅拌 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。
Ⅲ.在反应混合物中加入 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。
回答下列问题。
(1)仪器X的名称为_______ 。
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是_______ 。用淀粉碘化钾试纸可检验反应后的液体,如果试纸变_______ 色,说明次氯酸钠过量。
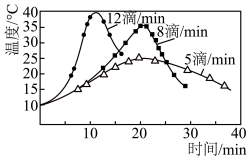
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为_______ 滴/ 。
。_______ 。
(5)在步骤Ⅳ中,加入精制食盐的目的是_______ 。
(6)在步骤Ⅴ中,加入无水 的作用为
的作用为_______ 。
(7)产品的产率为_______ (精确至0.1%)。
 时在水中的溶解度为
时在水中的溶解度为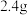 。实验室由环己醇制备环己酮。
。实验室由环己醇制备环己酮。【实验原理】
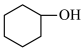 +NaClO
+NaClO
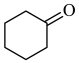 +NaCl+H2O
+NaCl+H2O 
【装置示意图】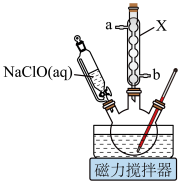
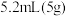 环已醇和
环已醇和 冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。
冰醋酸,开动磁力搅拌器。在冰水浴冷却下,逐滴加入次氯酸钠溶液至稍过量。Ⅱ.在室温下继续搅拌
 ,然后加入饱和亚硫酸氢钠溶液。
,然后加入饱和亚硫酸氢钠溶液。Ⅲ.在反应混合物中加入
 水、
水、 氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。
氯化铝,去掉仪器X,换成蒸馏装置,加热蒸馏,至馏出液无油珠滴出为止。Ⅳ.在搅拌情况下向馏出液中加入无水碳酸钠至中性,然后再加入精制食盐使之饱和,将此液体倒入分液漏斗,分出有机层。
Ⅴ.向有机层中加入无水
 ,静置,过滤,对滤液进行蒸馏,得到产品
,静置,过滤,对滤液进行蒸馏,得到产品 。
。回答下列问题。
(1)仪器X的名称为
(2)步骤Ⅰ中,加入冰醋酸除作为溶剂外,还有的作用是
(3)步骤Ⅰ中,次氯酸钠溶液要在冰水浴冷却下逐滴加入,勿使氧化反应进行得过于猛烈而升温过高,否则产物环己酮将进一步被氧化而发生碳链断裂。在次氯酸钠的不同滴加速度下,在冰水浴存在的情况下,溶液温度随滴加时间变化曲线如图,为了控制好反应温度,应选择的滴速为
 。
。
(5)在步骤Ⅳ中,加入精制食盐的目的是
(6)在步骤Ⅴ中,加入无水
 的作用为
的作用为(7)产品的产率为
您最近一年使用:0次



