名校
1 .  是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。
Ⅰ.制备
(1)操作步骤的先后顺序为___________ 。
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为___________ ,装置B中盛放的试剂为___________ (填试剂名称)。
(3)为使装置C受热均匀,可采取的加热方式为___________ ,装置D的作用为___________ 。
Ⅱ.制备
打开止水夹 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
(4)生成 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为___________ 。
Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。
(5)制得 的纯度为
的纯度为___________ 。下列实验操作导致 测定结果偏低的是
测定结果偏低的是___________ 。
A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
 是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。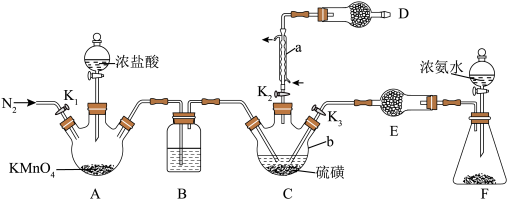
Ⅰ.制备

(1)操作步骤的先后顺序为
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入
 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开
 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为
(3)为使装置C受热均匀,可采取的加热方式为
Ⅱ.制备

打开止水夹
 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。(4)生成
 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为
 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。(5)制得
 的纯度为
的纯度为 测定结果偏低的是
测定结果偏低的是A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
您最近一年使用:0次
2024-03-14更新
|
941次组卷
|
5卷引用:山东省烟台市2024届高三一模化学试题
名校
2 .  是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、NiO及少量
、NiO及少量 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下: 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物
Ⅱ.0.1
 溶液的pH=1.0
溶液的pH=1.0
Ⅲ.
回答下列问题:
(1)滤渣的主要成分是___________ ;酸化时, 完全转化为
完全转化为 的最大pH为
的最大pH为___________ 。(已知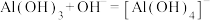
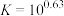 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)
(2)“酸化”后的溶液中存在 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为___________ 。
(3)反萃取剂应选用___________ (填“酸性”、“中性”或“碱性”)溶液;若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为___________ 。
(4)生成 的化学方程式为
的化学方程式为___________ ,实验测得溶液pH、温度和 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下: 晶体的最佳条件是
晶体的最佳条件是___________ ;制备过程中需加入NaOH维持最佳pH,若 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是___________ 。
 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、NiO及少量
、NiO及少量 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下: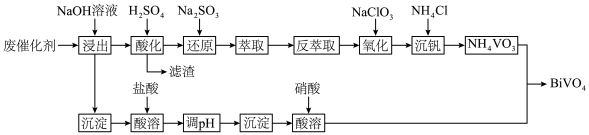
 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物Ⅱ.0.1

 溶液的pH=1.0
溶液的pH=1.0Ⅲ.
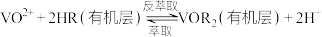
回答下列问题:
(1)滤渣的主要成分是
 完全转化为
完全转化为 的最大pH为
的最大pH为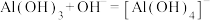
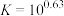 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)(2)“酸化”后的溶液中存在
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(3)反萃取剂应选用
 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为(4)生成
 的化学方程式为
的化学方程式为 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下: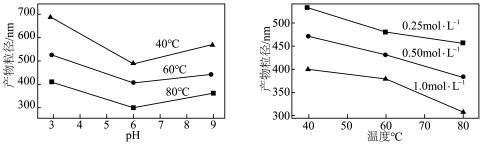
 晶体的最佳条件是
晶体的最佳条件是 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是
您最近一年使用:0次
2024-03-14更新
|
1376次组卷
|
7卷引用:山东省烟台市2024届高三一模化学试题
山东省烟台市2024届高三一模化学试题2024届山东省高三下学期第一次练兵考试一模化学试题山东省德州市2023-2024学年高三下学期一模考试化学试题(已下线)化学(山东卷01)-2024年高考押题预测卷河北省石家庄市第二中学2023-2024学年高三下3月T8联考化学试题(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)2024届福建省福州延安中学高三下学期高考第二次模拟化学试题
解题方法
3 . 草酸亚铁晶体(FeC2O4·2H2O)是实验室常用的分析试剂,可通过硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,易氧化]与草酸反应制得。制备并测定其组成设计实验如下。
Ⅰ.硫酸铵和硫酸亚铁混合结晶制备硫酸亚铁铵。
(1)操作(ⅰ)为______ 。
(2)操作(ⅳ)产生H2,赶出装置内的空气的目的为______ a、b止水夹“操作2”为______
(3)仪器甲的名称为______ 。该装置中存在一处缺陷为______
(4)写出装置C中发生反应的化学方程式____________ 。
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体
粗品。该草酸亚铁晶体(FeC2O4·2H2O)粗品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4溶液滴定法测定该粗品的组成,实验过程如图。已知草酸为弱酸,可被KMnO4溶液氧化为CO2,回答下列问题。____________ 。
(6)样品中所含H2C2O4·2H2O(摩尔质量为M g/mol)的质量分数表达式为____________ 。
Ⅰ.硫酸铵和硫酸亚铁混合结晶制备硫酸亚铁铵。
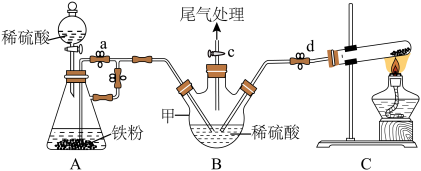
(1)操作(ⅰ)为
(2)操作(ⅳ)产生H2,赶出装置内的空气的目的为
(3)仪器甲的名称为
(4)写出装置C中发生反应的化学方程式
Ⅱ.制备草酸亚铁晶体并测定其组成。
将制得的硫酸亚铁铵与草酸一定条件下混合加热,经沉淀,抽滤、洗涤获得草酸亚铁晶体
粗品。该草酸亚铁晶体(FeC2O4·2H2O)粗品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4溶液滴定法测定该粗品的组成,实验过程如图。已知草酸为弱酸,可被KMnO4溶液氧化为CO2,回答下列问题。

(6)样品中所含H2C2O4·2H2O(摩尔质量为M g/mol)的质量分数表达式为
您最近一年使用:0次
名校
解题方法
4 . 中药自然铜具有散瘀止痛、续筋接骨之功效,其炮制方法始见于南北朝《雷公炮炙论》:取净自然铜(含FeS2的矿石)置于敞口耐火容器中,大火煅制红透,立即取出投入米醋淬火,反复煅淬数次至褐色,干燥后碾碎装存。下列说法正确的是
| A.古代煅制自然铜应在通风环境中进行 |
B.煅制过程中1 mol FeS2被完全氧化,转移电子的数目约为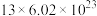 |
C.自然铜淬火过程中发生反应的离子方程式为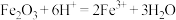 |
| D.含自然铜成分的中成药大七厘散(处方药),其包装上有“OTC”标识 |
您最近一年使用:0次
2024-03-05更新
|
988次组卷
|
5卷引用:2024届山东省泰安肥城市高考仿真模拟(二)化学试题
2024届山东省泰安肥城市高考仿真模拟(二)化学试题2024届辽宁省名校联盟(东北三省联考)高三下学期模拟预测化学试题(已下线)选择题6-10(已下线)化学(辽宁卷01)-2024年高考押题预测卷湖南省长沙市一中2024届高三下学期模拟试卷(二)化学试题
名校
解题方法
5 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: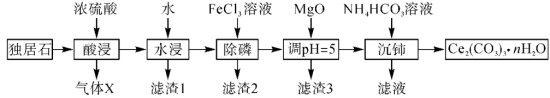
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
152次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
6 .  具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: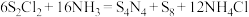 [已知
[已知 (分子结构为
(分子结构为 是硫单质中最稳定的]。下列说法错误的是
是硫单质中最稳定的]。下列说法错误的是

A. 属于分子晶体, 属于分子晶体,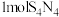 中含有 中含有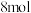 极性键 极性键 |
B.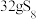 中含有 中含有 非极性键 非极性键 |
C.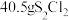 参与上述制备反应,转移 参与上述制备反应,转移 电子 电子 |
D. 的VSEPR模型均为四面体形 的VSEPR模型均为四面体形 |
您最近一年使用:0次
2024-03-03更新
|
387次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
7 . 二氧化铅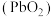 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
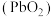 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是A.X是 ,Y是 ,Y是 |
B.还原产物与氧化产物的物质的量之比为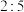 |
C.当生成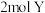 时,转移 时,转移 电子 电子 |
D.根据上述反应推测 不能氧化 不能氧化 |
您最近一年使用:0次
2024-02-27更新
|
227次组卷
|
3卷引用:山东省济宁市育才中学2023-2024学年高一下学期开学化学试题
8 . 甲钴胺是神经元营养药物,由C、H、Co、N、O、P元素组成。下列说法正确的是
A.还原性: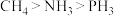 |
| B.基态P原子的最高能级轨道形状为球形 |
| C.同周期中第一电离能小于N的元素有5种 |
D.基态Co原子价层电子轨道表示式为 |
您最近一年使用:0次
2024-02-24更新
|
165次组卷
|
2卷引用:山东省淄博市2023-2024学年高二上学期教学质量检测化学试题
9 . 工业上以富钒炉渣(主要含FeO·V2O3、V2O5和少量的SiO2、Al2O3等)为原料制备V2O5的工艺流程如下:
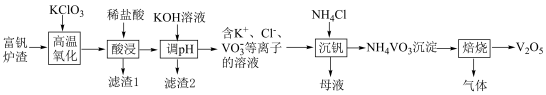
已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
②Ksp[Fe(OH)3]=2.6×10–39;Ksp[Al(OH)3]=1.0×10–33;Ksp(NH4VO3)=1.6×10–3
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是___________ ;“高温氧化”过程中发生主要反应的化学方程式为___________ 。
(2)滤渣1的主要成分为___________ ;“调pH”时需将Fe3+、Al3+除尽(浓度≤1×10–5 mol∙L–1时,可认为已除尽),需调节pH的范围为___________ 。
(3)若“沉钒”前溶液中c(VO )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为___________ mol·L–1。过滤、洗涤、干燥得到NH4VO3沉淀,检验NH4VO3沉淀是否洗净的操作是___________ 。
(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为___________ 。

已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
| 溶液pH | <1.0 | 1.0~4.0 | 4.0~6.0 | 6.0~8.5 | 8.5~13.0 | >13.0 |
| 钒元素存在形式 | VO | V2O5 | 多矾酸根 | VO | 多矾酸根 | VO |
| 备注 | 多矾酸盐在水中溶解度较小 | |||||
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是
(2)滤渣1的主要成分为
(3)若“沉钒”前溶液中c(VO
 )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 我国科学家研究发现稀土铈基催化剂可低温脱硝,其反应历程如图所示(“□”代表空位)。下列说法正确的是

| A.历程中Ce、Ti形成的共价键数目未发生变化 |
| B.每形成2 mol氢氧键,形成1 mol“空位” |
| C.上述历程中每生成1 molN2,转移6 mole– |
| D.总反应中氧化产物与还原产物物质的量之比为1∶2 |
您最近一年使用:0次



