名校
1 . 氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。已知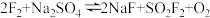 ,针对该反应的下列有关说法正确的有
,针对该反应的下列有关说法正确的有
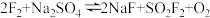 ,针对该反应的下列有关说法正确的有
,针对该反应的下列有关说法正确的有A. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B. 的氧化性强于 的氧化性强于 |
| C.生成42gNaF时,该反应转移1mol电子 |
| D.反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成 |
您最近一年使用:0次
2021-07-13更新
|
363次组卷
|
4卷引用:山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题
解题方法
2 . 硫元素的价类二维图如图所示。
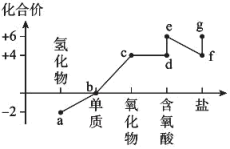
下列说法正确的是

下列说法正确的是
A.a在水溶液中的电离方程式为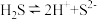 |
| B.b只有一种分子,不存在同素异形体 |
| C.d、e均属于二元强酸 |
| D.a与c、d、e都有可能反应生成b |
您最近一年使用:0次
2021-07-13更新
|
411次组卷
|
2卷引用:山东省青岛胶州市2020-2021学年高一下学期期末考试化学试题
3 . 次磷酸钠(NaH2PO2)常用作药物和化学镀镍中的还原剂,是一种正盐,可通过如下反应P4+3NaOH(浓)+3H2O 3NaH2PO2+PH3↑制得。下列相关说法正确的是
3NaH2PO2+PH3↑制得。下列相关说法正确的是
 3NaH2PO2+PH3↑制得。下列相关说法正确的是
3NaH2PO2+PH3↑制得。下列相关说法正确的是| A.氧化产物为PH3,其中P的化合价为−3 |
| B.反应中氧化剂与还原剂物质的量比为1:3 |
| C.反应中每消耗1mol P4共转移6mol电子 |
| D.次磷酸化学式为H3PO2,属于三元酸 |
您最近一年使用:0次
2021-07-13更新
|
453次组卷
|
3卷引用:山东省青岛胶州市2020-2021学年高一下学期期末考试化学试题
4 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图装置来制取。写出制取氯气的化学方程式_______ ;a的作用是_______ 。

(2)实验室通过测定不同浓度NaClO溶液在不同pH下的细菌杀灭率(%),以探究“84”消毒液杀菌能力的影响因素,实验结果如表。
①结合表中数据可推断,相同条件下,HClO的杀菌消毒能力_______ (填“强于”、“弱于”或“相当于”)NaClO的杀菌消毒能力。
②下列关于“84消毒液”使用方法的描述中,正确的是_______ (填字母序号)。
a.与双氧水消毒液混合使用会增强杀菌消毒能力
b.其杀菌消毒能力与其浓度无关
c.不能与洁厕灵混合使用,可能会导致安全事故
d.喷洒在物品表面后适当保持一段时间,以达到杀菌消毒效果
(3)ClO2和NaClO2均为重要的杀菌消毒剂。已知NaClO2易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
①将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2溶液。所得溶液在减压和55 ℃条件下蒸发至大量晶体析出后,_______ ,_______ ,低于60℃干燥,得到干燥的NaClO2 (补全实验步骤)。
②一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,得到ClO2和NaCl,理论上每消耗1molNaClO2生成ClO2的量为_______ mol。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图装置来制取。写出制取氯气的化学方程式

(2)实验室通过测定不同浓度NaClO溶液在不同pH下的细菌杀灭率(%),以探究“84”消毒液杀菌能力的影响因素,实验结果如表。
| NaClO溶液浓度 (mg·L-1) | 不同pH下的细菌杀灭率(%) | ||
| pH=4.5 | pH=7.0 | pH=9.5 | |
| 250 | 98.90 | 77.90 | 53.90 |
| 500 | 99.99 | 97.90 | 65.54 |
②下列关于“84消毒液”使用方法的描述中,正确的是
a.与双氧水消毒液混合使用会增强杀菌消毒能力
b.其杀菌消毒能力与其浓度无关
c.不能与洁厕灵混合使用,可能会导致安全事故
d.喷洒在物品表面后适当保持一段时间,以达到杀菌消毒效果
(3)ClO2和NaClO2均为重要的杀菌消毒剂。已知NaClO2易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
①将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2溶液。所得溶液在减压和55 ℃条件下蒸发至大量晶体析出后,
②一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,得到ClO2和NaCl,理论上每消耗1molNaClO2生成ClO2的量为
您最近一年使用:0次
名校
解题方法
5 . ZnO是电镀、涂料、有机合成等化学工业的重要原料。工业上由含锌废料(主要成分为ZnO,还含有FeO、MgO、CuO、SiO2)为原料生产ZnO的工艺流程如图:
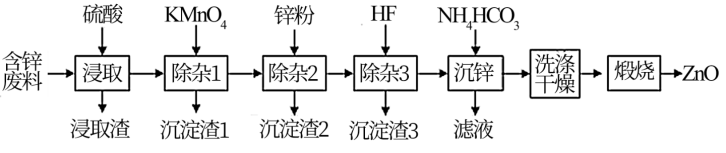
已知:沉淀渣1的成分为Fe(OH)3、MnO2
(1)浸取渣的主要成分是_______ (填化学式)。
(2)“除杂1”过程需要调节pH至5.2,最好选用_______ (填字母);生成沉淀渣1的离子方程式为_______ 。
A.Na2CO3 B.NH3·H2O C.ZnO D.H2SO4
(3)沉淀渣2的主要成分是_______ (填化学式);“除杂3”的目的是_______ 。
(4)“沉锌”得到的是Zn2(OH)2CO3,“洗涤干燥”步骤中检验沉淀是否洗涤干净的方法是_______ 。若煅烧过程中固体质量减少了18.6kg,则理论上生成_______ kgZnO。

已知:沉淀渣1的成分为Fe(OH)3、MnO2
(1)浸取渣的主要成分是
(2)“除杂1”过程需要调节pH至5.2,最好选用
A.Na2CO3 B.NH3·H2O C.ZnO D.H2SO4
(3)沉淀渣2的主要成分是
(4)“沉锌”得到的是Zn2(OH)2CO3,“洗涤干燥”步骤中检验沉淀是否洗涤干净的方法是
您最近一年使用:0次
2021-07-12更新
|
246次组卷
|
3卷引用:山东省烟台市2020-2021学年高二下学期期末考试化学试题
解题方法
6 . 实验室由MnO2制取KMnO4的流程如图:
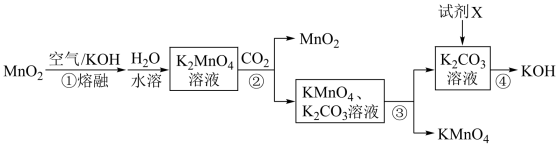
下列说法错误的是

下列说法错误的是
| A.步骤①发生反应2MnO2+O2+4KOH=2K2MnO4+2H2O |
| B.步骤②用到的玻璃仪器有烧杯、漏斗和玻璃棒 |
| C.试剂X可为石灰乳 |
| D.上述流程中只有MnO2可循环利用 |
您最近一年使用:0次
解题方法
7 . 某同学为验证同主族元素原子得电子能力强弱进行如下实验:
Ⅰ.向 溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
Ⅱ.向 溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
Ⅲ.在淀粉碘化钾试纸上滴加几滴溴水。
回答下列问题:
(1)实验Ⅰ的现象_______ 。
(2)根据Ⅰ、Ⅱ、Ⅲ的实验现象可得实验结论为_______ ,请用原子结构的知识解释其原因:_______ 。
(3)实验Ⅰ、Ⅱ得到的 层中含有卤素单质,可用
层中含有卤素单质,可用 浓溶液反萃取分离回收。以下是反萃取回收
浓溶液反萃取分离回收。以下是反萃取回收 的操作过程:
的操作过程:
①向装有 的
的 溶液的
溶液的_______ (填仪器名称)中加入少量浓 溶液;
溶液;
②振荡至溶液的_______ 色消失,振荡过程中仪器内压强会增大,需要打开_______ (填“上口玻璃塞”或“下口活塞”)放气;
③静置、分层,先将 层从仪器的下口放出,再将含碘的碱溶液从仪器的
层从仪器的下口放出,再将含碘的碱溶液从仪器的_______ (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴45%的 溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式
溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式_______ 。
Ⅰ.向
 溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;Ⅱ.向
 溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;
溶液中滴加少量氯水,充分反应后,加1mL四氯化碳振荡,静置;Ⅲ.在淀粉碘化钾试纸上滴加几滴溴水。
回答下列问题:
(1)实验Ⅰ的现象
(2)根据Ⅰ、Ⅱ、Ⅲ的实验现象可得实验结论为
(3)实验Ⅰ、Ⅱ得到的
 层中含有卤素单质,可用
层中含有卤素单质,可用 浓溶液反萃取分离回收。以下是反萃取回收
浓溶液反萃取分离回收。以下是反萃取回收 的操作过程:
的操作过程:①向装有
 的
的 溶液的
溶液的 溶液;
溶液;②振荡至溶液的
③静置、分层,先将
 层从仪器的下口放出,再将含碘的碱溶液从仪器的
层从仪器的下口放出,再将含碘的碱溶液从仪器的④边搅拌边加入几滴45%的
 溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式
溶液,溶液立即转为棕黄色,并析出碘晶体,写出该反应的离子方程式
您最近一年使用:0次
8 . 工业上常用氧化剂NaClO处理NaCN超标的电镀废水。现用1mol·L-1NaClO 溶液处理1m3NaCN超标的电镀废水,测得溶液中生成的n(OCN-)与n(N2)随 NaClO 溶液加入量的变化关系如图所示∶

已知∶ HCN、HOCN 中 N 元素的化合价相同。
下列说法错误的是

已知∶ HCN、HOCN 中 N 元素的化合价相同。
下列说法错误的是
| A.NaOCN 中 C 元素为 +4 价 |
| B.曲线Ⅰ表示溶液中 OCN-的物质的量变化 |
| C.当向溶液中加入 350 mL NaClO 溶液时生成1.68 LN2(标准状况) |
| D.该电镀废水中 NaCN 的含量为9.8 mg·L-1 |
您最近一年使用:0次
名校
解题方法
9 . 实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体( ),流程如下:
),流程如下:

下列说法正确的是
 ),流程如下:
),流程如下:
下列说法正确的是
| A.上述流程中涉及的反应均属于氧化还原反应 |
B.“酸溶”时试剂 可用稀硫酸或稀盐酸 可用稀硫酸或稀盐酸 |
C.“还原”时发生反应的离子方程式为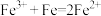 |
| D.“结晶”采用的方式是蒸发浓缩、冷却结晶 |
您最近一年使用:0次
2021-06-30更新
|
1153次组卷
|
8卷引用:山东省济南市第一中学2021-2022学年高一5月月考化学试题
10 . 实验室中利用固体KMnO4进行如图实验,下列说法错误的是
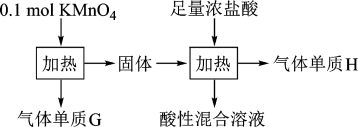

| A.G与H均为氧化产物 | B.实验中KMnO4只作氧化剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H的物质的量之和可能为0.25mol |
您最近一年使用:0次
2021-06-29更新
|
8448次组卷
|
20卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)专题04 氧化还原反应-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省枣庄市第三中学2022届高三第一次月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题2021年山东高考化学试题变式题11-20山东省新泰市第一中学2022—2023学年高一上学期期中考试化学试题(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)河北省邯郸市大名县第一中学2021-2022学年高二下学期期末考试化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲市第二中学2023届高三上学期第二次月考化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 氧化还原反应基本概念的判断(已下线)第4讲 氧化还原反应的基本概念与规律(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)



