解题方法
1 . 截至2021年8月31日,长征系列运载火箭已进行386次发射,有望在今年完成第400次发射.火箭中的燃料燃烧时火焰温度可达到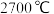 ,已知:
,已知: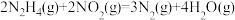
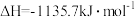 。下列叙述错误的是
。下列叙述错误的是
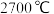 ,已知:
,已知: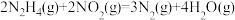
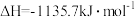 。下列叙述错误的是
。下列叙述错误的是A.若反应生成 ,则转移 ,则转移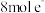 |
| B.氮气既是氧化产物又是还原产物 |
C. 作氧化剂 作氧化剂 |
D.若反应消耗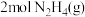 ,则放出的热量为 ,则放出的热量为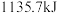 |
您最近一年使用:0次
名校
解题方法
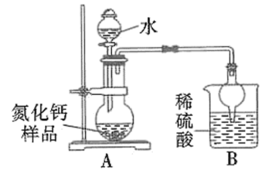
2 . 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是_______ 。
(2)装置A中每生成标准状况下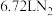 ,转移的电子数为
,转移的电子数为_______ 。
(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为_______ 。
(4)设计实验证明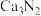 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:_______ 。
II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。
①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是
(2)装置A中每生成标准状况下
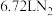 ,转移的电子数为
,转移的电子数为(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为
(4)设计实验证明
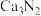 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。

①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
2021-09-16更新
|
255次组卷
|
3卷引用:云南省云南师范大学第二附属中学2022届高三8月理综试卷化学试题
解题方法
3 . 以红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2等)为原料制备Ni(OH)2的工艺流程如图:
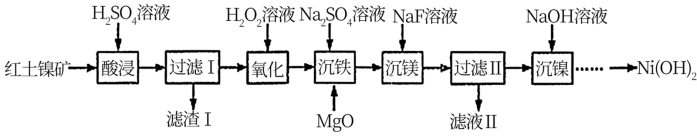
(1)“酸浸”时,加快化学反应速率的措施___ (写一条即可)。滤渣1的成分为___ (填化学式)。
(2)“氧化”时,Fe2+发生反应的离子方程式为___ ,若用NaClO代替H2O2溶液,使0.1molFe2+转化为Fe3+,则需NaClO至少为___ mol。
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是___ 。
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___ 。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是___ 。室温时,若“沉镍”后的滤液c(Ni2+)<1×10-5mol•L-1,则滤液中pH>___ 。(Ksp[Ni(OH)2=1×10-15)

(1)“酸浸”时,加快化学反应速率的措施
(2)“氧化”时,Fe2+发生反应的离子方程式为
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是
| 金属离子 | Fe2+ | Fe3+ | Mg2+ | Ni2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 8.9 | 6.9 |
| 沉淀完全的pH | 8.3 | 2.8 | 10.9 | 8.9 |
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是
您最近一年使用:0次
名校
解题方法
4 . 向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应后,过滤,得到滤渣 A 和滤液。将滤渣 A 加入少量稀硫酸中,有气泡产生。以下对滤渣 A 的组成成分判断的五种情况,其中合理的有
①Cu ②Fe、Cu ③Zn、Fe ④Zn、Cu ⑤Zn、Fe、Cu
①Cu ②Fe、Cu ③Zn、Fe ④Zn、Cu ⑤Zn、Fe、Cu
| A.②⑤ | B.②③ | C.②③④⑤ | D.①②⑤ |
您最近一年使用:0次
解题方法
5 . Ag是高新技术产业的基础材料之一,依据下列回收Ag的方案回答下列问题:
(1)利用废旧电池中的 可将有毒气体甲醛(HCHO)氧化成
可将有毒气体甲醛(HCHO)氧化成 ,将上述反应设计成原电池,在
,将上述反应设计成原电池,在___________ (填“正”或“负”)极可获得Ag。
(2)以含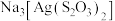 的废定影液为原料提取银的主要步骤为:加入过量
的废定影液为原料提取银的主要步骤为:加入过量 溶液后,过滤、洗涤、干燥。将获得的
溶液后,过滤、洗涤、干燥。将获得的 在足量空气中充分焙烧制得Ag。实验室焙烧
在足量空气中充分焙烧制得Ag。实验室焙烧 在
在___________ (填仪器名称)中完成,焙烧 的化学方程式是
的化学方程式是___________ ,常温下, 饱和溶液中
饱和溶液中 的浓度为a mol/L,则常温下
的浓度为a mol/L,则常温下 的溶度积常数
的溶度积常数 为
为___________ 。
(3)从光盘金属层中提取Ag(其他微量金属忽略不计)的流程如下图所示:
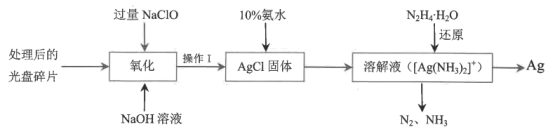
①“氧化”阶段需在80℃条件下进行,最适合的加热方式为___________ ,操作Ⅰ的名称为___________ 。
②“还原”过程 的氧化产物为
的氧化产物为 ,理论上消耗1mol
,理论上消耗1mol 可生成单质Ag的质量为
可生成单质Ag的质量为___________ 克。
③NaClO溶液与Ag反应有 生成,该反应的离子方程式为
生成,该反应的离子方程式为___________ 。
(1)利用废旧电池中的
 可将有毒气体甲醛(HCHO)氧化成
可将有毒气体甲醛(HCHO)氧化成 ,将上述反应设计成原电池,在
,将上述反应设计成原电池,在(2)以含
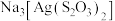 的废定影液为原料提取银的主要步骤为:加入过量
的废定影液为原料提取银的主要步骤为:加入过量 溶液后,过滤、洗涤、干燥。将获得的
溶液后,过滤、洗涤、干燥。将获得的 在足量空气中充分焙烧制得Ag。实验室焙烧
在足量空气中充分焙烧制得Ag。实验室焙烧 在
在 的化学方程式是
的化学方程式是 饱和溶液中
饱和溶液中 的浓度为a mol/L,则常温下
的浓度为a mol/L,则常温下 的溶度积常数
的溶度积常数 为
为(3)从光盘金属层中提取Ag(其他微量金属忽略不计)的流程如下图所示:

①“氧化”阶段需在80℃条件下进行,最适合的加热方式为
②“还原”过程
 的氧化产物为
的氧化产物为 ,理论上消耗1mol
,理论上消耗1mol 可生成单质Ag的质量为
可生成单质Ag的质量为③NaClO溶液与Ag反应有
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
6 . 合理利用钢厂废渣,变废为宝,对保护环境具有重要意义。以某钢厂废渣(主要成分为Fe2O3、SiO2,还含有少量的CuO、MnO2等)为原料制备铁黄[FeO(OH)]的工艺流程如下:

已知:“氨浸”工序中加入氨水的目的是将CuO转化为[Cu(NH3)4]CO3。
请回答下列问题:
(1)“氨浸”工序之前,将废渣粉碎的目的___________ ,“氨浸”时将CuO转化为[Cu(NH3)4]2+反应的离子方程式为___________ 。
(2)“滤渣2”的主要成分为___________ (填化学式)。
(3)“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应为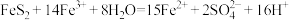 ,则该反应中,每生成1 mol
,则该反应中,每生成1 mol ,转移
,转移___________ mol电子。
(4)“操作X”具体包括___________ 、___________ 、过滤、洗涤。
(5)“蒸氨沉铜”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,相应反应的化学方程式为___________ ,气体X可返回___________ 工序循环使用。
(6)工业上通常利用电渗析法处理“滤液3”,图中A为阴离子交换膜,D为质子交换膜。

电渗析后,回收室I的产品是___________ (填化学式);阳极的电极反应式为___________ 。

已知:“氨浸”工序中加入氨水的目的是将CuO转化为[Cu(NH3)4]CO3。
请回答下列问题:
(1)“氨浸”工序之前,将废渣粉碎的目的
(2)“滤渣2”的主要成分为
(3)“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应为
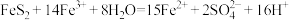 ,则该反应中,每生成1 mol
,则该反应中,每生成1 mol ,转移
,转移(4)“操作X”具体包括
(5)“蒸氨沉铜”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,相应反应的化学方程式为
(6)工业上通常利用电渗析法处理“滤液3”,图中A为阴离子交换膜,D为质子交换膜。

电渗析后,回收室I的产品是
您最近一年使用:0次
7 . 关于物质及能量的变化,下列说法正确的是
A.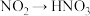 的变化需要加入氧化剂才能实现 的变化需要加入氧化剂才能实现 |
B.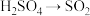 的变化只能加入还原剂才能实现 的变化只能加入还原剂才能实现 |
C.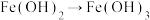 的变化能通过化合反应实现 的变化能通过化合反应实现 |
D.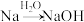 的变化过程中会吸收大量的热 的变化过程中会吸收大量的热 |
您最近一年使用:0次
2021-07-04更新
|
175次组卷
|
2卷引用:云南省昆明市四川师范大学附属昆明实验学校(安宁校区)2020-2021学年高一上学期期末考试化学试题
名校
8 . 铑(Rh)是在1803年由WllamWllston发现的一种铂系金属,铑及其合金、配合物可用于制醛类和醋酸的催化剂等。下图是一种从废铑催化剂(含铑、有机杂质和少量Cu)中回收铑的工艺流程:

已知:①铑的氧化物性质稳定且极难溶解;
②氢氧化铑是一种两性氢氧化物,Ksp[Rh(OH)3]=1×10-23
(1)焚烧的目的是_______ 和将Cu转化为CuO。
(2)实验室探究焚烧温度对铑回收率的影响,结果如图,当焚烧温度高于320℃时,铑的回收率降低的可能原因是_______ 。

(3)“加热至熔融”步骤的主要目的是将焚烧后的铑单质转化成可溶性的Rh2(SO4)3,该反应中氧化剂和还原剂的物质的量之比为3:2,则该反应还原产物为_______ 。
(4)用氨水沉淀铑元素的离子方程式为_______ ;此步骤中,pH不能太高(实际调节pH在8左右)的原因是_______ 。
(5)电解还原时,析出铑的电极与外电源的_______ (填“正”或“负”)极相连接。
(6)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。

下列叙述正确的是_______ (填序号)。
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO CH3CO2H
CH3CO2H
C.反应过程中Rh的成键数目保持不变

已知:①铑的氧化物性质稳定且极难溶解;
②氢氧化铑是一种两性氢氧化物,Ksp[Rh(OH)3]=1×10-23
(1)焚烧的目的是
(2)实验室探究焚烧温度对铑回收率的影响,结果如图,当焚烧温度高于320℃时,铑的回收率降低的可能原因是

(3)“加热至熔融”步骤的主要目的是将焚烧后的铑单质转化成可溶性的Rh2(SO4)3,该反应中氧化剂和还原剂的物质的量之比为3:2,则该反应还原产物为
(4)用氨水沉淀铑元素的离子方程式为
(5)电解还原时,析出铑的电极与外电源的
(6)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。

下列叙述正确的是
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO
 CH3CO2H
CH3CO2HC.反应过程中Rh的成键数目保持不变
您最近一年使用:0次
真题
解题方法
9 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
的一种制备方法如下图所示: 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为_______ ,生成的沉淀与硝酸反应,生成_______ 后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为_______ ;若反应物用量比 时,氧化产物为
时,氧化产物为_______ ;当 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是_______ 。
(2)以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为_______ 。
(3) 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成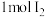 ,消耗的
,消耗的 至少为
至少为_______  。
。 在
在 溶液中可发生反应
溶液中可发生反应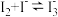 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是_______ 。
(1)
 的一种制备方法如下图所示:
的一种制备方法如下图所示: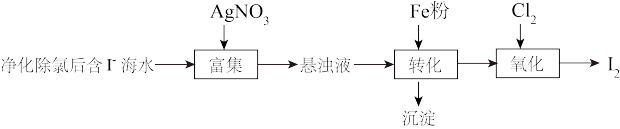
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为②通入
 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是(2)以
 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为(3)
 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成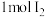 ,消耗的
,消耗的 至少为
至少为 。
。 在
在 溶液中可发生反应
溶液中可发生反应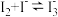 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是
您最近一年使用:0次
2021-06-11更新
|
20341次组卷
|
28卷引用:云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
云南省大理州实验中学2021-2022学年高二上学期化学期末考试题2021年高考全国甲卷化学真题(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(二)陌生化学方程式书写(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题天津市第一零二中学2022届高三上学期第一次月考化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)微专题 陌生情景中反应方程式的书写(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第2讲 卤素及海水提溴、提碘(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷
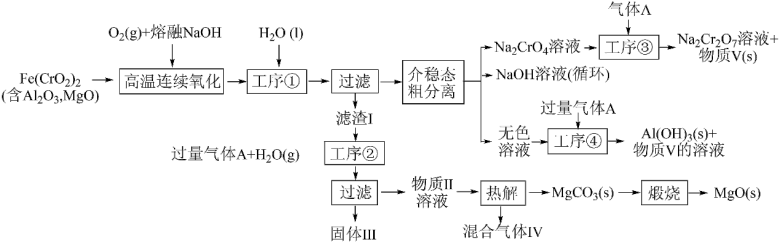
10 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______ (填元素符号)。
(2)工序①的名称为__ 。
(3)滤渣I的主要成分是__ (填化学式)。
(4)工序③中发生反应的离子方程式为_______ 。
(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为__ ,可代替NaOH的化学试剂还有_______ (填化学式)。
(6)热解工序产生的混合气体最适宜返回工序_______ (填“①”或“②”或“③”或“④”)参与内循环。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为__ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;A1(OH)3+OH-⇌Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)

回答下列问题:
(1)高温连续氧化工序中被氧化的元素是
(2)工序①的名称为
(3)滤渣I的主要成分是
(4)工序③中发生反应的离子方程式为
(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为
(6)热解工序产生的混合气体最适宜返回工序
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
您最近一年使用:0次
2021-06-09更新
|
12006次组卷
|
23卷引用:云南省昆明市第三中学2022-2023学年高三上学期10月月考化学试题
云南省昆明市第三中学2022-2023学年高三上学期10月月考化学试题2021年新高考河北化学高考真题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)2021年河北省高考化学试卷变式题10-18题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题河北省衡水阳光中学2022-2023学年高二上学期第一次阶段考试化学试题(已下线)第二部分 工业生产流程 综合提能训练(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



