名校
解题方法
1 . 根据所学知识回答下列问题:
(1)硫代硫酸钠( )又名大苏打、海波,可用于鞣制皮革、从矿石中提取银;还可以除去自来水中的余氯,相关的化学方程式为
)又名大苏打、海波,可用于鞣制皮革、从矿石中提取银;还可以除去自来水中的余氯,相关的化学方程式为 。
。
① 中硫元素的化合价为
中硫元素的化合价为________ ,该反应中 体现了
体现了________ (填“还原”或“氧化”)性。
②该反应中氧化剂与还原剂的物质的量之比为________ 。
③实验室中常用氢氧化钠溶液将氯气转化为次氯酸钠和氯化钠,理论上处理相同物质的量的氯气,消耗的硫代硫酸钠和氢氧化钠的物质的量之比为________ 。
(2)汽车的安全气囊内一般充入的是叠氮化钠与硝酸钾等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生反应: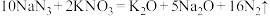 ,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。请回答下列问题:
,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。请回答下列问题:
①该反应中,氧化剂是________ ,每生成1mol Na2O,被氧化的氮原子的物质的量为________ mol。
②该反应中,生成标准状况17.92L的 ,转移的电子数为
,转移的电子数为________  。
。
③该反应中,理论上加入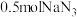 和足量
和足量 充分反应后能得到
充分反应后能得到________  。
。
(1)硫代硫酸钠(
 )又名大苏打、海波,可用于鞣制皮革、从矿石中提取银;还可以除去自来水中的余氯,相关的化学方程式为
)又名大苏打、海波,可用于鞣制皮革、从矿石中提取银;还可以除去自来水中的余氯,相关的化学方程式为 。
。①
 中硫元素的化合价为
中硫元素的化合价为 体现了
体现了②该反应中氧化剂与还原剂的物质的量之比为
③实验室中常用氢氧化钠溶液将氯气转化为次氯酸钠和氯化钠,理论上处理相同物质的量的氯气,消耗的硫代硫酸钠和氢氧化钠的物质的量之比为
(2)汽车的安全气囊内一般充入的是叠氮化钠与硝酸钾等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生反应:
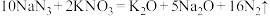 ,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。请回答下列问题:
,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。请回答下列问题:①该反应中,氧化剂是
②该反应中,生成标准状况17.92L的
 ,转移的电子数为
,转移的电子数为 。
。③该反应中,理论上加入
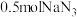 和足量
和足量 充分反应后能得到
充分反应后能得到 。
。
您最近一年使用:0次
2023-12-27更新
|
187次组卷
|
2卷引用:广西名校联盟2023-2024学年高一上学期阶段性联考化学试题
名校
解题方法
2 .  是一种重要的杀菌消毒剂,其一种利用工业废气生产工艺如图:
是一种重要的杀菌消毒剂,其一种利用工业废气生产工艺如图:

(1) 的名称为
的名称为___________ 。
(2) 中Cl的化合价为;
中Cl的化合价为; 可与NaOH溶液反应生成
可与NaOH溶液反应生成 、NaCl和水,则
、NaCl和水,则 属于
属于___________ (填序号)。
A.酸性氧化物 B.碱性氧化物 C.既不是酸性氧化物也不是碱性氧化物
(3)写出“反应”步骤中发生反应的化学方程式___________ ;其中还原剂是___________ 。
(4)“电解”步骤中发生反应的离子方程式___________ 。
(5)“操作”包括:___________ 、过滤、洗涤、干燥。
(6)生产工艺中参与循环反应的物质有___________ 。
(7)上述工艺中, 通入热NaOH溶液中,发生氧化还原反应,则反应中氧化剂与还原剂的物质的量之比为
通入热NaOH溶液中,发生氧化还原反应,则反应中氧化剂与还原剂的物质的量之比为___________ 。
 是一种重要的杀菌消毒剂,其一种利用工业废气生产工艺如图:
是一种重要的杀菌消毒剂,其一种利用工业废气生产工艺如图:
(1)
 的名称为
的名称为(2)
 中Cl的化合价为;
中Cl的化合价为; 可与NaOH溶液反应生成
可与NaOH溶液反应生成 、NaCl和水,则
、NaCl和水,则 属于
属于A.酸性氧化物 B.碱性氧化物 C.既不是酸性氧化物也不是碱性氧化物
(3)写出“反应”步骤中发生反应的化学方程式
(4)“电解”步骤中发生反应的离子方程式
(5)“操作”包括:
(6)生产工艺中参与循环反应的物质有
(7)上述工艺中,
 通入热NaOH溶液中,发生氧化还原反应,则反应中氧化剂与还原剂的物质的量之比为
通入热NaOH溶液中,发生氧化还原反应,则反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
3 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)日常使用的金属材料,大多数属于合金。合金有许多优良的物理、化学或机械性能。生活中比较常见的合金有___________ (填写一类即可,下同)。近年来,为满足某些尖端技术发展的需要,人们有设计和合成了许多新型合金,例如:___________ 。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式: )的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
)的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:

①葡萄糖的摩尔质量为___________ 。
②该注射液中葡萄糖的物质的量浓度为___________ (保留两位小数)
(3)某饮用矿泉水中,测得含有 、
、 、
、 、
、 和
和 五种主要离子(不考虑溶液中少量的
五种主要离子(不考虑溶液中少量的 和
和 或其他离子),其中
或其他离子),其中 :
: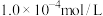 ,
, :
: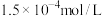 ,
, :
: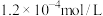 ,
, :
: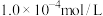 ,则溶液中
,则溶液中 的物质的量浓度是
的物质的量浓度是______  。
。
(4)水是万物之源,为探究高铁酸钾(化学式为: )在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
)在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:___________ 。
(1)日常使用的金属材料,大多数属于合金。合金有许多优良的物理、化学或机械性能。生活中比较常见的合金有
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式:
 )的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
)的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
(3)某饮用矿泉水中,测得含有
 、
、 、
、 、
、 和
和 五种主要离子(不考虑溶液中少量的
五种主要离子(不考虑溶液中少量的 和
和 或其他离子),其中
或其他离子),其中 :
: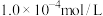 ,
, :
: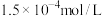 ,
, :
: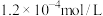 ,
, :
: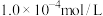 ,则溶液中
,则溶液中 的物质的量浓度是
的物质的量浓度是 。
。(4)水是万物之源,为探究高铁酸钾(化学式为:
 )在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
)在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
您最近一年使用:0次
2023-12-21更新
|
94次组卷
|
2卷引用:广西钦州市第四中学2023-2024学年高三上学期10月考试化学试卷
4 . 铝、铁及其化合物在生产、生活中有着广泛的应用。
(1)向 溶液中滴加NaOH溶液,可以观察到的现象是
溶液中滴加NaOH溶液,可以观察到的现象是_______________________ 。写出该过程涉及的氧化还原反应方程式_______________________ 。
(2)若一定量的普通铁粉和水蒸气在高温下反应生成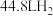 (标准状况),则转移电子的物质的量为
(标准状况),则转移电子的物质的量为__________ mol。
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用 溶液作为“腐蚀液”,该反应的离子方程式为
溶液作为“腐蚀液”,该反应的离子方程式为__________________________ ,检验反应后的溶液中是否还有三价铁离子的试剂是__________ 。
(4)铝制器具不宜盛放碱性食物,请写出铝与NaOH溶液反应的离子方程式___________________________ ,若生成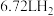 气体(标准状况),则消耗铝的质量为
气体(标准状况),则消耗铝的质量为__________ g。
(5)为了除去 中的
中的 杂质,应选择
杂质,应选择__________ (“NaOH溶液”或“氨水”),写出除杂的化学方程式_________________________________ 。
(1)向
 溶液中滴加NaOH溶液,可以观察到的现象是
溶液中滴加NaOH溶液,可以观察到的现象是(2)若一定量的普通铁粉和水蒸气在高温下反应生成
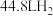 (标准状况),则转移电子的物质的量为
(标准状况),则转移电子的物质的量为(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用
 溶液作为“腐蚀液”,该反应的离子方程式为
溶液作为“腐蚀液”,该反应的离子方程式为(4)铝制器具不宜盛放碱性食物,请写出铝与NaOH溶液反应的离子方程式
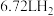 气体(标准状况),则消耗铝的质量为
气体(标准状况),则消耗铝的质量为(5)为了除去
 中的
中的 杂质,应选择
杂质,应选择
您最近一年使用:0次
2023-12-21更新
|
416次组卷
|
3卷引用:广西钦州市第四中学2023-2024学年高一上学期11月考试化学试卷
广西钦州市第四中学2023-2024学年高一上学期11月考试化学试卷湖南省长沙市雅礼中学2023-2024学年高一上学期第三次月考化学试题(已下线)寒假作业08 金属材料-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
2024·广西·模拟预测
名校
解题方法
5 . 工业上生产高纯铜的主要过程如下图所示。
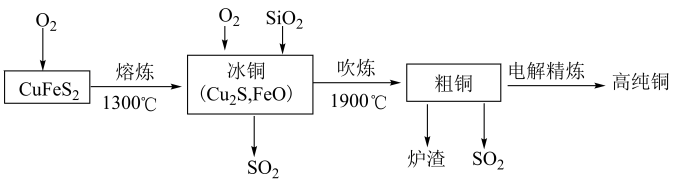
下列说法错误的是

下列说法错误的是
A.制备冰铜的反应方程式为2CuFeS2+4O2 Cu2S+2FeO+3SO2 Cu2S+2FeO+3SO2 |
| B.铜的基态电子排布式为[Ar]4s1 |
C.电解精炼铜阴极电极反应式为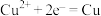 |
| D.生产粗铜过程中产生的SO2的价层电子对互斥模型为平面三角形 |
您最近一年使用:0次
2023-12-20更新
|
1582次组卷
|
4卷引用:化学01(14+4模式)2024年1月“九省联考”考前化学猜想卷
(已下线)化学01(14+4模式)2024年1月“九省联考”考前化学猜想卷江西省上饶市清源学校2023-2024学年高二上学期12月考试化学试题2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题江西省南昌市第十九中学2023-2024学年高二上学期期末考试化学试卷
名校
解题方法
6 . 铁是人体必需的微量元素。食用富含铁元素的食品,可以补充人体所需的铁元素。某实验小组通过化学实验的方法检验菠菜中的铁元素,体验实验研究的一般过程和化学知识在实际中的应用,回答下列问题:
(1)取新鲜菠菜切开表皮,在内部组织上滴加KSCN溶液,无颜色变化,说明菠菜中铁元素不以________ (填离子符号)形式存在。
(2)另取新鲜菠菜剪碎、研磨、溶解、______________ ,然后将少许滤液加入试管中,加入少量H2O2溶液,再滴加几滴KSCN溶液,振荡,若观察到_______________ 现象,说明试验样品中含有铁元素。实验中加入H2O2溶液的目的为_______________ ,加入后Fe2+发生反应的离子方程式为________________ ,一段时间后,溶液中有气泡出现,产生气泡的原因是________________ 。
(3)甲同学查阅资料发现:KSCN中的硫元素为-2价。于是往(2)中继续滴加H2O2溶液,震荡,一段时间后发现溶液变为浅棕黄色,可能的原因是________________ ,小组同学为证实自己的猜想,设计如下对照实验:向1mL0.1mol·L-1KSCN溶液中加入足量5%H2O2溶液,再加入BaCl2溶液,观察到_______________ ,证实了甲同学的猜想是正确的。
(1)取新鲜菠菜切开表皮,在内部组织上滴加KSCN溶液,无颜色变化,说明菠菜中铁元素不以
(2)另取新鲜菠菜剪碎、研磨、溶解、
(3)甲同学查阅资料发现:KSCN中的硫元素为-2价。于是往(2)中继续滴加H2O2溶液,震荡,一段时间后发现溶液变为浅棕黄色,可能的原因是
您最近一年使用:0次
7 . 下列各物质间可发生反应:
Ⅰ.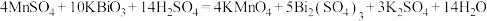
Ⅱ.
Ⅲ.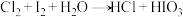 (未配平)
(未配平)
(1)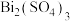 中Bi元素的化合价为
中Bi元素的化合价为___________ , 的名称为
的名称为___________ (I的元素名称叫碘)。
(2) 是正盐、钾盐、高锰酸盐,这种分类法属于
是正盐、钾盐、高锰酸盐,这种分类法属于______ (填“树状”或“交叉”)分类法。在如图中它的最佳位置是______ (填“A、B、C或D”)。

(3)反应Ⅱ是中学化学重要反应。
①请用单线桥法把电子转移的方向和数目表示出来______ 。
②反应中HCl作用是___________ 。
(4)反应Ⅲ配平后的化学方程式为___________ 。
(5)反应Ⅰ、Ⅱ、Ⅲ中作氧化剂的物质,其氧化性由强到弱的顺序为___________ 。
Ⅰ.
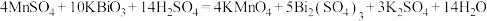
Ⅱ.

Ⅲ.
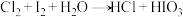 (未配平)
(未配平)(1)
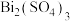 中Bi元素的化合价为
中Bi元素的化合价为 的名称为
的名称为(2)
 是正盐、钾盐、高锰酸盐,这种分类法属于
是正盐、钾盐、高锰酸盐,这种分类法属于
(3)反应Ⅱ是中学化学重要反应。
①请用单线桥法把电子转移的方向和数目表示出来
②反应中HCl作用是
(4)反应Ⅲ配平后的化学方程式为
(5)反应Ⅰ、Ⅱ、Ⅲ中作氧化剂的物质,其氧化性由强到弱的顺序为
您最近一年使用:0次
8 . 杭州亚运会零碳甲醇(CH3OH)点燃火炬惊艳世界。推广甲醇是实现碳中和目标的重要途径。下列说法错误的是
| A. CH3OH属于非电解质 |
| B.1mol CH3OH完全燃烧生成CO2和H2O,转移6mol e- |
| C.CH3OH燃烧时,甲醇是氧化剂,CO2是还原产物 |
| D.CH3OH燃烧产生的CO2可以和H2通过热催化合成甲醇,该过程中CO2被还原 |
您最近一年使用:0次
2023-12-05更新
|
124次组卷
|
3卷引用:广西壮族自治区钦州市第四中学2023-2024学年高三上学期9月考试化学试卷
解题方法
9 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
(1)实验中发生的化学反应的离子方程式为___________ 。
(2)通过实验1、4,可探究___________ (填外部因素)对化学反应速率的影响。通过实验3、5,可探究温度对化学反应速率的影响,则
___________ ,
___________ ;实验得出
___________ (填“>”、“=”或“<”) 。
。
(3)0~5min内,实验2中高锰酸钾的平均反应速率为___________  。进行实验4时发现溶液几乎没有褪色,原因可能是
。进行实验4时发现溶液几乎没有褪色,原因可能是___________ 。
(4)甲同学在实验1、2、3中观察到 溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
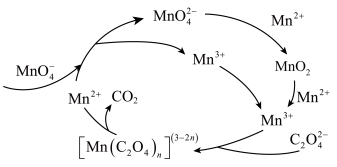
ⅰ. 与酸性
与酸性 溶液反应的一种机理如图所示:
溶液反应的一种机理如图所示:
ⅱ. 在溶液中呈紫红色,能发生反应
在溶液中呈紫红色,能发生反应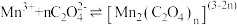 ,
,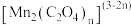 通常呈青绿色;
通常呈青绿色; 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
①仅由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为___________ 。
②乙同学将实验1中溶液pH调至1时再次做实验,发现溶液紫色并未直接褪去,而是先变为青色溶液,一段时间后青色溶液逐渐褪至无色。乙同学结合上述信息,推测紫色溶液变为青色溶液时,青色溶液中可能含有 。指导老师否定了该猜想,理由是
。指导老师否定了该猜想,理由是___________ 。
 溶液和酸性
溶液和酸性 溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:
溶液的反应进行了一系列探究外界条件的改变对化学反应速率的影响实验,相关实验如下:| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液颜色褪至无色所需时间/min | |||
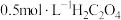 溶液 溶液 |  | 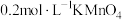 溶液 溶液 |  稀硫酸 稀硫酸 | |||
| 1 | 25 | 3.0 | 3.0 | 2.0 | 2.0 | 6.4 |
| 2 | 25 | 4.0 | 2.0 |  | 2.0 | 5.0 |
| 3 | 25 | 5.0 | 1.0 | 2.0 |  |  |
| 4 | 25 | 1.5 | 4.5 | 2.0 | 2.0 |  |
| 5 | 50 | 5.0 | 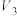 | 2.0 | 2.0 | 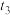 |
(1)实验中发生的化学反应的离子方程式为
(2)通过实验1、4,可探究



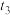 。
。(3)0~5min内,实验2中高锰酸钾的平均反应速率为
 。进行实验4时发现溶液几乎没有褪色,原因可能是
。进行实验4时发现溶液几乎没有褪色,原因可能是(4)甲同学在实验1、2、3中观察到
 溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:
溶液褪色速率开始时较慢,反应一段时间后逐渐加快。查阅资料获悉:ⅰ.
 与酸性
与酸性 溶液反应的一种机理如图所示:
溶液反应的一种机理如图所示:
ⅱ.
 在溶液中呈紫红色,能发生反应
在溶液中呈紫红色,能发生反应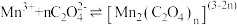 ,
,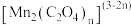 通常呈青绿色;
通常呈青绿色; 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。①仅由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为
②乙同学将实验1中溶液pH调至1时再次做实验,发现溶液紫色并未直接褪去,而是先变为青色溶液,一段时间后青色溶液逐渐褪至无色。乙同学结合上述信息,推测紫色溶液变为青色溶液时,青色溶液中可能含有
 。指导老师否定了该猜想,理由是
。指导老师否定了该猜想,理由是
您最近一年使用:0次
2023-11-22更新
|
84次组卷
|
3卷引用:广西贵港市部分学校2023-2024学年高二上学期期中联考化学试题
10 . 药物结构的修饰有助于新药的开发与利用。青蒿素可以获得双氢青蒿素,其变化过程示意图如下。下列说法不正确 的是
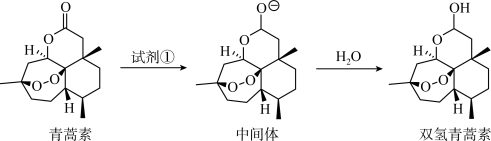
A.若试剂①为NaH,其还原产物为 |
| B.青蒿素中存在过氧键,具有强氧化性 |
| C.该过程若有1mol青蒿素完全转化,则转移2mol电子 |
| D.羟基的引入使得双氢青蒿素分子拥有更多修饰与改造的可能 |
您最近一年使用:0次
2023-11-10更新
|
1073次组卷
|
5卷引用:2024届广西普通高中学业水平选择性考试高三下学期模拟考试化学试卷
2024届广西普通高中学业水平选择性考试高三下学期模拟考试化学试卷浙江省温州市普通高中2024届高三上学期第一次适应性考试(一模)化学试题(已下线)专题01 基本概念-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)



