解题方法
1 . 嫦娥五号从月球带回的“土壤”中含有辉钼矿,其主要成分为 (S为
(S为 价),含少量
价),含少量 、
、 、
、 (铼)等元素。其中钼
(铼)等元素。其中钼 是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
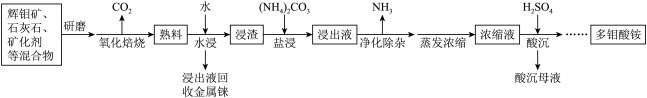
已知:25℃时
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“氧化焙烧”中发生反应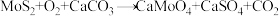 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ ,其中加入石灰石的主要作用是_______ 。
(3)加入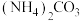 后的“浸出液”中含有
后的“浸出液”中含有 (钼酸根),以及少量
(钼酸根),以及少量 等离子,生成
等离子,生成 的离子方程式为
的离子方程式为_______ ,该反应的
_______ 。
(4)根据已知数据,“净化除杂”过程中,可加入最适宜的试剂是_______ (填标号)。
A.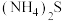 B.
B. C.
C. D.
D.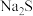
该试剂主要是将 离子转化为
离子转化为_______ (填化学式)。
(5)“酸沉”过程,调节 至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子
至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子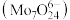 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(6)工艺流程中可循环利用的物质是_______ 、_______ 。
 (S为
(S为 价),含少量
价),含少量 、
、 、
、 (铼)等元素。其中钼
(铼)等元素。其中钼 是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
已知:25℃时
| 难溶物 |  | 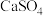 |  |  |  |
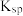 | 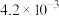 |  |  | 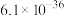 | 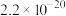 |
(1)“研磨”的目的是
(2)“氧化焙烧”中发生反应
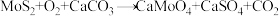 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(3)加入
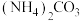 后的“浸出液”中含有
后的“浸出液”中含有 (钼酸根),以及少量
(钼酸根),以及少量 等离子,生成
等离子,生成 的离子方程式为
的离子方程式为
(4)根据已知数据,“净化除杂”过程中,可加入最适宜的试剂是
A.
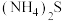 B.
B. C.
C. D.
D.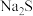
该试剂主要是将
 离子转化为
离子转化为(5)“酸沉”过程,调节
 至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子
至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子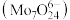 ,该反应的离子方程式为
,该反应的离子方程式为(6)工艺流程中可循环利用的物质是
您最近一年使用:0次
2022-10-21更新
|
843次组卷
|
3卷引用:广西南宁市2022-2023学年高三上学期摸底测试化学试题
22-23高一上·全国·课后作业
2 . 氧化性还原性强弱判断
①根据氧化还原反应方程式比较

氧化性:_______ ;
还原性:_______ 。
②根据金属的活动性顺序判断

③根据反应的条件及反应的剧烈程度比较
反应条件要求_______ ,反应越_______ ,对应物质的氧化性或还原性_______ 。
④根据氧化还原反应的程度比较
不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值_______ ,氧化剂的氧化性_______ 。例如:

①根据氧化还原反应方程式比较

氧化性:
还原性:
②根据金属的活动性顺序判断

③根据反应的条件及反应的剧烈程度比较
反应条件要求
④根据氧化还原反应的程度比较
不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值

您最近一年使用:0次
2022-10-10更新
|
828次组卷
|
4卷引用:广西钦州市第四中学2023-2024学年高一上学期9月考试化学试卷
广西钦州市第四中学2023-2024学年高一上学期9月考试化学试卷(已下线)物质及其变化——整体认知(已下线)【知识图鉴】单元讲练测必修第一册第一单元01讲核心【定心卷】1.3.2 氧化剂和还原剂随堂练习-人教版2023-2024学年必修第一册
3 . 下列选项中所描述的关系中物质的量比为2:1的是
| A.NO2与水反应中的氧化剂与还原剂之比 |
| B.H2S与SO2反应中氧化产物与还原产物之比 |
C.CH4(g)+CO2(g) 2CO(g)+2H2(g)平衡时速率υ(正、CH4),υ(逆、CO)之比 2CO(g)+2H2(g)平衡时速率υ(正、CH4),υ(逆、CO)之比 |
| D.氢氧燃料电池工作时,同一时间内正负极消耗的两种气体(同温同压条件下) |
您最近一年使用:0次
2022-09-26更新
|
76次组卷
|
2卷引用:广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷
解题方法
4 . 锌锰废电池中的碳包主要含有MnO2、MnOOH、NH4Cl、ZnCl2、炭粉,从中回收 MnO2 的工艺流程如下:

已知:①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
②Mn(OH)2开始沉淀时pH为7.7,则:
(1)为提高碳包溶解速率,可采取的措施有_______ 。
(2)第II步在空气中烘炒的目的除了将MnOOH转化为MnO2外,另一作用是_______ 。
(3)“还原”过程中粗MnO2溶解的离子方程式为:_______ ,溶解一定量的MnO2,实际消耗的H2O2比理论值高的原因是:_______ (用化学方程式表示)。
(4)加入NH4HCO3溶液调节溶液pH<7.7,充分反应直到不再有气泡产生;若溶液pH>7.7,会导致产品中混有_______ (填化学式)。
(5)检测MnCO3是否洗净的方法是_______ 。
(6)高纯MnCO3在空气中灼烧的化学方程式为_______ 。

已知:①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
②Mn(OH)2开始沉淀时pH为7.7,则:
(1)为提高碳包溶解速率,可采取的措施有
(2)第II步在空气中烘炒的目的除了将MnOOH转化为MnO2外,另一作用是
(3)“还原”过程中粗MnO2溶解的离子方程式为:
(4)加入NH4HCO3溶液调节溶液pH<7.7,充分反应直到不再有气泡产生;若溶液pH>7.7,会导致产品中混有
(5)检测MnCO3是否洗净的方法是
(6)高纯MnCO3在空气中灼烧的化学方程式为
您最近一年使用:0次
解题方法
5 . 三氧化钨(WO3)是一种重要的化工原料,有望延长燃料电池寿命,在陶瓷、船舶、合金等制造中也有重要应用。一种综合处理钨精矿粉(含FeWO4和MnWO4)并制备WO3的工艺流程如图所示:
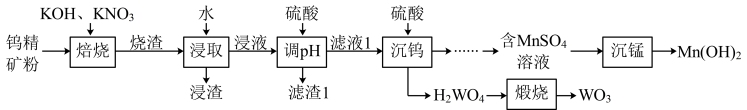
已知:①“烧渣”的主要成分为Fe2O3、KNO2、K2MnO4、K2WO4和KOH。
②弱碱性和酸性体系中,K2Mn4O、歧化为KMnO4和MnO2
回答下列问题:
(1)“焙烧”前,须将钨精矿粉与KOH、KNO3混合均匀,目的是_______ ,该工序中FeWO4发生反应的化学方程式为_______ 。
(2)“调pH不能过低,原因是_______ ,滤渣1中主要成分为_______ (写化学式)。
(3)“沉钨”工序中生成钨酸的离子方程式为_______ 。
(4)若在实验室中进行“煅烧”操作,可将固体放在_______ (填仪器名称)中加热。
(5)常温下,“沉锰”中调节溶液pH=10.2时,Mn2+恰好沉淀完全[此时溶液中c(Mn2+)=1.0×10-5 mol·L-1],则Ksp[Mn(OH)2]的数量级为_______ 。

已知:①“烧渣”的主要成分为Fe2O3、KNO2、K2MnO4、K2WO4和KOH。
②弱碱性和酸性体系中,K2Mn4O、歧化为KMnO4和MnO2
回答下列问题:
(1)“焙烧”前,须将钨精矿粉与KOH、KNO3混合均匀,目的是
(2)“调pH不能过低,原因是
(3)“沉钨”工序中生成钨酸的离子方程式为
(4)若在实验室中进行“煅烧”操作,可将固体放在
(5)常温下,“沉锰”中调节溶液pH=10.2时,Mn2+恰好沉淀完全[此时溶液中c(Mn2+)=1.0×10-5 mol·L-1],则Ksp[Mn(OH)2]的数量级为
您最近一年使用:0次
2022-09-16更新
|
317次组卷
|
2卷引用:广西西部2023届高三上学期9月联考理综化学试题
6 . 下列说法不正确 的是
A.在装有2mL和1mL0.1mol/L 溶液的二支试管中,分别滴加足量稀硫酸,观察浑浊产生的时间或产生气体的多少即可判断反应的快慢 溶液的二支试管中,分别滴加足量稀硫酸,观察浑浊产生的时间或产生气体的多少即可判断反应的快慢 |
| B.维生素C是水果罐头中常用的抗氧化剂,具有还原性 |
| C.某些强氧化剂(如:氯酸钾、高锰酸钾)及其混合物不能研磨,否则可能引起爆炸 |
| D.使用容量瓶配制溶液时,应先检漏 |
您最近一年使用:0次
2022-08-17更新
|
182次组卷
|
2卷引用:广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷
2022高三·全国·专题练习
真题
名校
7 . 室温下,下列实验探究方案不能 达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向盛有 溶液的试管中滴加几滴 溶液的试管中滴加几滴 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化 |  具有还原性 具有还原性 |
| B | 向盛有 水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 |  具有漂白性 具有漂白性 |
| C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |  的氧化性比 的氧化性比 的强 的强 |
| D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |  是弱电解质 是弱电解质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-21更新
|
10103次组卷
|
28卷引用:广西玉林市博白县中学2023-2024学年高三上学期开学考试化学试题
广西玉林市博白县中学2023-2024学年高三上学期开学考试化学试题(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题1-13河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点04 氧化还原反应-备战2023年高考化学考试易错题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江苏省南京市金陵中学河西分校2022-2023学年高二上学期期末检测化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题11-13)江苏省南京市第二十九中学2022-2023学年高二下学期3月月考化学试题(已下线)素养卷09 微型原理验证方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点10 再现常考化学实验基础知识-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)江苏省扬州中学2022-2023学年高一下学期5月月考化学试题(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)江苏省四校2023-2024学年高二上学期开学联考化学试题吉林省长春外国语学校2023-2024学年高三上学期开学考试化学试题河北省涞水北雄高级中学2022-2023学年高三下学期3月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第3讲 物质制备实验的设计与评价安徽省芜湖市安徽师范大学附属中学2023-2024学年高一下学期4月测试化学试题(已下线)第04讲 氧化还原反应的基本概念和规律(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
8 . 下列关于金属冶炼的说法错误的是(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)A.可用直接加热 的方法冶炼制备Ag 的方法冶炼制备Ag |
B.用海水为原料制得MgO固体,再用 还原MgO来制备Mg 还原MgO来制备Mg |
| C.在电解熔融NaCl制取金属钠的反应中,钠元素被还原 |
D.用Al和 反应冶炼铁,1 mol氧化剂参与反应,转移电子数为6 反应冶炼铁,1 mol氧化剂参与反应,转移电子数为6  |
您最近一年使用:0次
9 . 如图是工业生产磁性Fe3O4胶体粒子的流程:

下列说法正确的是

下列说法正确的是
| A.用Na2CO3溶液浸泡是为了除去废铁屑表面的铁锈 |
| B.加适量的H2O2,涉及反应:H2O2+Fe2++2H+=Fe3++2H2O |
C.溶液A中所存在的离子有:H+、Fe2+、Fe3+、SO |
| D.向溶液A中加入NaOH溶液并通入N2加热,反应结束后,过滤可得Fe3O4胶体粒子 |
您最近一年使用:0次
10 . 工业制硫酸中的一步重要反应是 的催化氧化。在2L密闭容器中,充入
的催化氧化。在2L密闭容器中,充入 和
和 ,在催化剂、500℃的条件下发生反应。请结合下图数据,回答下列问题。
,在催化剂、500℃的条件下发生反应。请结合下图数据,回答下列问题。

(1)写出该反应的化学方程式_______ 。
(2)反应开始至20min末,以 的变化表示该反应的平均速率是
的变化表示该反应的平均速率是_______ 。
(3)下列叙述不能判断该反应达到平衡状态是_______(填字母)
(4)已知2mol 与1mol
与1mol 的总能量比2mol
的总能量比2mol 的能量大196kJ。以下能正确表示
的能量大196kJ。以下能正确表示 催化氧化生成
催化氧化生成 的能量变化过程的图示是_______(填字母)
的能量变化过程的图示是_______(填字母)
(5)某课外活动小组利用 能使酸性
能使酸性 溶液褪色的原理测定空气中的
溶液褪色的原理测定空气中的 含量,这一现象体现了
含量,这一现象体现了 的
的_______ 性。
(6)某企业利用下图流程综合处理工厂排放的含 的烟气,以减少其对环境造成的污染。“氨气吸收塔”中发生反应的化学方程式为
的烟气,以减少其对环境造成的污染。“氨气吸收塔”中发生反应的化学方程式为_______ ,在整个流程中可循环利用的物质为_______ (填化学式)。

(7)硝酸工业的尾气中含有NO, 光催化氧化法脱除NO的过程如图所示。图中
光催化氧化法脱除NO的过程如图所示。图中 最终转化为
最终转化为 的化学方程式为
的化学方程式为_______ 。

 的催化氧化。在2L密闭容器中,充入
的催化氧化。在2L密闭容器中,充入 和
和 ,在催化剂、500℃的条件下发生反应。请结合下图数据,回答下列问题。
,在催化剂、500℃的条件下发生反应。请结合下图数据,回答下列问题。
(1)写出该反应的化学方程式
(2)反应开始至20min末,以
 的变化表示该反应的平均速率是
的变化表示该反应的平均速率是(3)下列叙述不能判断该反应达到平衡状态是_______(填字母)
| A.容器中压强不再改变 | B. 的质量不再改变 的质量不再改变 |
C. 的浓度与 的浓度与 的浓度相等 的浓度相等 | D.单位时间内生成1mol ,同时生成1mol ,同时生成1mol |
 与1mol
与1mol 的总能量比2mol
的总能量比2mol 的能量大196kJ。以下能正确表示
的能量大196kJ。以下能正确表示 催化氧化生成
催化氧化生成 的能量变化过程的图示是_______(填字母)
的能量变化过程的图示是_______(填字母)A. | B. |
C. | D. |
 能使酸性
能使酸性 溶液褪色的原理测定空气中的
溶液褪色的原理测定空气中的 含量,这一现象体现了
含量,这一现象体现了 的
的(6)某企业利用下图流程综合处理工厂排放的含
 的烟气,以减少其对环境造成的污染。“氨气吸收塔”中发生反应的化学方程式为
的烟气,以减少其对环境造成的污染。“氨气吸收塔”中发生反应的化学方程式为
(7)硝酸工业的尾气中含有NO,
 光催化氧化法脱除NO的过程如图所示。图中
光催化氧化法脱除NO的过程如图所示。图中 最终转化为
最终转化为 的化学方程式为
的化学方程式为
您最近一年使用:0次



