解题方法
1 . 氮元素是植物不可缺少的一种主要营养元素。游离态的N分子不能被大多数植物直接吸收,植物吸收和利用效果最好的是 和
和 。回答下列问题:
。回答下列问题:
(1)氮的固定包含人工固氮和___________ ;人工固氮中工业合成氨的化学方程式为___________ 。
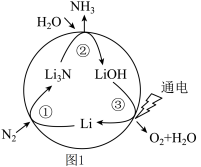
(2)一种新型人工固氮的原理如图1所示,这种固氮方式的总反应方程式为___________ (反应条件省略);反应①②③中属于氧化还原反应的是___________ (填编号)。
(3)碳酸氢铵作肥料时,要遵循“五不施”原则。其中有“烈日当空不施”,原因是___________ (用化学方程式表示)。
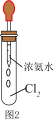
(4)自然界中的微生物也可将氮的化合态NH3转化为游离态的N2,在实验室可用Cl2实现此过程。如图2所示,试管中集满干燥的Cl2,迅速用胶塞塞紧,滴入足量浓氨水。开始时,试管内发生反应:2NH3+3Cl2=N2+6HCl,并产生白烟。白烟的化学式为___________ ,将反应后的试管浸入水中并倒立,在水下打开胶塞,最终进入试管内的水约占试管总体积的___________ 。
 和
和 。回答下列问题:
。回答下列问题:(1)氮的固定包含人工固氮和
(2)一种新型人工固氮的原理如图1所示,这种固氮方式的总反应方程式为

(3)碳酸氢铵作肥料时,要遵循“五不施”原则。其中有“烈日当空不施”,原因是
(4)自然界中的微生物也可将氮的化合态NH3转化为游离态的N2,在实验室可用Cl2实现此过程。如图2所示,试管中集满干燥的Cl2,迅速用胶塞塞紧,滴入足量浓氨水。开始时,试管内发生反应:2NH3+3Cl2=N2+6HCl,并产生白烟。白烟的化学式为

您最近一年使用:0次
解题方法
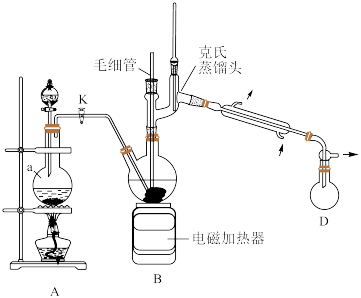
2 . 叠氮化钠(NaN3)是一种重要的化学分析试剂,已知NaN3无色无味,微溶于醇、易溶于水,在40℃以上会发生分解。实验室模仿工业“亚硝酸甲酯-水合肼法”制备NaN3,装置如图所示,基本操作如下:
步骤2:生成的亚硝酸甲酯(CH3ONO)蒸气通入到水合肼(N2H4·H2O)的烧碱溶液中,通过电磁加热器加热,生成叠氮化钠;
步骤3:减压蒸馏,回收甲醇;
步骤4:蒸馏后所得母液,冷却结晶、过滤、洗涤、干燥,得到叠氮化钠。
回答下列问题:
(1)仪器a的名称为___________ ;写出装置A中生成CH3ONO的化学方程式:___________ 。
(2)写出装置B中生成NaN3的化学方程式:___________ 。
(3)装置B反应结束后需采用减压蒸馏回收甲醇,不宜直接蒸馏的原因是___________ ;减压蒸馏中使用毛细管的优点是___________ 。
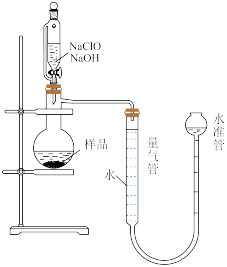
(4)量气法可有效测定产品的纯度,装置如图所示。___________ ;反应结束后水准管中液面会高于量气管,此时需要将水准管慢慢向下移动,则量气管中的液面会___________ (填“上移”“下移”或“不移动”),该产品的纯度(质量分数)为___________ (用含m、V的表达式表示)。
步骤2:生成的亚硝酸甲酯(CH3ONO)蒸气通入到水合肼(N2H4·H2O)的烧碱溶液中,通过电磁加热器加热,生成叠氮化钠;
步骤3:减压蒸馏,回收甲醇;
步骤4:蒸馏后所得母液,冷却结晶、过滤、洗涤、干燥,得到叠氮化钠。
回答下列问题:
(1)仪器a的名称为
(2)写出装置B中生成NaN3的化学方程式:
(3)装置B反应结束后需采用减压蒸馏回收甲醇,不宜直接蒸馏的原因是
(4)量气法可有效测定产品的纯度,装置如图所示。
您最近一年使用:0次
解题方法
3 . 重铬酸钠 主要用于涂料、金属缓蚀剂、有机合成氧化剂等。工业上以铬铁矿(主要成分亚铬酸亚铁
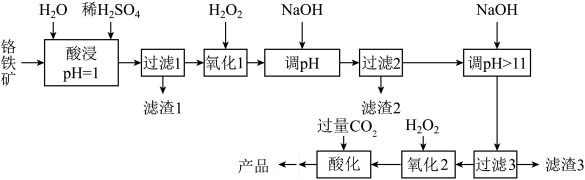
主要用于涂料、金属缓蚀剂、有机合成氧化剂等。工业上以铬铁矿(主要成分亚铬酸亚铁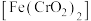 ,含少量Mg、Al、Si等杂质元素)为原料制取重铬酸钠的工艺流程如图:
,含少量Mg、Al、Si等杂质元素)为原料制取重铬酸钠的工艺流程如图:
已知:① 在酸性溶液中性质稳定,当
在酸性溶液中性质稳定,当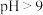 时,以
时,以 形式存在且易被氧化;
形式存在且易被氧化;
②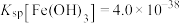 ,
,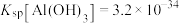 ,
,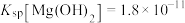 ;
;
③最高价铬酸根在碱性介质中以 存在,在酸性介质中以
存在,在酸性介质中以 存在。
存在。
回答下列问题:
(1)基态Cr原子和Fe原子中未成对电子数之比为_______ 。
(2)滤渣1的主要成分为_______ (写化学式)。
(3)“氧化1”加入足量H2O2的目的是_______ ,为防止反应过于剧烈,可采取的措施是_______ 。
(4)“调pH”至 恰好沉淀完全时滤液中
恰好沉淀完全时滤液中
_______ 。
(5)检验“滤渣3”被水洗净的试剂为_______ 。
(6)“氧化2”反应的离子方程式为_______ 。
(7)“酸化”反应的化学方程式为_______ 。
 主要用于涂料、金属缓蚀剂、有机合成氧化剂等。工业上以铬铁矿(主要成分亚铬酸亚铁
主要用于涂料、金属缓蚀剂、有机合成氧化剂等。工业上以铬铁矿(主要成分亚铬酸亚铁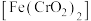 ,含少量Mg、Al、Si等杂质元素)为原料制取重铬酸钠的工艺流程如图:
,含少量Mg、Al、Si等杂质元素)为原料制取重铬酸钠的工艺流程如图:
已知:①
 在酸性溶液中性质稳定,当
在酸性溶液中性质稳定,当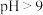 时,以
时,以 形式存在且易被氧化;
形式存在且易被氧化;②
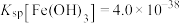 ,
,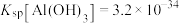 ,
,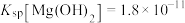 ;
;③最高价铬酸根在碱性介质中以
 存在,在酸性介质中以
存在,在酸性介质中以 存在。
存在。回答下列问题:
(1)基态Cr原子和Fe原子中未成对电子数之比为
(2)滤渣1的主要成分为
(3)“氧化1”加入足量H2O2的目的是
(4)“调pH”至
 恰好沉淀完全时滤液中
恰好沉淀完全时滤液中
(5)检验“滤渣3”被水洗净的试剂为
(6)“氧化2”反应的离子方程式为
(7)“酸化”反应的化学方程式为
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠( )俗称大苏打,是化学常用试剂。回答下列问题:
)俗称大苏打,是化学常用试剂。回答下列问题:
(1) 中S的平均化合价为
中S的平均化合价为_______ 。从组成角度分类,它属于_______ (填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2) 在碱性条件下稳定存在,在酸性条件下不稳定。向
在碱性条件下稳定存在,在酸性条件下不稳定。向 溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:
溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:_______ 。
(3)在定量实验中,常用 溶液测定溶液中
溶液测定溶液中 含量,发生反应的化学方程式为
含量,发生反应的化学方程式为 。若某次实验中恰好消耗200mL
。若某次实验中恰好消耗200mL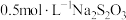 溶液,理论上转移电子数目约为
溶液,理论上转移电子数目约为_______ 。
(4)某实验需要使用250mL 溶液,用
溶液,用 配制该溶液。
配制该溶液。
①配制过程中,下列仪器不需要选用的是_______ (填字母)。
A. B.
B. C.
C. D.
D.
②若其他操作均正确,定容时俯视刻度线,配制的溶液浓度_______ (填“偏小”“偏大”或“无影响”,下同);容量瓶没有干燥,配制的溶液浓度_______ 。
 )俗称大苏打,是化学常用试剂。回答下列问题:
)俗称大苏打,是化学常用试剂。回答下列问题:(1)
 中S的平均化合价为
中S的平均化合价为A.酸 B.碱 C.盐 D.氧化物
(2)
 在碱性条件下稳定存在,在酸性条件下不稳定。向
在碱性条件下稳定存在,在酸性条件下不稳定。向 溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:
溶液中滴加盐酸,溶液变浑浊,析出浅黄色固体(单质)并放出刺激性气味的气体(相对分子质量为64),写出该反应的离子方程式:(3)在定量实验中,常用
 溶液测定溶液中
溶液测定溶液中 含量,发生反应的化学方程式为
含量,发生反应的化学方程式为 。若某次实验中恰好消耗200mL
。若某次实验中恰好消耗200mL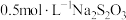 溶液,理论上转移电子数目约为
溶液,理论上转移电子数目约为(4)某实验需要使用250mL
 溶液,用
溶液,用 配制该溶液。
配制该溶液。①配制过程中,下列仪器不需要选用的是
A.
 B.
B. C.
C. D.
D.
②若其他操作均正确,定容时俯视刻度线,配制的溶液浓度
您最近一年使用:0次
5 . 二氧化氯( ,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠(
,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠( )制备
)制备 。制备
。制备 及验证其氧化性的装置如图所示(部分夹持装置已省略):
及验证其氧化性的装置如图所示(部分夹持装置已省略):

已知:实验室可用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放
,使用时加酸只释放 一种气体;酸性条件下高锰酸钾的还原产物为
一种气体;酸性条件下高锰酸钾的还原产物为 。回答下列问题:
。回答下列问题:
(1)盛装浓盐酸的仪器名称为_______ 。
(2)装置A中发生反应的离子方程式为_______ 。
(3)装置B中盛放的试剂是_______ 。
(4)向装置D中通入 的目的是
的目的是_______ ,装置D中发生反应的化学方程式为_______ 。
(5)装置G中能观察到溶液显红色,则发生反应的离子方程式为_______ 、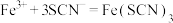 。
。
(6)用 替代
替代 作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率: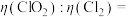
_______ (保留到小数点后两位)。
 ,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠(
,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠( )制备
)制备 。制备
。制备 及验证其氧化性的装置如图所示(部分夹持装置已省略):
及验证其氧化性的装置如图所示(部分夹持装置已省略):
已知:实验室可用稳定剂吸收
 ,生成
,生成 ,使用时加酸只释放
,使用时加酸只释放 一种气体;酸性条件下高锰酸钾的还原产物为
一种气体;酸性条件下高锰酸钾的还原产物为 。回答下列问题:
。回答下列问题:(1)盛装浓盐酸的仪器名称为
(2)装置A中发生反应的离子方程式为
(3)装置B中盛放的试剂是
(4)向装置D中通入
 的目的是
的目的是(5)装置G中能观察到溶液显红色,则发生反应的离子方程式为
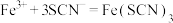 。
。(6)用
 替代
替代 作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率: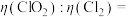
您最近一年使用:0次
解题方法
6 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的用途。用工业烧渣(主要成分为 、
、 ,含少量FeO等)回收并分离
,含少量FeO等)回收并分离 和
和 ,工艺流程图如下所示:
,工艺流程图如下所示:

已知: 。
。
回答下列问题:
(1)“烧渣”中加入NaOH溶液发生反应的化学方程式为___________ 。
(2)“物质X”的俗称为___________ 。物质X也可以通过向饱和氯化钠溶液中先后通入足量的氨气和二氧化碳制得,写出反应的化学方程式:___________ 。
(3)向“滤渣I”中加入盐酸溶解后,再加入双氧水的目的是___________ ,发生反应的离子方程式为___________ 。
(4)写出“物质Y”的一种用途:___________ 。
(5)若将“滤渣1”用适量硫酸恰好完全溶解后,进行过滤得到 和
和 的混合溶液。通过元素分析测得其中Fe和S的物质的量之比
的混合溶液。通过元素分析测得其中Fe和S的物质的量之比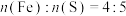 ,则此溶液中
,则此溶液中 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、
、 ,含少量FeO等)回收并分离
,含少量FeO等)回收并分离 和
和 ,工艺流程图如下所示:
,工艺流程图如下所示:
已知:
 。
。回答下列问题:
(1)“烧渣”中加入NaOH溶液发生反应的化学方程式为
(2)“物质X”的俗称为
(3)向“滤渣I”中加入盐酸溶解后,再加入双氧水的目的是
(4)写出“物质Y”的一种用途:
(5)若将“滤渣1”用适量硫酸恰好完全溶解后,进行过滤得到
 和
和 的混合溶液。通过元素分析测得其中Fe和S的物质的量之比
的混合溶液。通过元素分析测得其中Fe和S的物质的量之比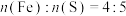 ,则此溶液中
,则此溶液中 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
7 . Mg的结构特性类似于铝,可作飞机、导弹的合金材料。海水提取镁的流程如下:
i.制备石灰乳:将含有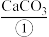 的大理石通过高温加热,随后形成
的大理石通过高温加热,随后形成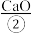 和
和 。
。 加入水中会形成石灰乳[含有部分未溶解的
加入水中会形成石灰乳[含有部分未溶解的 ]。
]。
ii.沉淀:将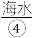 引入沉淀池中,海水中的
引入沉淀池中,海水中的 和石灰乳会发生化学反应生皮
和石灰乳会发生化学反应生皮 。
。
iii.酸化:让 与
与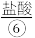 发生反应。
发生反应。
iv.蒸发结晶:将氯化镁溶液蒸发浓缩、冷却结晶得到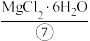 。
。
v.脱水:在 的气流中将
的气流中将 脱水制成
脱水制成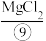 。
。
vi.电解:电解熔融 得到
得到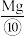 和
和 。
。
回答下列问题:
(1)常温下,上述标有序号的物质中,能导电的是___________ (填序号,下同);属于酸性氧化物的是___________ 。
(2)石灰乳属于___________ (填“溶液”、“胶体”或“浊液”),沉淀时发生反应的离子方程式为___________ 。
(3)酸化时的化学方程式为___________ ;蒸发结晶需要用到的仪器为___________ (填标号)。

(4)高温下铝粉和氧化铁可以发生置换反应,该反应的化学方程式为___________ ;甲同学提出用铝粉与MgSO4溶液反应来制备镁单质,乙同学认为甲同学的方法不合理,乙同学的理由可能是___________ 。
i.制备石灰乳:将含有
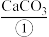 的大理石通过高温加热,随后形成
的大理石通过高温加热,随后形成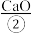 和
和 。
。 加入水中会形成石灰乳[含有部分未溶解的
加入水中会形成石灰乳[含有部分未溶解的 ]。
]。ii.沉淀:将
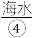 引入沉淀池中,海水中的
引入沉淀池中,海水中的 和石灰乳会发生化学反应生皮
和石灰乳会发生化学反应生皮 。
。iii.酸化:让
 与
与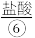 发生反应。
发生反应。iv.蒸发结晶:将氯化镁溶液蒸发浓缩、冷却结晶得到
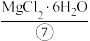 。
。v.脱水:在
 的气流中将
的气流中将 脱水制成
脱水制成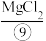 。
。vi.电解:电解熔融
 得到
得到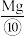 和
和 。
。回答下列问题:
(1)常温下,上述标有序号的物质中,能导电的是
(2)石灰乳属于
(3)酸化时的化学方程式为

(4)高温下铝粉和氧化铁可以发生置换反应,该反应的化学方程式为
您最近一年使用:0次
8 . 过氧化氢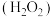 水溶液俗称双氧水,常用于医用伤口消毒、环境消毒和食品消毒。
水溶液俗称双氧水,常用于医用伤口消毒、环境消毒和食品消毒。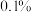 的高锰酸钾溶液常用于伤口的杀菌和鱼缸的消毒。二者混合使用时效果会大打折扣,因为混合时会发生反应:
的高锰酸钾溶液常用于伤口的杀菌和鱼缸的消毒。二者混合使用时效果会大打折扣,因为混合时会发生反应: 。下列说法正确的是
。下列说法正确的是
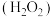 水溶液俗称双氧水,常用于医用伤口消毒、环境消毒和食品消毒。
水溶液俗称双氧水,常用于医用伤口消毒、环境消毒和食品消毒。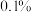 的高锰酸钾溶液常用于伤口的杀菌和鱼缸的消毒。二者混合使用时效果会大打折扣,因为混合时会发生反应:
的高锰酸钾溶液常用于伤口的杀菌和鱼缸的消毒。二者混合使用时效果会大打折扣,因为混合时会发生反应: 。下列说法正确的是
。下列说法正确的是A.氧化性: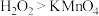 | B.还原剂和还原产物分别为 和 和 |
C.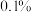 的高锰酸钾溶液属于电解质 的高锰酸钾溶液属于电解质 | D. |
您最近一年使用:0次
9 . 以下是某高一同学整理课本上铁及其化合物的有关知识,其中错误的是
| A.高炉炼铁过程中,发生了氧化还原反应 |
B. 是一种红棕色粉末,俗称磁性氧化铁 是一种红棕色粉末,俗称磁性氧化铁 |
C. 不稳定,在空气中加热迅速被氧化成 不稳定,在空气中加热迅速被氧化成 |
| D.炽热的铁水或钢水倒入模具之前,模具必须进行充分的干燥 |
您最近一年使用:0次
解题方法
10 . 磷酸亚铁锂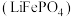 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点。氮化钛
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点。氮化钛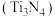 为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿[主要成分
为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿[主要成分 (钛酸亚铁),含有少量
(钛酸亚铁),含有少量 、
、 、
、 等杂质]制备氮化钛和磷酸亚铁锂的工艺流程如下:
等杂质]制备氮化钛和磷酸亚铁锂的工艺流程如下:
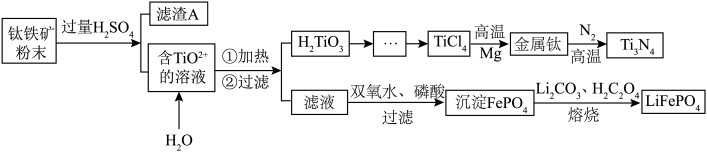
已知:①钛铁矿与硫酸的主要反应: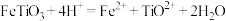 ;
;
② 遇水会水解。
遇水会水解。
请回答下列问题:
(1)请写出加快钛铁矿与硫酸反应速率的方法___________ (至少写出两种)。
(2)滤渣A是___________ (化学式)。
(3)含 的溶液转化为
的溶液转化为 的离子方程式
的离子方程式___________ 。
(4)由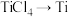 需要在Ar氛围中进行的理由
需要在Ar氛围中进行的理由___________ ;反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到钛单质,依据下表中的信息,需要加热的温度略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到钛单质,依据下表中的信息,需要加热的温度略高于___________ 即可。
(5)请写出滤液制取 的离子反应方程式
的离子反应方程式___________ 。
(6)写出熔烧制备 的化学反应方程式
的化学反应方程式___________ 。
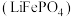 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点。氮化钛
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点。氮化钛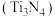 为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿[主要成分
为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿[主要成分 (钛酸亚铁),含有少量
(钛酸亚铁),含有少量 、
、 、
、 等杂质]制备氮化钛和磷酸亚铁锂的工艺流程如下:
等杂质]制备氮化钛和磷酸亚铁锂的工艺流程如下:
已知:①钛铁矿与硫酸的主要反应:
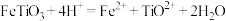 ;
;②
 遇水会水解。
遇水会水解。请回答下列问题:
(1)请写出加快钛铁矿与硫酸反应速率的方法
(2)滤渣A是
(3)含
 的溶液转化为
的溶液转化为 的离子方程式
的离子方程式(4)由
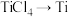 需要在Ar氛围中进行的理由
需要在Ar氛围中进行的理由 、Ti的混合物,可采用真空蒸馏的方法分离得到钛单质,依据下表中的信息,需要加热的温度略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到钛单质,依据下表中的信息,需要加热的温度略高于 | Mg |  | Ti | |
| 熔点/℃ |  | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)请写出滤液制取
 的离子反应方程式
的离子反应方程式(6)写出熔烧制备
 的化学反应方程式
的化学反应方程式
您最近一年使用:0次



