1 . 酸性条件下,硫酸亚铁铵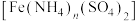 溶液与
溶液与 溶液可发生如下反应:
溶液可发生如下反应: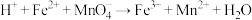 (未配平),下列说法中不正确的是
(未配平),下列说法中不正确的是
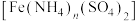 溶液与
溶液与 溶液可发生如下反应:
溶液可发生如下反应: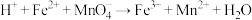 (未配平),下列说法中不正确的是
(未配平),下列说法中不正确的是A.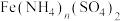 中n值等于2 中n值等于2 |
B.氧化性: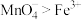 |
C.配平后 的化学计量数为6 的化学计量数为6 |
D.1 mol  被还原, 被还原, 共失去5 mol 共失去5 mol  |
您最近一年使用:0次
2 . 2024年4月25日,搭载神舟十八号载人飞船的长征二号F遥十八运载火箭在酒泉卫星发射中心成功点火发射,并且飞船成功进入预定轨道。
(1)偏二甲肼[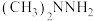 ,N元素的化合价为-2价]是运载火箭常用的推进剂之一,但偏二甲肼为有毒的无色液体,残余的偏二甲肼可将其转化为
,N元素的化合价为-2价]是运载火箭常用的推进剂之一,但偏二甲肼为有毒的无色液体,残余的偏二甲肼可将其转化为 而除去,请选择合适的偏二甲肼处理剂:
而除去,请选择合适的偏二甲肼处理剂:___________ (填序号,多选)。
a.铁粉 b.高锰酸钾溶液 c.次氯酸钙溶液 d.氨水
(2)火箭逃逸塔采用了高性能耐烧蚀树脂,该材料属于___________ 有机高分子材料(填“天然”或“合成”);橡胶制品在航空航天领域也有着广泛的应用,工业上常用硫与橡胶作用以进行橡胶硫化,该过程属于___________ 变化(填“物理”或“化学”)。
(3)中科院上海硅酸盐研究所研制的防烧蚀污染涂层成功应用于飞船的舷窗,该涂层具有___________ 的性能和自清洁功能,保证了返回舱返回大气层时,舷窗在2000℃的高温下以及在受到烧蚀使材料挥发污染后,仍具有清晰的透明度。
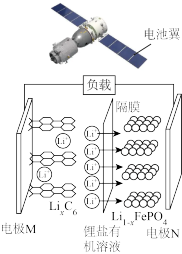
(4)飞船入轨后,太阳电池翼展开是确保飞船实现能源供给的关键动作。电池翼用到的无机非金属材料主要是砷化镓和___________ (填化学式),可将___________ 能转化为___________ 能;飞船的主电源储能电池首次采用大容量、长寿命的锂离子蓄电池,该电池属于___________ (填“一次电池”或“二次电池”),磷酸亚铁锂电池也是一种常见的锂离子电池,放电时的工作原理是如右图所示,电极M是___________ 极(填“负”或“正”)。
(1)偏二甲肼[
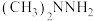 ,N元素的化合价为-2价]是运载火箭常用的推进剂之一,但偏二甲肼为有毒的无色液体,残余的偏二甲肼可将其转化为
,N元素的化合价为-2价]是运载火箭常用的推进剂之一,但偏二甲肼为有毒的无色液体,残余的偏二甲肼可将其转化为 而除去,请选择合适的偏二甲肼处理剂:
而除去,请选择合适的偏二甲肼处理剂:a.铁粉 b.高锰酸钾溶液 c.次氯酸钙溶液 d.氨水
(2)火箭逃逸塔采用了高性能耐烧蚀树脂,该材料属于
(3)中科院上海硅酸盐研究所研制的防烧蚀污染涂层成功应用于飞船的舷窗,该涂层具有
(4)飞船入轨后,太阳电池翼展开是确保飞船实现能源供给的关键动作。电池翼用到的无机非金属材料主要是砷化镓和
您最近一年使用:0次
解题方法
3 . 某化学实验小组探究了铜的氧化过程。回答下列问题:
(1)铜与浓硝酸反应的装置如图:_______ ,装置B的作用是_______ 。
②已知装置B中发生反应: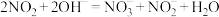 ,若有ag
,若有ag  参加反应,理论上转移电子的物质的量为
参加反应,理论上转移电子的物质的量为_______ 。(用含a的代数式表示)
(2)铜与过量 溶液反应的探究如下:
溶液反应的探究如下:_______ ,产生的气体为_______ (填化学式)。
(3)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的条件下,使 与NO反应生成无污染的
与NO反应生成无污染的 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。45g NO和17g  在一定条件下发生反应,如果
在一定条件下发生反应,如果 的实际产率为60%,则生成
的实际产率为60%,则生成 的质量为
的质量为_______ 。
(1)铜与浓硝酸反应的装置如图:

②已知装置B中发生反应:
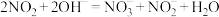 ,若有ag
,若有ag  参加反应,理论上转移电子的物质的量为
参加反应,理论上转移电子的物质的量为(2)铜与过量
 溶液反应的探究如下:
溶液反应的探究如下: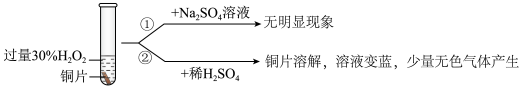
(3)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的条件下,使
 与NO反应生成无污染的
与NO反应生成无污染的 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式: 在一定条件下发生反应,如果
在一定条件下发生反应,如果 的实际产率为60%,则生成
的实际产率为60%,则生成 的质量为
的质量为
您最近一年使用:0次
2024-07-13更新
|
70次组卷
|
2卷引用:山西省太原市2023-2024学年高一下学期7月期末考试化学试题
名校
4 . 硫代硫酸钠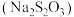 在纺织业、造纸业等领域有广泛应用。某兴趣小组拟制备硫代硫酸钠晶体
在纺织业、造纸业等领域有广泛应用。某兴趣小组拟制备硫代硫酸钠晶体 。
。
【查阅资料】
i. 易溶于水,遇酸易分解生成S和
易溶于水,遇酸易分解生成S和 。
。
ii.向 和
和 混合溶液中通入
混合溶液中通入 可制得
可制得 ,所得产品常含有少量
,所得产品常含有少量 和
和 。
。
iii. 易被氧化;
易被氧化; 难溶于水,可溶于稀
难溶于水,可溶于稀 。
。
【制备产品】
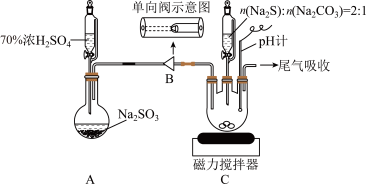
实验装置如图所示(省略夹持装置):
i.检查装置气密性,按图示加入试剂。
ii.先向C中烧瓶中加入 和
和 混合溶液,再向A中烧瓶中滴加70%浓
混合溶液,再向A中烧瓶中滴加70%浓 ,装置A产生的
,装置A产生的 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液,结束反应。
气体,得产品混合溶液,结束反应。
iii.过滤C中混合溶液,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到 产品。
产品。
回答下列问题:
(1)反应开始后,C中先有浑浊产生,后又变澄清。此浑浊物是_____ (写化学式)。该浑浊物是由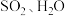 和
和_____ (写化学式)反应得到,该物质和 反应的物质的量之比为
反应的物质的量之比为_____ 。
(2)实验过程中有大量 产生,反应的化学方程式为
产生,反应的化学方程式为_____ 。
(3)装置B中单向阀的作用是_____ ;为保证硫代硫酸钠的产量,实验中通入装置C混合溶液中的 不能过量,原因是
不能过量,原因是_____ 。
(4)为减少装置C中生成 的量,在不改变原有装置的基础上对实验步骤(ii)进行了改进,改进后的操作是
的量,在不改变原有装置的基础上对实验步骤(ii)进行了改进,改进后的操作是_____ 。
探究 的性质:
的性质:
步骤i:取 晶体,溶解,配成
晶体,溶解,配成 溶液。
溶液。
步骤ii:取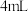 溶液,向其中加入
溶液,向其中加入 饱和氯水
饱和氯水 ,溶液立即出现浑浊,经检验浑浊物为S。
,溶液立即出现浑浊,经检验浑浊物为S。
步骤iii:继续滴加饱和氯水,浑浊度增大,最后消失,溶液变澄清。
(5)探究S产生的原因( 中S元素的化合价分别为
中S元素的化合价分别为 和
和 ):
):
提出假设:
假设1: 等含氯的氧化性微粒氧化了
等含氯的氧化性微粒氧化了 价硫元素。
价硫元素。
假设2:空气中的 氧化了
氧化了 价硫元素。
价硫元素。
假设3:酸性条件下 分解产生S。
分解产生S。
设计实验方案:
_____ 。
②对比实验a、b,可得出的结论是_____ 。
(6)步骤iii中,溶液最终变澄清的原因是_____ (写化学方程式)。
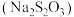 在纺织业、造纸业等领域有广泛应用。某兴趣小组拟制备硫代硫酸钠晶体
在纺织业、造纸业等领域有广泛应用。某兴趣小组拟制备硫代硫酸钠晶体 。
。【查阅资料】
i.
 易溶于水,遇酸易分解生成S和
易溶于水,遇酸易分解生成S和 。
。ii.向
 和
和 混合溶液中通入
混合溶液中通入 可制得
可制得 ,所得产品常含有少量
,所得产品常含有少量 和
和 。
。iii.
 易被氧化;
易被氧化; 难溶于水,可溶于稀
难溶于水,可溶于稀 。
。【制备产品】
实验装置如图所示(省略夹持装置):
i.检查装置气密性,按图示加入试剂。
ii.先向C中烧瓶中加入
 和
和 混合溶液,再向A中烧瓶中滴加70%浓
混合溶液,再向A中烧瓶中滴加70%浓 ,装置A产生的
,装置A产生的 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液,结束反应。
气体,得产品混合溶液,结束反应。iii.过滤C中混合溶液,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到
 产品。
产品。回答下列问题:
(1)反应开始后,C中先有浑浊产生,后又变澄清。此浑浊物是
 和
和 反应的物质的量之比为
反应的物质的量之比为(2)实验过程中有大量
 产生,反应的化学方程式为
产生,反应的化学方程式为(3)装置B中单向阀的作用是
 不能过量,原因是
不能过量,原因是(4)为减少装置C中生成
 的量,在不改变原有装置的基础上对实验步骤(ii)进行了改进,改进后的操作是
的量,在不改变原有装置的基础上对实验步骤(ii)进行了改进,改进后的操作是探究
 的性质:
的性质:步骤i:取
 晶体,溶解,配成
晶体,溶解,配成 溶液。
溶液。步骤ii:取
 溶液,向其中加入
溶液,向其中加入 饱和氯水
饱和氯水 ,溶液立即出现浑浊,经检验浑浊物为S。
,溶液立即出现浑浊,经检验浑浊物为S。步骤iii:继续滴加饱和氯水,浑浊度增大,最后消失,溶液变澄清。
(5)探究S产生的原因(
 中S元素的化合价分别为
中S元素的化合价分别为 和
和 ):
):提出假设:
假设1:
 等含氯的氧化性微粒氧化了
等含氯的氧化性微粒氧化了 价硫元素。
价硫元素。假设2:空气中的
 氧化了
氧化了 价硫元素。
价硫元素。假设3:酸性条件下
 分解产生S。
分解产生S。设计实验方案:
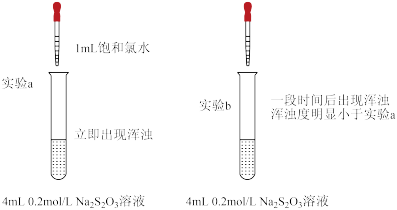

②对比实验a、b,可得出的结论是
(6)步骤iii中,溶液最终变澄清的原因是
您最近一年使用:0次
名校
解题方法
5 . 氮氧化物(NOx)、SO2等气体会造成一系列的环境和生态问题,按要求回答下列问题。
(1)某同学在实验室模拟NH3吸收NO2的实验设计如图(部分夹持装置省略)。_______ ,装置B和装置C的作用均为干燥气体,装置B、C中的干燥剂_______ (填“能”或“不能”)相同。
②装置D中发生反应的化学方程式是_______ 。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为_______ 。
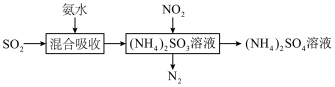
(2)工业生产中利用氨水吸收SO2和NO2,原理如下:_______ 。
(3)碘、水吸收SO2的具体流程如图所示。已知:HI为无色易挥发气体,碘蒸汽为深紫色。_______ 。
②分离器中将H2SO4和HI分离的方法是_______ 。
③膜反应器中发生可逆反应: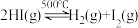 ,若膜反应器体积固定,下列状态能说明反应达到最大限度的是
,若膜反应器体积固定,下列状态能说明反应达到最大限度的是_______ (填字母)。
a.膜反应器中HI、H2、I2的物质的量之比为2:1:1
b.膜反应器中气体颜色不再加深
c.气体平均相对分子质量不变
d.生成1 mol I2的同时生成2 mol HI
(1)某同学在实验室模拟NH3吸收NO2的实验设计如图(部分夹持装置省略)。
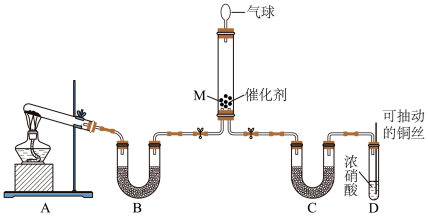
②装置D中发生反应的化学方程式是
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为
(2)工业生产中利用氨水吸收SO2和NO2,原理如下:
(3)碘、水吸收SO2的具体流程如图所示。已知:HI为无色易挥发气体,碘蒸汽为深紫色。
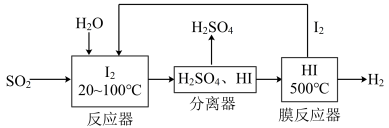
②分离器中将H2SO4和HI分离的方法是
③膜反应器中发生可逆反应:
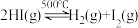 ,若膜反应器体积固定,下列状态能说明反应达到最大限度的是
,若膜反应器体积固定,下列状态能说明反应达到最大限度的是a.膜反应器中HI、H2、I2的物质的量之比为2:1:1
b.膜反应器中气体颜色不再加深
c.气体平均相对分子质量不变
d.生成1 mol I2的同时生成2 mol HI
您最近一年使用:0次
6 . 工业上用二氧化硫制硫酸和大气中二氧化硫转化成硫酸型酸雨的流程如下图所示。
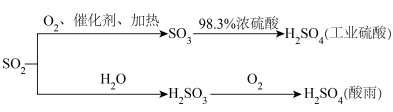
A.工业上直接氧化 是因为 是因为 比 比 更容易被 更容易被 氧化 氧化 |
B.实际生产中,用 吸收 吸收 比用98.3%浓硫酸吸收 比用98.3%浓硫酸吸收 的产率更高 的产率更高 |
C.燃煤脱硫不仅可以减少 的排放,还有助于实现“碳达峰”战略目标 的排放,还有助于实现“碳达峰”战略目标 |
D. 与 与 在催化剂、加热的条件下充分反应生成 在催化剂、加热的条件下充分反应生成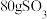 ,转移2mol电子 ,转移2mol电子 |
您最近一年使用:0次
解题方法
7 . 下列根据实验操作及现象不能达到相应实验目的的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 向滴有几滴 的 的 溶液中加入 溶液中加入 ,缓缓通入少量 ,缓缓通入少量 并振荡、静置,水层显红色,有机层显无色 并振荡、静置,水层显红色,有机层显无色 | 验证还原性: |
| B | 相同温度下,同时进行 与 与 和 和 的反应,观察产生 的反应,观察产生 的快慢 的快慢 | 探究 键的极性对反应速率的影响 键的极性对反应速率的影响 |
| C | 将胆矾晶体投入浓硫酸中,固体由蓝色变为白色 | 验证浓硫酸具有脱水性 |
| D | 分别测定 和 和 与盐酸反应的反应热 与盐酸反应的反应热 | 确定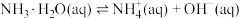 的 的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 氮氧化物(NOx)是大气污染物之一,处理工业废气中的NOx对于环境保护具有重要的意义。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。___________ ;装置B内的试剂是___________ 。
②装置D中发生反应的离子方程式是___________
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为___________ 。
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知吸收过程发生的反应有2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O。
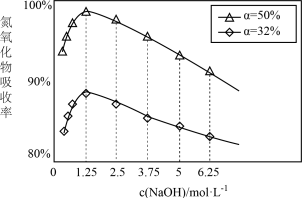
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图(α表示NOx中NO2的含量):___________ ,c(NaOH)=___________ 。
②若一定体积的NOx被250 mL 2 mol ·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8 g,则x的值为___________ 。
(1)在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
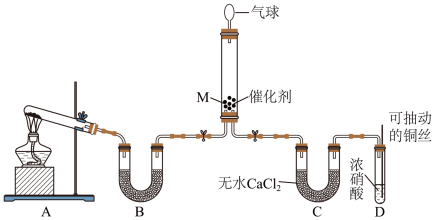
②装置D中发生反应的离子方程式是
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为
(2)用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知吸收过程发生的反应有2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O。
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图(α表示NOx中NO2的含量):
②若一定体积的NOx被250 mL 2 mol ·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8 g,则x的值为
您最近一年使用:0次
2024-06-19更新
|
82次组卷
|
3卷引用:山西省朔州市怀仁市大地学校高中部2023-2024学年高一下学期7月期末化学试题
真题
名校
9 . 家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
A.用过氧碳酸钠漂白衣物: 具有较强氧化性 具有较强氧化性 |
| B.酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发 |
| C.用柠檬酸去除水垢:柠檬酸酸性强于碳酸 |
| D.用碱液清洗厨房油污:油脂可碱性水解 |
您最近一年使用:0次
2024-06-12更新
|
6377次组卷
|
11卷引用:山西大学附属中学校2024~2025学年高三上学期8月第二次诊断考试化学试题
山西大学附属中学校2024~2025学年高三上学期8月第二次诊断考试化学试题2024年吉林省高考化学试题2024年黑龙江省高考化学试卷2024年辽宁省高考化学试卷(已下线)2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)(已下线)01化学物质及其变化(已下线)04氧化还原反应(已下线)选择题1-5安徽省安庆一中2023-2024学年下学期高一年级期末考试化学试卷河南省南阳市内乡县实验高级中学2024-2025学年高三上学期学习效果检测化学试题江西省南昌市聚仁高级中学2024-2025学年高三上学期七月月考化学试题
10 .  是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是
是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 和
和 发生反应;
发生反应; 元素转化为
元素转化为 、
、 、
、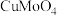 ;
;
②“氨浸”时, 元素以
元素以 的形式进入滤液1中,而
的形式进入滤液1中,而 元素进入滤渣1中;
元素进入滤渣1中;
③ 。
。
回答下列问题:
(1)尾气的成分有 和
和_______ (填化学式)。
(2)“滤渣1”的主要成分是 和
和_______ (填化学式)。
(3)写出“除杂”时反应的离子方程式_______ 。除杂后测得溶液中 ,列式计算并判断
,列式计算并判断 是否沉淀完全
是否沉淀完全_______ 。
(4)“酸沉”时加入 的作用是
的作用是_______ 。
(5)写出四钼酸铵[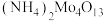 ]发生“焙解”的化学方程式
]发生“焙解”的化学方程式_______ 。
(6) 的结构和
的结构和 相似,如图
相似,如图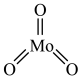 ,易升华,则
,易升华,则 晶体类型为
晶体类型为_______ 。 晶体有多种晶胞,正交相
晶体有多种晶胞,正交相 具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相
具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相 晶体在日常生活中可用作
晶体在日常生活中可用作_______ 。
(7)工业上还可以在碱性环境下用 溶液和
溶液和 反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式
反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式_______ 。
 是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是
是生产含钼催化剂的重要原料,能溶于氨水和强碱。以钼精矿(主要成分是 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图所示:
的工艺流程如图所示: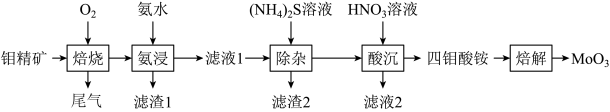
 和
和 发生反应;
发生反应; 元素转化为
元素转化为 、
、 、
、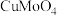 ;
;②“氨浸”时,
 元素以
元素以 的形式进入滤液1中,而
的形式进入滤液1中,而 元素进入滤渣1中;
元素进入滤渣1中;③
 。
。回答下列问题:
(1)尾气的成分有
 和
和(2)“滤渣1”的主要成分是
 和
和(3)写出“除杂”时反应的离子方程式
 ,列式计算并判断
,列式计算并判断 是否沉淀完全
是否沉淀完全(4)“酸沉”时加入
 的作用是
的作用是(5)写出四钼酸铵[
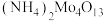 ]发生“焙解”的化学方程式
]发生“焙解”的化学方程式(6)
 的结构和
的结构和 相似,如图
相似,如图 ,易升华,则
,易升华,则 晶体类型为
晶体类型为 晶体有多种晶胞,正交相
晶体有多种晶胞,正交相 具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相
具有独特的层状结构,层与层之间的作用力为范德华力,根据结构和作用力预测正交相 晶体在日常生活中可用作
晶体在日常生活中可用作(7)工业上还可以在碱性环境下用
 溶液和
溶液和 反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式
反应制备钼酸盐,同时生成副产品硫酸盐,写出该反应的离子方程式
您最近一年使用:0次



