解题方法
1 . 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂。
(1)K2FeO4可以去除水中的重金属,主要依靠其在水中分解后产生的Fe(OH)3胶体沉淀的吸附和共沉作用。可通过___________ 鉴别Fe(OH)3胶体和K2FeO4溶液。
(2)在碱性条件下,KClO饱和溶液可将Fe(NO3)3转化为K2FeO4,K2FeO4中Fe的化合价为___________ 价,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(3)K2FeO4可利用Na2FeO4制得。干法制备Na2FeO4的主要反应为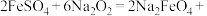
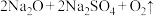 。该反应中氧化产物为
。该反应中氧化产物为___________ (填化学式),每生成1molO2,反应中转移的电子数为___________  。
。
(4)实验室需要使用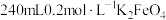 溶液。
溶液。
①配制K2FeO4溶液的过程中需要使用的玻璃仪器有烧杯、量筒、胶头滴管、___________ 和___________ 。
②用托盘天平称量___________ gK2FeO4固体。
③定容时,俯视刻度线将导致配得的溶液浓度___________ (填“偏低”“偏高”或“无影响”)。
(1)K2FeO4可以去除水中的重金属,主要依靠其在水中分解后产生的Fe(OH)3胶体沉淀的吸附和共沉作用。可通过
(2)在碱性条件下,KClO饱和溶液可将Fe(NO3)3转化为K2FeO4,K2FeO4中Fe的化合价为
(3)K2FeO4可利用Na2FeO4制得。干法制备Na2FeO4的主要反应为
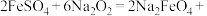
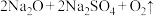 。该反应中氧化产物为
。该反应中氧化产物为 。
。(4)实验室需要使用
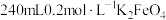 溶液。
溶液。①配制K2FeO4溶液的过程中需要使用的玻璃仪器有烧杯、量筒、胶头滴管、
②用托盘天平称量
③定容时,俯视刻度线将导致配得的溶液浓度
您最近一年使用:0次
2 . 某冶炼厂电解精炼铜产生的阳极泥经分铜、分金后得到的分银渣中仍含有Pb、Sn、Bi、Sb和极少量的Au、Ag等多种富有经济价值的稀贵金属,这些元素多以氧化物形式存在。选择“NaOH、NaNO3熔融盐法”对分银渣加以利用,回收Sn、Pb元素的部分工艺流程如下:

已知:①PbO、SnO2具有两性的性质。
②“滤液①”的主要成分有Na2PbO2、Na2SnO3。
回答下列问题:
(1)将分银渣“球磨”的目的是___________ 。
(2)“步骤③”的名称是___________ ,滤渣①所含金属元素主要是___________ 。
(3)写出Sn在“熔炼”时反应的化学方程式:___________ 。
(4)向“含铅溶液”加入Na2S可生成PbS,写出该反应的离子方程式:___________ ,经处理得到的可以循环利用的物质是___________ (填化学式)。
(5)锡酸钙(CaSnO3)具有介电性质,晶体呈钙钛矿结构,锡酸钙贮锂材料有着高能量密度、无污染、资源丰富及价格便宜等优点,是极具发展潜力的一种负极材料。如图为CaSnO3晶胞,每个氧离子周围与它最近且距离相等的氧离子有___________ 个。若晶胞参数为anm,则晶体密度为___________  (设
(设 表示阿伏加德罗常数的值,列出计算式)
表示阿伏加德罗常数的值,列出计算式)


已知:①PbO、SnO2具有两性的性质。
②“滤液①”的主要成分有Na2PbO2、Na2SnO3。
回答下列问题:
(1)将分银渣“球磨”的目的是
(2)“步骤③”的名称是
(3)写出Sn在“熔炼”时反应的化学方程式:
(4)向“含铅溶液”加入Na2S可生成PbS,写出该反应的离子方程式:
(5)锡酸钙(CaSnO3)具有介电性质,晶体呈钙钛矿结构,锡酸钙贮锂材料有着高能量密度、无污染、资源丰富及价格便宜等优点,是极具发展潜力的一种负极材料。如图为CaSnO3晶胞,每个氧离子周围与它最近且距离相等的氧离子有
 (设
(设 表示阿伏加德罗常数的值,列出计算式)
表示阿伏加德罗常数的值,列出计算式)
您最近一年使用:0次
2024-01-02更新
|
134次组卷
|
2卷引用:山西省三重教育2023-2024学年高三上学期联考理科综合试题
3 . 化学材料在生产、生活中应用广泛。下列有关说法错误的是
| A.还原铁粉可用作食品包装袋内的脱氧剂 |
B.用 对自来水进行消毒,改善水质 对自来水进行消毒,改善水质 |
| C.维生素C常用作抗氧化剂,说明它具有氧化性 |
| D.“雨后彩虹”“海市蜃楼”既是光学现象,也与胶体的知识有关 |
您最近一年使用:0次
解题方法
4 . 在点滴板①②③三个孔穴中分别滴入3滴新制的氯水,再向②③中分别滴入3滴NaBr溶液、NaI溶液;向④⑤两个孔穴中分别滴入3滴溴水,向⑤中滴入3滴NaI溶液。下列关于该实验的说法正确的是


| A.新制氯水中水的电离程度大于纯水的 |
B.①②③可得出氧化性: |
| C.若用久置的氯水进行上述实验,实验现象与原实验现象完全相同 |
| D.上述实验中可以探究同主族元素性质的递变规律 |
您最近一年使用:0次
2023-12-24更新
|
941次组卷
|
4卷引用:山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷
山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷广东省部分名校2023-2024学年高三上学期联合质量检测化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
5 . 研究氧化还原反应的规律有利于我们趋利避害,更好地促进社会文明的发展。下列应用与氧化还原反应无关的是
 |  |  |  |
| A.月饼包装中放入脱氧剂 | B.熟肉采用真空包装 | C.偏二甲肼作火箭发射的燃料 | D.利用核反应发电 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 下列应用或反应中,没有涉及氧化还原反应的是
| A.利用铝粉和四氧化三铁的反应焊接钢轨 |
| B.氯化铁溶液用于制作铜印刷电路板 |
| C.苹果汁在榨取过程中常加入维生素C以防止其变色 |
| D.复合膨松剂中加入柠檬酸 |
您最近一年使用:0次
名校
7 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,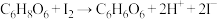 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中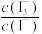 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到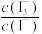 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,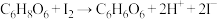 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
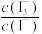 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到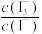 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
106次组卷
|
3卷引用:山西省朔州市怀仁市2023-2024学年高二上学期1月期末化学试题
名校
8 . 填空。
(1)宋代的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理为 ,则
,则 的化学式是
的化学式是______ ,其中 在该反应中
在该反应中________ (填字母)。
A.作氧化剂 B.作还原剂
C.既是氢化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)实现下列反应必须需要加入氧化剂的是_________ ,需要加入还原剂的是_________ ,
A. B.
B. C.
C.
D. E.
E. F.
F.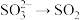
G. H.
H.
(3)氢化钠( )广泛应用于工业生产,回答下列问题。
)广泛应用于工业生产,回答下列问题。
①氢化钠( )中氢元素的化合价为
)中氢元素的化合价为___________ 。
② 能与水剧烈反应:
能与水剧烈反应: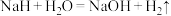 ,该反应中的氧化剂是
,该反应中的氧化剂是___________ ,氧化剂与还原剂的量之比是___________ 。
③在高温下氢化钠( )可将四氯化钛(
)可将四氯化钛( )还原成金属钛,该反应的化学方程式为
)还原成金属钛,该反应的化学方程式为________ 。
(4)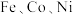 能与
能与 反应,其中
反应,其中 和
和 均生成二氯化物,由此推断
均生成二氯化物,由此推断 和
和 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为________ , 与盐酸反应有
与盐酸反应有 气体生成,写出反应的离子方程式:
气体生成,写出反应的离子方程式:___________ 。
(5)在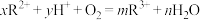 的离子方程式中,对系数
的离子方程式中,对系数 和
和 、
、 判断正确的是___________(填字母)。
判断正确的是___________(填字母)。
(1)宋代的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理为
 ,则
,则 的化学式是
的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氢化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)实现下列反应必须需要加入氧化剂的是
A.
 B.
B. C.
C.
D.
 E.
E. F.
F.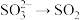
G.
 H.
H.
(3)氢化钠(
 )广泛应用于工业生产,回答下列问题。
)广泛应用于工业生产,回答下列问题。①氢化钠(
 )中氢元素的化合价为
)中氢元素的化合价为②
 能与水剧烈反应:
能与水剧烈反应: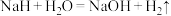 ,该反应中的氧化剂是
,该反应中的氧化剂是③在高温下氢化钠(
 )可将四氯化钛(
)可将四氯化钛( )还原成金属钛,该反应的化学方程式为
)还原成金属钛,该反应的化学方程式为(4)
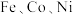 能与
能与 反应,其中
反应,其中 和
和 均生成二氯化物,由此推断
均生成二氯化物,由此推断 和
和 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为 与盐酸反应有
与盐酸反应有 气体生成,写出反应的离子方程式:
气体生成,写出反应的离子方程式:(5)在
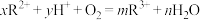 的离子方程式中,对系数
的离子方程式中,对系数 和
和 、
、 判断正确的是___________(填字母)。
判断正确的是___________(填字母)。A. , , 是还原剂 是还原剂 | B.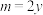 , , 被氧化 被氧化 |
C. , , 是氧化剂 是氧化剂 | D. , , 是还原剂 是还原剂 |
您最近一年使用:0次
名校
9 . 氯化亚铜难溶于水,溶于浓盐酸和氨水,不溶于乙醇,在潮湿的空气中易被氧化。某兴趣小组模拟工业用SO2还原Na2[CuCl4]溶液制备CuCl的装置如图所示。回答下列问题:
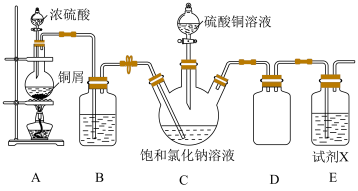
(1)装置A中盛放铜屑的仪器名称是___________ ;写出装置A中发生反应的化学反应方程式:___________ 。
(2)装置D的作用是___________ ;将硫酸铜溶液滴入饱和氯化钠溶液中会形成Na2[CuCl4],其中[CuCl4]2-的配位键中提供孤电子对的是___________ (填化学符号);装置C中SO2与[CuCl4]2-反应的离子方程式为___________ 。
(3)高温条件下,亚铜离子比铜离子稳定,原因是___________ ;CuSO4在高温条件下发生分解反应生成的砖红色固体为___________ (填化学式)。

(1)装置A中盛放铜屑的仪器名称是
(2)装置D的作用是
(3)高温条件下,亚铜离子比铜离子稳定,原因是
您最近一年使用:0次
名校
10 . 氯气( )是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:
)是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:
Ⅰ.实验室制备84消毒液.

(1)装置甲中盛放高锰酸钾的仪器名称是______ ,装置甲中反应的离子方程式为______ .
(2)装置乙的作用是______ .
(3)装置丙中制备次氯酸钠为放热反应,该反应需要控制温度在40℃以下,写出一种(除搅拌外)控制该反应温度的操作方法______ .
Ⅱ.氯气的应用
(4)可用 和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是
和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是______ .(填化学式)
(5)向KI溶液滴加过量氯水会生成 ,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:
,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:_________

(6) 是次氯酸的酸酐,其制备方法之一是将
是次氯酸的酸酐,其制备方法之一是将 通入HgO中即可制得,同时生成
通入HgO中即可制得,同时生成 .请写出对应的化学方程式并用双线桥表示电子的转移:
.请写出对应的化学方程式并用双线桥表示电子的转移:______ .
 )是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:
)是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:Ⅰ.实验室制备84消毒液.

(1)装置甲中盛放高锰酸钾的仪器名称是
(2)装置乙的作用是
(3)装置丙中制备次氯酸钠为放热反应,该反应需要控制温度在40℃以下,写出一种(除搅拌外)控制该反应温度的操作方法
Ⅱ.氯气的应用
(4)可用
 和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是
和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是(5)向KI溶液滴加过量氯水会生成
 ,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:
,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:
(6)
 是次氯酸的酸酐,其制备方法之一是将
是次氯酸的酸酐,其制备方法之一是将 通入HgO中即可制得,同时生成
通入HgO中即可制得,同时生成 .请写出对应的化学方程式并用双线桥表示电子的转移:
.请写出对应的化学方程式并用双线桥表示电子的转移:
您最近一年使用:0次
2023-12-04更新
|
79次组卷
|
3卷引用:山西运城盐湖五中2023-2024学年高一上学期期末练兵卷(一)化学试题



