2024高三·全国·专题练习
1 . 闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物铜包钢的有效分离,同时得到的 可用于催化、医药、冶金等重要领域。工艺流程如下:
可用于催化、医药、冶金等重要领域。工艺流程如下: 。
。
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为_______ (填化学式)。
(2)滤渣的主要成分为_______ (填化学式)。
(3)浸取工序的产物为 ,该工序发生反应的化学方程式为
,该工序发生反应的化学方程式为_______ 。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反应的离子方程式为_______ 。
(4)浸取工序宜在 之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是
之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是_______ 。
(5)补全中和工序中主反应的离子方程式
_______ +_______ 。
(6)真空干燥的目的为_______ 。
 可用于催化、医药、冶金等重要领域。工艺流程如下:
可用于催化、医药、冶金等重要领域。工艺流程如下: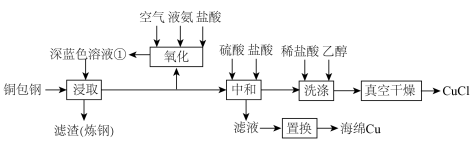
 。
。回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为
(2)滤渣的主要成分为
(3)浸取工序的产物为
 ,该工序发生反应的化学方程式为
,该工序发生反应的化学方程式为(4)浸取工序宜在
 之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是
之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是(5)补全中和工序中主反应的离子方程式

(6)真空干燥的目的为
您最近一年使用:0次
2023-11-29更新
|
4037次组卷
|
4卷引用:北京市首都师范大学附属中学2023-2024学年高三下学期开学练习化学试题
北京市首都师范大学附属中学2023-2024学年高三下学期开学练习化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2023年河北省高考化学试卷(已下线)T16-工业流程题
名校
解题方法
2 . Ⅰ.写出下列反应的离子方程式:
(1)磁性氧化铁溶于稀盐酸:___________ 。
(2)用硫氰酸钾溶液检验待测液中的
___________ 。
(3)用酸性高锰酸钾溶液检验待测液中的
___________ 。
Ⅱ.根据信息配平下列反应的离子方程式
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。请根据题中信息配平该反应的离子方程式:
无色)。请根据题中信息配平该反应的离子方程式:___________
___________ ___________
___________ ___________=___________
___________=___________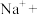 ___________
___________ ___________
___________ ___________
___________
(5) 虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。完成
高效,且腐蚀性小。完成 氧化
氧化 的离子方程式:
的离子方程式:___________
___________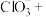 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
(1)磁性氧化铁溶于稀盐酸:
(2)用硫氰酸钾溶液检验待测液中的

(3)用酸性高锰酸钾溶液检验待测液中的

Ⅱ.根据信息配平下列反应的离子方程式
(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。请根据题中信息配平该反应的离子方程式:
无色)。请根据题中信息配平该反应的离子方程式:___________
 ___________
___________ ___________=___________
___________=___________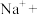 ___________
___________ ___________
___________ ___________
___________(5)
 虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。完成
高效,且腐蚀性小。完成 氧化
氧化 的离子方程式:
的离子方程式:___________
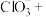 ___________
___________ ___________=___________
___________=___________ ___________
___________ ___________
___________
您最近一年使用:0次
解题方法
3 . 以钛铁矿(主要含 钛元素化合价为+4)为原料制备铵铁蓝
钛元素化合价为+4)为原料制备铵铁蓝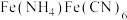 的一种流程示意图如下。
的一种流程示意图如下。
已知:钛铁铁矿遇酸以 形式存在于溶液中,且易水解为
形式存在于溶液中,且易水解为

(1)钛铁矿粉碎的目的是___________ 。
(2)请结合化学用语解释向酸浸液中加入“生铁”的目的是___________ 。
(3)滤渣中的主要成分是___________ 。
(4)在“沉铁”步骤产生的白色沉淀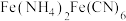 ,
,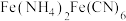 中Fe的化合价是
中Fe的化合价是___________ 。
(5)流程中 的作用是
的作用是___________ ,该步发生反应的离子方程式是___________ 。
(6)铵铁蓝溶液的颜色受铵铁蓝溶液中游离 时的质量分数影响,
时的质量分数影响, 的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中
的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中 的质量分数受条件影响如下图所示:
的质量分数受条件影响如下图所示:

 浓度对
浓度对 质量分数的影响
质量分数的影响

“沉铁”步骤中混合溶液pH对 质量分数的影响
质量分数的影响
要得到颜色鲜艳的铵铁蓝还需控制的条件是___________ 。
 钛元素化合价为+4)为原料制备铵铁蓝
钛元素化合价为+4)为原料制备铵铁蓝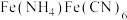 的一种流程示意图如下。
的一种流程示意图如下。已知:钛铁铁矿遇酸以
 形式存在于溶液中,且易水解为
形式存在于溶液中,且易水解为

(1)钛铁矿粉碎的目的是
(2)请结合化学用语解释向酸浸液中加入“生铁”的目的是
(3)滤渣中的主要成分是
(4)在“沉铁”步骤产生的白色沉淀
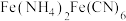 ,
,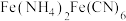 中Fe的化合价是
中Fe的化合价是(5)流程中
 的作用是
的作用是(6)铵铁蓝溶液的颜色受铵铁蓝溶液中游离
 时的质量分数影响,
时的质量分数影响, 的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中
的质量分数越高,铵铁蓝的颜色越鲜艳,铵铁蓝制备中 的质量分数受条件影响如下图所示:
的质量分数受条件影响如下图所示:
 浓度对
浓度对 质量分数的影响
质量分数的影响
“沉铁”步骤中混合溶液pH对
 质量分数的影响
质量分数的影响要得到颜色鲜艳的铵铁蓝还需控制的条件是
您最近一年使用:0次
4 . 完成下列问题。
(1)将 通入0.5mol/L
通入0.5mol/L 溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出
溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出 与
与 反应的离子方程式
反应的离子方程式___________ 。
(2)NSR( 的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中
的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中 的排放,其工作原理如下图。
的排放,其工作原理如下图。

储存阶段中Ba存储 后转化为
后转化为 的化学方程式是
的化学方程式是___________ 。
(3) 的吸收与利用:
的吸收与利用:
利用太阳能,以 为原料制取炭黑的流程如下图所示。过程2的化学方程式是
为原料制取炭黑的流程如下图所示。过程2的化学方程式是___________ 。

(4)已知: 的还原产物是
的还原产物是
 酸性溶液与
酸性溶液与 反应的离子方程式是
反应的离子方程式是___________ 。
(5)以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下

“沉淀”过程中产生CuCl的离子方程式是___________ 。
(1)将
 通入0.5mol/L
通入0.5mol/L 溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出
溶液中,一段时间后,试管中液面与空气接触部分出现红棕色气体。写出 与
与 反应的离子方程式
反应的离子方程式(2)NSR(
 的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中
的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中 的排放,其工作原理如下图。
的排放,其工作原理如下图。
储存阶段中Ba存储
 后转化为
后转化为 的化学方程式是
的化学方程式是(3)
 的吸收与利用:
的吸收与利用:利用太阳能,以
 为原料制取炭黑的流程如下图所示。过程2的化学方程式是
为原料制取炭黑的流程如下图所示。过程2的化学方程式是
(4)已知:
 的还原产物是
的还原产物是
 酸性溶液与
酸性溶液与 反应的离子方程式是
反应的离子方程式是(5)以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下

“沉淀”过程中产生CuCl的离子方程式是
您最近一年使用:0次
解题方法
5 . 研究人员对Na2SO3和Fe粉去除废水中的硝态氮进行研究。
已知:i.某工厂排放的含氮废水中总氮=10mg·L-1,含有硝态氮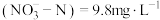 、氨氮
、氨氮 。
。
ii.本实验中Na2SO3在 时,脱除硝态氮(转化为N2)效果较强。
时,脱除硝态氮(转化为N2)效果较强。
iii.Na2SO3和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
(1)Na2SO3和Fe粉在去除废水中硝态氮的过程中表现___________ 性(填“氧化”或“还原”)。
(2)研究Na2SO3在pH=1的含氮废水中发生反应的情况,实验结果如图1。
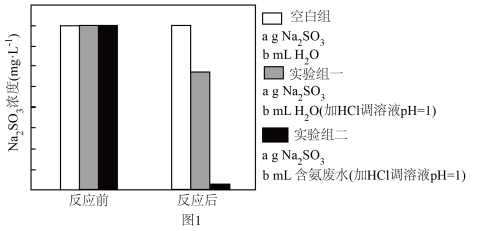
①根据图1,写出“实验组一”中发生反应的离子方程式___________ 。
②进行“实验组二”实验时发现,降低溶液pH更有利于 的去除,可能的原因是
的去除,可能的原因是___________ 。
(3)脱除pH=1的含氮废水中硝态氮,单独加入Na2SO3或同时加入Na2SO3与Fe粉的实验结果如图2和图3。
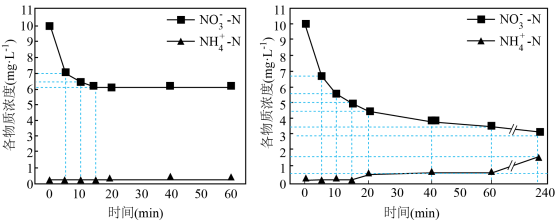
①根据图2,前15min内Na2SO3,脱除NO;主要反应的离子方程式为___________ 。
②根据图2和图3,20~60min内体系中生成 主要反应的离子方程式为
主要反应的离子方程式为___________ 。
③检验处理后的废水中存在 取一定量废水蒸发浓缩,
取一定量废水蒸发浓缩,___________ (补充操作和现象)。
已知:i.某工厂排放的含氮废水中总氮=10mg·L-1,含有硝态氮
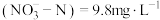 、氨氮
、氨氮 。
。ii.本实验中Na2SO3在
 时,脱除硝态氮(转化为N2)效果较强。
时,脱除硝态氮(转化为N2)效果较强。iii.Na2SO3和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
(1)Na2SO3和Fe粉在去除废水中硝态氮的过程中表现
(2)研究Na2SO3在pH=1的含氮废水中发生反应的情况,实验结果如图1。

①根据图1,写出“实验组一”中发生反应的离子方程式
②进行“实验组二”实验时发现,降低溶液pH更有利于
 的去除,可能的原因是
的去除,可能的原因是(3)脱除pH=1的含氮废水中硝态氮,单独加入Na2SO3或同时加入Na2SO3与Fe粉的实验结果如图2和图3。

①根据图2,前15min内Na2SO3,脱除NO;主要反应的离子方程式为
②根据图2和图3,20~60min内体系中生成
 主要反应的离子方程式为
主要反应的离子方程式为③检验处理后的废水中存在
 取一定量废水蒸发浓缩,
取一定量废水蒸发浓缩,
您最近一年使用:0次
2023-11-15更新
|
214次组卷
|
3卷引用:北京市朝阳区2023-2024学年高三上学期期中考试化学试题
6 . 过氧化钙常温常压下为固体,微溶于水,过氧化钙不通过金属钙来制备。一种制备过氧化钙的方法是在10℃左右向一定量的氧化钙滴加适量过氧化氢溶液,生成 固体。将
固体。将 固体过滤后干燥,得到无水过氧化钙,回答下列问题:
固体过滤后干燥,得到无水过氧化钙,回答下列问题:
(1)氧化钙属于___________ (填“酸性”或“碱性”)氧化物;写出题干中描述的由氧化钙制备 的化学方程式:
的化学方程式:___________ 。
(2)用题干中描述的方法制备的过氧化钙通常不纯且氧化钙和过氧化氢难以完全反应,可能的原因是___________ ;为了检测所制备过氧化钙的纯度,一种常用的方法是将已知质量的待测样品与已知质量的 在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与
在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与 的反应中,过氧化钙是
的反应中,过氧化钙是___________ (填“氧化剂”或“还原剂”);
(3)取少量过氧化钙固体于试管中,加热试管,用带火星的木条深入试管口,发现___________ ,说明反应生成一种无色气体;在火力发电厂的烟道气中,二氧化碳约占碳排放总量的40%,因此提高烟道气中二氧化碳的捕集效率十分必要,若在加热条件下以过氧化钙为二氧化碳吸附剂,则吸附过程中发生反应的化学方程式是___________ 。
 固体。将
固体。将 固体过滤后干燥,得到无水过氧化钙,回答下列问题:
固体过滤后干燥,得到无水过氧化钙,回答下列问题:(1)氧化钙属于
 的化学方程式:
的化学方程式:(2)用题干中描述的方法制备的过氧化钙通常不纯且氧化钙和过氧化氢难以完全反应,可能的原因是
 在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与
在酸性溶液中完全反应,计算出待测样品所含过氧化钙的质量,在过氧化钙与 的反应中,过氧化钙是
的反应中,过氧化钙是(3)取少量过氧化钙固体于试管中,加热试管,用带火星的木条深入试管口,发现
您最近一年使用:0次
名校
7 .  是一种重要的化学品,具有广泛的应用
是一种重要的化学品,具有广泛的应用
(1) 的性质研究。
的性质研究。
①理论分析: 具有氧化性和还原性,从O元素的化合价分析原因:
具有氧化性和还原性,从O元素的化合价分析原因:_______ 。
②实验研究:向酸化的 溶液中加入
溶液中加入 溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(
溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊( ),继续加入
),继续加入 溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法
溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法不正确 的是_______ (填序号)。
A. 是
是 分解反应的催化剂
分解反应的催化剂
B. 既表现氧化性又表现还原性
既表现氧化性又表现还原性
C. 将
将 还原为
还原为
D.发生了反应
(2) 的制备。某种制取过氧化氢的方法如下:
的制备。某种制取过氧化氢的方法如下:
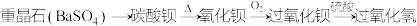
①用氧化钡制取过氧化钡(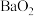 )的反应属于
)的反应属于_______ 反应(填序号)。
A.化合 B.分解 C.氧化还原 D.复分解
②用过氧化钡制取过氧化氢的离子方程式是_______ 。
③上述方法制得的过氧化氢浓度低且能耗高。有人提出下列制取过氧化氢的方案,从原理上分析合理的是_______ (填序号)。
A.在一定条件下,使用适宜的氧化剂氧化
B.在一定条件下, 还原
还原
C.在一定条件下, 氧化
氧化
(3) 的定量检测。用酸性
的定量检测。用酸性 测定
测定 的含量,反应原理如下(该条件下可忽略
的含量,反应原理如下(该条件下可忽略 的分解)。补充完整该离子方程式并配平
的分解)。补充完整该离子方程式并配平__________ 。
□ □
□ ___
___ □
□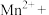 □_____
□_____
 是一种重要的化学品,具有广泛的应用
是一种重要的化学品,具有广泛的应用(1)
 的性质研究。
的性质研究。①理论分析:
 具有氧化性和还原性,从O元素的化合价分析原因:
具有氧化性和还原性,从O元素的化合价分析原因:②实验研究:向酸化的
 溶液中加入
溶液中加入 溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(
溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊( ),继续加入
),继续加入 溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法
溶液,红色浑浊又变为蓝色溶液,这个过程可以反复多次。下列关于上述过程的说法A.
 是
是 分解反应的催化剂
分解反应的催化剂B.
 既表现氧化性又表现还原性
既表现氧化性又表现还原性C.
 将
将 还原为
还原为
D.发生了反应

(2)
 的制备。某种制取过氧化氢的方法如下:
的制备。某种制取过氧化氢的方法如下:
①用氧化钡制取过氧化钡(
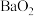 )的反应属于
)的反应属于A.化合 B.分解 C.氧化还原 D.复分解
②用过氧化钡制取过氧化氢的离子方程式是
③上述方法制得的过氧化氢浓度低且能耗高。有人提出下列制取过氧化氢的方案,从原理上分析合理的是
A.在一定条件下,使用适宜的氧化剂氧化

B.在一定条件下,
 还原
还原
C.在一定条件下,
 氧化
氧化
(3)
 的定量检测。用酸性
的定量检测。用酸性 测定
测定 的含量,反应原理如下(该条件下可忽略
的含量,反应原理如下(该条件下可忽略 的分解)。补充完整该离子方程式并配平
的分解)。补充完整该离子方程式并配平□
 □
□ ___
___ □
□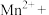 □_____
□_____
您最近一年使用:0次
名校
解题方法
8 . 钒(V)被称为钢铁行业的“维生素”。从某钒矿石焙砂中提取钒的主要流程如下:

已知:
i.滤液A中的阳离子主要有H+、VO 、Fe3+、Al3+等;
、Fe3+、Al3+等;
ii.“萃取”过程可表示为VO2++2HA(有机相) VOA2(有机相)+2H+。
VOA2(有机相)+2H+。
(1)“浸钒”时,为加快浸出速率可采取的措施有___________ (写出1条即可)。
(2)“浸钒”过程中,焙砂中的V2O5与硫酸反应的离子方程式为___________ 。
(3)“还原”过程中,铁粉发生的反应有Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+和如下反应,补全该反应的离子方程式__________ 。
 VO
VO +
+ Fe+
Fe+ ___________=
___________= VO2++
VO2++ Fe2++
Fe2++ ___________
___________
(4)“萃取”前,若不用石灰乳先中和,萃取效果不好,原因是___________ 。
(5)写出“煅烧”过程发生反应的化学方程式___________ 。
(6)用以下方法测量“浸钒”过程中钒的浸出率。从滤液A中取出1mL,用蒸馏水稀释至
10mL,加入适量过硫酸铵,加热,将滤液A中可能存在的VO2+氧化为VO ,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO
,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO 滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
已知:a.所取钒矿石焙砂中钒元素的质量为ag;所得滤液A的总体积为bmL;
b.3滴指示剂消耗v2mL(NH4)2Fe(SO4)2溶液。
①用上述方法测得“浸钒”过程中钒的浸出率为___________ 。
②若不除去过量的过硫酸铵,钒浸出率的测定结果将___________ (填“偏高”“不变”或“偏低”)。

已知:
i.滤液A中的阳离子主要有H+、VO
 、Fe3+、Al3+等;
、Fe3+、Al3+等;ii.“萃取”过程可表示为VO2++2HA(有机相)
 VOA2(有机相)+2H+。
VOA2(有机相)+2H+。(1)“浸钒”时,为加快浸出速率可采取的措施有
(2)“浸钒”过程中,焙砂中的V2O5与硫酸反应的离子方程式为
(3)“还原”过程中,铁粉发生的反应有Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+和如下反应,补全该反应的离子方程式
 VO
VO +
+ Fe+
Fe+ ___________=
___________= VO2++
VO2++ Fe2++
Fe2++ ___________
___________(4)“萃取”前,若不用石灰乳先中和,萃取效果不好,原因是
(5)写出“煅烧”过程发生反应的化学方程式
(6)用以下方法测量“浸钒”过程中钒的浸出率。从滤液A中取出1mL,用蒸馏水稀释至
10mL,加入适量过硫酸铵,加热,将滤液A中可能存在的VO2+氧化为VO
 ,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO
,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液将VO 滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。已知:a.所取钒矿石焙砂中钒元素的质量为ag;所得滤液A的总体积为bmL;
b.3滴指示剂消耗v2mL(NH4)2Fe(SO4)2溶液。
①用上述方法测得“浸钒”过程中钒的浸出率为
②若不除去过量的过硫酸铵,钒浸出率的测定结果将
您最近一年使用:0次
2023-11-06更新
|
347次组卷
|
4卷引用:北京市丰台区2023-2024学年高三上学期期中练习化学试题
9 . 通过 捕获和转化技术可实现
捕获和转化技术可实现 资源化利用,其物质转化关系如图所示,下列说法
资源化利用,其物质转化关系如图所示,下列说法不正确 的是
 捕获和转化技术可实现
捕获和转化技术可实现 资源化利用,其物质转化关系如图所示,下列说法
资源化利用,其物质转化关系如图所示,下列说法
A. 的捕获和转化有助于减弱温室效应 的捕获和转化有助于减弱温室效应 |
| B.过程I属于化合反应 |
C.捕获和转化 的过程中,CaO可以循环利用 的过程中,CaO可以循环利用 |
D.过程Ⅱ中的反应为 |
您最近一年使用:0次
2023-11-04更新
|
264次组卷
|
2卷引用:北京中国人民大学附属中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
10 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
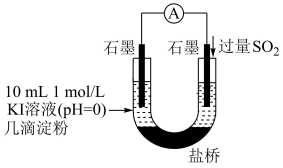
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次



