名校
解题方法
1 . 某小组探究Cu与 的反应,进行如下实验。
的反应,进行如下实验。
已知: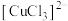 (无色)
(无色) (白色)
(白色)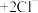
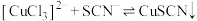 (白色)
(白色)
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是_______ 。
(2)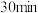 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ_______ Ⅱ(填“>”“<”或“=”)。
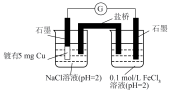
(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
经检验,白色沉淀为 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。
① 溶液的浓度是
溶液的浓度是_______ 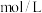 。
。
②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为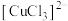 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
③由ⅲ、ⅳ可知,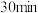 后主要反应的离子方程式是
后主要反应的离子方程式是_______ 。
(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ, 在Cu与
在Cu与 反应中的作用是
反应中的作用是_______ 。
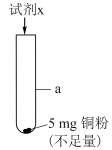
(5)研究 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。
a中加入的试剂x为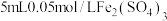 和
和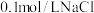 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是_______ 。
 的反应,进行如下实验。
的反应,进行如下实验。已知:
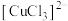 (无色)
(无色) (白色)
(白色)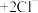
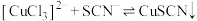 (白色)
(白色)
| 序号 | 试剂x | 实验现象 |
| Ⅰ | 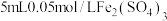 溶液 溶液 | 溶液变为浅蓝色,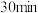 时,铜粉有较多剩余 时,铜粉有较多剩余 | |
| Ⅱ | 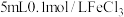 溶液 溶液 | 溶液变为蓝色,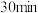 时,铜粉完全溶解 时,铜粉完全溶解 |
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有
 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是(2)
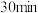 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加
 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
| 序号 | 取样时间/min | 现象 |
| ⅰ | 1 | 产生白色沉淀 | |
| ⅱ | 10 | 产生白色沉淀,较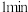 时量多 时量多 | |
| ⅲ | 30 | 产生白色沉淀,较 时量少 时量少 | |
| ⅳ | 40 | 无白色沉淀产生 |
 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。①
 溶液的浓度是
溶液的浓度是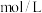 。
。②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为
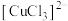 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是③由ⅲ、ⅳ可知,
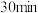 后主要反应的离子方程式是
后主要反应的离子方程式是(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ,
 在Cu与
在Cu与 反应中的作用是
反应中的作用是(5)研究
 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。a中加入的试剂x为
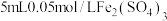 和
和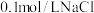 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是
您最近一年使用:0次
2024-01-20更新
|
154次组卷
|
2卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
名校
解题方法
2 . 对烟气高效的脱硫、脱硝是防治空气污染的重要方式。
Ⅰ.尿素液相脱硫脱硝
(1)尿素 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是_______ 。
(2)尿素溶液吸收烟气中的 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是_______ 。
(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是_______ 。
Ⅱ. 气相脱硫脱硝
气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中。NO和 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。

已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:
基元反应1:

基元反应2:
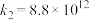
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:
基元反应3:
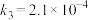
基元反应4:
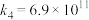
(4) 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是_______ 。
(5)将 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是_______ 。
(6)当体系中有水蒸气时, 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是_______ 。
Ⅰ.尿素液相脱硫脱硝
(1)尿素
 含有的氨基中的N原子可与
含有的氨基中的N原子可与 形成配位键,原因是
形成配位键,原因是(2)尿素溶液吸收烟气中的
 ,生成一种正盐和
,生成一种正盐和 ,反应的化学方程式是
,反应的化学方程式是(3)研究发现,用尿素溶液吸收烟气中的NO时,脱除率很低。若
 与尿素溶液联用,将NO转化为
与尿素溶液联用,将NO转化为 ,可大大提高NO的脱除率。
,可大大提高NO的脱除率。 与
与 溶液反应可生成两种无毒无污染的气体,反应的化学方程式是
溶液反应可生成两种无毒无污染的气体,反应的化学方程式是Ⅱ.
 气相脱硫脱硝
气相脱硫脱硝一定温度下,将模拟烟气通入气相氧化反应器中。NO和
 的初始浓度相同,改变
的初始浓度相同,改变 的浓度,相同时间内,气体的氧化率随
的浓度,相同时间内,气体的氧化率随 与NO或
与NO或 的物质的量浓度之比的变化如图所示。其中①、④分别为NO和
的物质的量浓度之比的变化如图所示。其中①、④分别为NO和 单独通入反应器时NO、
单独通入反应器时NO、 的氧化率,②、③分别为将NO和
的氧化率,②、③分别为将NO和 同时通入反应器时NO、
同时通入反应器时NO、 的氧化率。
的氧化率。
已知:对于确定的基元反应,反应速率(v)与速率常数(k)成正比。
 气相氧化NO的关键基元反应:
气相氧化NO的关键基元反应:基元反应1:


基元反应2:

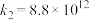
 气相氧化
气相氧化 的关键基元反应:
的关键基元反应:基元反应3:

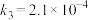
基元反应4:

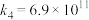
(4)
 单独氧化
单独氧化 时,氧化率很低。原因是
时,氧化率很低。原因是(5)将
 和NO同时通入气相氧化反应器中时,
和NO同时通入气相氧化反应器中时, 和NO的氧化率与将其单独通入反应器中时不同。原因分别是
和NO的氧化率与将其单独通入反应器中时不同。原因分别是(6)当体系中有水蒸气时,
 单独氧化
单独氧化 的氧化率有很大提升。研究表明,此时
的氧化率有很大提升。研究表明,此时 被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸。反应的化学方程式是
您最近一年使用:0次
2024-01-20更新
|
159次组卷
|
2卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
解题方法
3 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  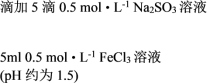 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  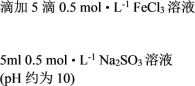 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近一年使用:0次
名校
4 . 二氧化硒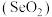 是重要的工业原料:
是重要的工业原料:
(1) 属于
属于______ (填“碱性氧化物”或“酸性氧化物”),利用这类物质的共性,饲料工业领域常用 与碱溶液反应生产亚硒酸钠
与碱溶液反应生产亚硒酸钠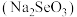 ,该反应的化学方程式为
,该反应的化学方程式为______ 。
(2) 是制备高纯硒的原料,请补全离子方程式:
是制备高纯硒的原料,请补全离子方程式:______ 。
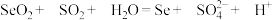
该过程是利用了 的
的______ (填“氧化性”或“还原性”)。
(3)硒元素的最高化合价为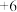 价,预测
价,预测 有还原性,可用下列试剂中的
有还原性,可用下列试剂中的______ 检验(填字母序号)。
A. B.酸性
B.酸性 C.KI D.
C.KI D.
补全该反应的离子方程式:______ 。
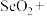 ______
______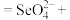 ______。
______。
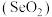 是重要的工业原料:
是重要的工业原料:(1)
 属于
属于 与碱溶液反应生产亚硒酸钠
与碱溶液反应生产亚硒酸钠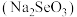 ,该反应的化学方程式为
,该反应的化学方程式为(2)
 是制备高纯硒的原料,请补全离子方程式:
是制备高纯硒的原料,请补全离子方程式: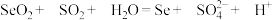
该过程是利用了
 的
的(3)硒元素的最高化合价为
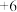 价,预测
价,预测 有还原性,可用下列试剂中的
有还原性,可用下列试剂中的A.
 B.酸性
B.酸性 C.KI D.
C.KI D.
补全该反应的离子方程式:
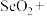 ______
______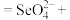 ______。
______。
您最近一年使用:0次
2024-01-18更新
|
160次组卷
|
3卷引用:北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷
名校
5 . 下列说法不正确 的是
| A.氯气泄漏时,应该向上风口和地势较高处转移疏散人群 |
| B.先将自来水日晒一段时间后再注入鱼缸,其目的是促使水中的次氯酸分解 |
| C.金属钠着火时,可用干沙土灭火 |
| D.为防止中秋月饼等富脂食品被氧化,常在包装袋中放入生石灰 |
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组探究KIO3和Na2SO3在酸性条件下的反应,操作过程如下表:
已知:IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
(1)针对实验现象,该小组同学提出以下猜想:
①猜想I:t秒前KIO3被Na2SO3还原生成I2,但由于溶液中存在Na2SO3,I2被消耗。将该反应离子方程式补充完整:___________
I2+SO +H2O=SO
+H2O=SO +□___________+□___________
+□___________+□___________
该条件下还原性:SO
___________ I-(填“>”“=”或“<”)。若猜想成立,向反应后的蓝色溶液中再次加入少量___________ (填试剂),蓝色迅速消失,随后再次变蓝。
②猜想Ⅱ:t秒前KIO3被Na2SO3还原为I-,无I2生成;t秒后,Na2SO3被消耗完,IO 继续与I-反应生成I2,
继续与I-反应生成I2,___________ (填现象)。
(2)该小组同学利用原电池原理进一步探究KIO3和Na2SO3的反应,实验方案如下:
①操作I中IO 在a电极放电时的还原产物是
在a电极放电时的还原产物是___________ 。
②操作Ⅱ中放电一段时间后,a电极附近溶液出现蓝色的原因可能是:
i.___________ (结合化学用语进行分析、解释)。
ii.b极区c(SO )不断减小,还原性减弱。
)不断减小,还原性减弱。
③下列说法正确的是___________ 。
a.a电极附近蓝色不再褪去,表明SO 已完全被氧化
已完全被氧化
b.操作Ⅱ中,溶液变蓝时,电流表读数变小;蓝色消失时,电流表读数又增大
c.反应结束后,向b电极附近再次滴加Na2SO3溶液,a电极附近蓝色无变化
综上所述,KIO3和Na2SO3在酸性条件下反应,IO 先被还原为I-;当Na2SO3完全反应后,IO
先被还原为I-;当Na2SO3完全反应后,IO 与I-继续反应生成I2。
与I-继续反应生成I2。
| 装置 | 操作 | 现象 |
 | 向酸化的KIO3溶液中加入2滴淀粉溶液,再加入少量Na2SO3溶液。 | 开始,无明显现象;t秒后溶液突然变为蓝色。 |
 +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。(1)针对实验现象,该小组同学提出以下猜想:
①猜想I:t秒前KIO3被Na2SO3还原生成I2,但由于溶液中存在Na2SO3,I2被消耗。将该反应离子方程式补充完整:
I2+SO
 +H2O=SO
+H2O=SO +□___________+□___________
+□___________+□___________该条件下还原性:SO

②猜想Ⅱ:t秒前KIO3被Na2SO3还原为I-,无I2生成;t秒后,Na2SO3被消耗完,IO
 继续与I-反应生成I2,
继续与I-反应生成I2,(2)该小组同学利用原电池原理进一步探究KIO3和Na2SO3的反应,实验方案如下:
| 装置 | 操作及现象 |
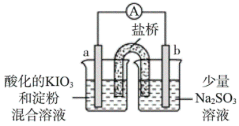 | I.开始放电时,a电极附近溶液一直未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 |
| Ⅱ.放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失重复多次后,蓝色不再褪去。 | |
Ⅲ.放电后,在b电极附近溶液中检测出SO 。 。 |
 在a电极放电时的还原产物是
在a电极放电时的还原产物是②操作Ⅱ中放电一段时间后,a电极附近溶液出现蓝色的原因可能是:
i.
ii.b极区c(SO
 )不断减小,还原性减弱。
)不断减小,还原性减弱。③下列说法正确的是
a.a电极附近蓝色不再褪去,表明SO
 已完全被氧化
已完全被氧化b.操作Ⅱ中,溶液变蓝时,电流表读数变小;蓝色消失时,电流表读数又增大
c.反应结束后,向b电极附近再次滴加Na2SO3溶液,a电极附近蓝色无变化
综上所述,KIO3和Na2SO3在酸性条件下反应,IO
 先被还原为I-;当Na2SO3完全反应后,IO
先被还原为I-;当Na2SO3完全反应后,IO 与I-继续反应生成I2。
与I-继续反应生成I2。
您最近一年使用:0次
名校
解题方法
7 . 氯气是氯碱工业的主要产品之一,是一种常用的消毒刹,其消毒原理是与水反应生成了次氯酸,次氯酸的强氧化性能杀死水中的病菌。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯气与水反应的离子方程式为______________________________ 。
(2)将氯气通入淀粉 溶液中,溶液变蓝,写出反应的离子方程式
溶液中,溶液变蓝,写出反应的离子方程式____________________ ;继续通入氯气,蓝色消失,原因是: ,该反应体现了氯气的
,该反应体现了氯气的__________ 性。
(3)泳池用含氯物质消毒时,需要保证一定量的余氯,若水中的余氯以次氯酸形式存在,再加入 进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与
进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与 发生反应生成盐酸的化学方程式
发生反应生成盐酸的化学方程式____________________ 。
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为_________________________ 。
(5)二氧化氯( )是国际上公认为安全、.无毒的绿色消毒剂。工业上制取
)是国际上公认为安全、.无毒的绿色消毒剂。工业上制取 的化学方程式如下:
的化学方程式如下: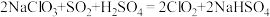 。按要求回答下列问题:
。按要求回答下列问题:
①该反应的离子方程式为____________________ 。
②另一种制备 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 与
与 的物质的量之比为
的物质的量之比为 ,则每生成
,则每生成 ,转移
,转移_________ 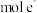 。
。
(1)氯气与水反应的离子方程式为
(2)将氯气通入淀粉
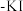 溶液中,溶液变蓝,写出反应的离子方程式
溶液中,溶液变蓝,写出反应的离子方程式 ,该反应体现了氯气的
,该反应体现了氯气的(3)泳池用含氯物质消毒时,需要保证一定量的余氯,若水中的余氯以次氯酸形式存在,再加入
 进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与
进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与 发生反应生成盐酸的化学方程式
发生反应生成盐酸的化学方程式(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
(5)二氧化氯(
 )是国际上公认为安全、.无毒的绿色消毒剂。工业上制取
)是国际上公认为安全、.无毒的绿色消毒剂。工业上制取 的化学方程式如下:
的化学方程式如下: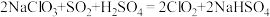 。按要求回答下列问题:
。按要求回答下列问题:①该反应的离子方程式为
②另一种制备
 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 与
与 的物质的量之比为
的物质的量之比为 ,则每生成
,则每生成 ,转移
,转移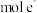 。
。
您最近一年使用:0次
名校
解题方法
8 . K2FeO4是常见的水处理剂,其原理如图所示。下列有关说法不正确 的是
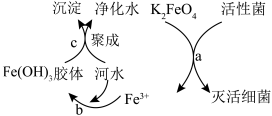

A.过程a中每一个FeO 发生还原反应得到3个电子 发生还原反应得到3个电子 |
| B.过程b发生了氧化还原反应 |
| C.过程c属于物理变化 |
| D.K2FeO4净水既能杀菌消毒又能除去水中的悬浮性颗粒 |
您最近一年使用:0次
名校
9 . 以石英砂(主要成分为: )为原料,经三步反应制得高纯硅,其中第一步反应的化学方程式如下:
)为原料,经三步反应制得高纯硅,其中第一步反应的化学方程式如下: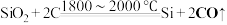 。
。
(1) 中
中 元素的化合价是
元素的化合价是_______ 。
(2)作还原剂的物质是_______ ;碳元素的化合价_______ (填“升高”或“降低”)。
(3)发生还原反应的物质是_______ ;若生成n个 ,转移
,转移_______ n个电子。
 )为原料,经三步反应制得高纯硅,其中第一步反应的化学方程式如下:
)为原料,经三步反应制得高纯硅,其中第一步反应的化学方程式如下: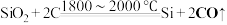 。
。(1)
 中
中 元素的化合价是
元素的化合价是(2)作还原剂的物质是
(3)发生还原反应的物质是
 ,转移
,转移
您最近一年使用:0次
10 . 从氧化还原反应角度预测 的化学性质实验用品:Zn、酸性
的化学性质实验用品:Zn、酸性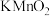 溶液、KOH溶液
溶液、KOH溶液
 的化学性质实验用品:Zn、酸性
的化学性质实验用品:Zn、酸性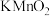 溶液、KOH溶液
溶液、KOH溶液| 预测性质 | 选择反应物 | 预测产物 | 预测依据 |
您最近一年使用:0次