名校
解题方法
1 . 有机化合物A在生产生活中具有重要的价值, 研究其结构及性质具有非常重要的意义。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是___________ 。
Ⅱ.确定分子式
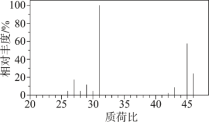
该有机化合物的质谱信息如图。___________ 。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是___ 。
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键________ (氢键用“…”表示)。
① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O 被还原为Cr3+
被还原为Cr3+
② 充分反应后,向①中加入过量KI溶液。
( )
)
③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL( )。
)。
(5)①中参与反应的A与K2Cr2O7的物质的量之比是___________ 。
(6)结合实验数据,得cA =___________ mol·L-1(用代数式表示)。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是
Ⅱ.确定分子式
该有机化合物的质谱信息如图。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键

① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O
 被还原为Cr3+
被还原为Cr3+② 充分反应后,向①中加入过量KI溶液。
(
 )
)③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL(
 )。
)。(5)①中参与反应的A与K2Cr2O7的物质的量之比是
(6)结合实验数据,得cA =
您最近一年使用:0次
2024-06-10更新
|
36次组卷
|
2卷引用:北京市铁路第二中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
2 . 了解化石燃料燃烧过程中二氧化硫( )和氮氧化物(
)和氮氧化物( )的处理对改善环境推动可持续发展具有重要意义。结合所学知识,回答下列问题:
)的处理对改善环境推动可持续发展具有重要意义。结合所学知识,回答下列问题:
I.用活性炭吸附 。
。
(1)活性炭可以和 反应。一定条件下,当1mol NO与活性炭完全反应生成两种无毒的气体时,放出17kJ的热量,写出其反应的热化学方程式:
反应。一定条件下,当1mol NO与活性炭完全反应生成两种无毒的气体时,放出17kJ的热量,写出其反应的热化学方程式:______ 。
(2)活性炭吸附 反应如下:
反应如下:
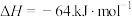 。
。
在 ℃时,该反应在2L容器中测得反应不同时间各物质的物质的量如下:
℃时,该反应在2L容器中测得反应不同时间各物质的物质的量如下:
0~10min内, 的平均反应速率
的平均反应速率
______ ,30min时,该反应的平衡常数
______ 。
(3)30min后,只改变某一条件,反应重新达到平衡;根据表中的数据判断改变的条件可能是______ (填字母)。
a.加入活性炭 b.通入
c.缩小容器的体积 d.加入合适的催化剂
II. 烟气脱除。
烟气脱除。
工业上可用纳米MgO分散到一定浓度的 溶液中,配制成
溶液中,配制成 烟气脱硫试剂。
烟气脱硫试剂。
将含有 的烟气以一定流速持续通入到该脱硫试剂中,实时监测出口处气体中
的烟气以一定流速持续通入到该脱硫试剂中,实时监测出口处气体中 脱除效率及脱硫试剂溶液的pH值,如图1所示。
脱除效率及脱硫试剂溶液的pH值,如图1所示。
已知:ⅰ.纳米MgO活性较高,常温下可以与水反应;
ⅱ.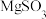 在水中难溶,
在水中难溶, 可溶。
可溶。
(4)烟气脱硫开始阶段溶液呈碱性,很快pH值降到4左右,烟气脱硫效率始终很高。结合化学用语解释其原因______ 。
(5)脱硫试剂中Mg2+维持较高的初始浓度,对脱硫效率有显著影响。实验发现,在600s以后,随着 的脱除,溶液pH值几乎不变,但
的脱除,溶液pH值几乎不变,但 浓度逐渐升高,结合图2中含硫微粒的分布情况,用离子方程式解释其可能原因
浓度逐渐升高,结合图2中含硫微粒的分布情况,用离子方程式解释其可能原因______ 。 的浓度、
的浓度、______ (写出两条)。
 )和氮氧化物(
)和氮氧化物( )的处理对改善环境推动可持续发展具有重要意义。结合所学知识,回答下列问题:
)的处理对改善环境推动可持续发展具有重要意义。结合所学知识,回答下列问题:I.用活性炭吸附
 。
。(1)活性炭可以和
 反应。一定条件下,当1mol NO与活性炭完全反应生成两种无毒的气体时,放出17kJ的热量,写出其反应的热化学方程式:
反应。一定条件下,当1mol NO与活性炭完全反应生成两种无毒的气体时,放出17kJ的热量,写出其反应的热化学方程式:(2)活性炭吸附
 反应如下:
反应如下:
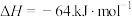 。
。在
 ℃时,该反应在2L容器中测得反应不同时间各物质的物质的量如下:
℃时,该反应在2L容器中测得反应不同时间各物质的物质的量如下:时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| 2 | 1.16 | 0.80 | 0.80 | 1.23 | 1.23 |
| 0 | 0.42 | 0.60 | 0.60 | 0.80 | 0.80 |
 的平均反应速率
的平均反应速率

(3)30min后,只改变某一条件,反应重新达到平衡;根据表中的数据判断改变的条件可能是
a.加入活性炭 b.通入

c.缩小容器的体积 d.加入合适的催化剂
II.
 烟气脱除。
烟气脱除。工业上可用纳米MgO分散到一定浓度的
 溶液中,配制成
溶液中,配制成 烟气脱硫试剂。
烟气脱硫试剂。将含有
 的烟气以一定流速持续通入到该脱硫试剂中,实时监测出口处气体中
的烟气以一定流速持续通入到该脱硫试剂中,实时监测出口处气体中 脱除效率及脱硫试剂溶液的pH值,如图1所示。
脱除效率及脱硫试剂溶液的pH值,如图1所示。
已知:ⅰ.纳米MgO活性较高,常温下可以与水反应;
ⅱ.
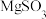 在水中难溶,
在水中难溶, 可溶。
可溶。(4)烟气脱硫开始阶段溶液呈碱性,很快pH值降到4左右,烟气脱硫效率始终很高。结合化学用语解释其原因
(5)脱硫试剂中Mg2+维持较高的初始浓度,对脱硫效率有显著影响。实验发现,在600s以后,随着
 的脱除,溶液pH值几乎不变,但
的脱除,溶液pH值几乎不变,但 浓度逐渐升高,结合图2中含硫微粒的分布情况,用离子方程式解释其可能原因
浓度逐渐升高,结合图2中含硫微粒的分布情况,用离子方程式解释其可能原因
 的浓度、
的浓度、
您最近一年使用:0次
3 .  是一种压电材料。以
是一种压电材料。以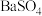 为原料制备粉状
为原料制备粉状 的流程如图。
的流程如图。 易溶于水,
易溶于水, 微溶于水。
微溶于水。
ⅱ.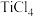 易水解生成
易水解生成 。
。
ⅲ某些温度时 的溶解度如下。
的溶解度如下。
(1)固体1的含硫物质主要是 ,得到固体1的化学方程式是
,得到固体1的化学方程式是___________ 。
(2)试剂 选用
选用___________ (填“水”或“盐酸”),理由是___________ 。
(3)向溶液1中加入盐酸的目的是___________ 。
(4)操作 的具体步骤是
的具体步骤是___________ 。
(5)固体3的主要成分是 。
。
①生成固体3的化学方程式是___________ 。
②得到固体3的过程,需要调控 ,否则
,否则 的产率较低。原因有:
的产率较低。原因有:
ⅰ. 较低时,c(
较低时,c( )较低;
)较低;
ⅱ. 较高时,
较高时,___________ 补充完整)。
(6)高温煅烧固体3,生成的 与
与 的物质的量之比
的物质的量之比 =
=___________ 。
 是一种压电材料。以
是一种压电材料。以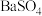 为原料制备粉状
为原料制备粉状 的流程如图。
的流程如图。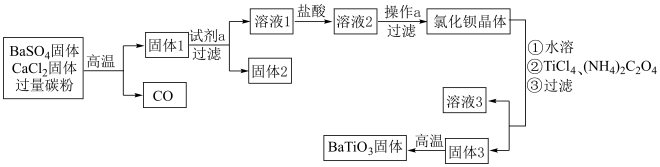
 易溶于水,
易溶于水, 微溶于水。
微溶于水。ⅱ.
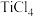 易水解生成
易水解生成 。
。ⅲ某些温度时
 的溶解度如下。
的溶解度如下。温度 | 0 | 20 | 80 | 100 |
 溶解度 溶解度 | 31.6 | 35.7 | 52.4 | 59.4 |
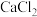 溶解度 溶解度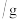 | 59.5 | 74.0 | 147.0 | 159.0 |
(1)固体1的含硫物质主要是
 ,得到固体1的化学方程式是
,得到固体1的化学方程式是(2)试剂
 选用
选用(3)向溶液1中加入盐酸的目的是
(4)操作
 的具体步骤是
的具体步骤是(5)固体3的主要成分是
 。
。①生成固体3的化学方程式是
②得到固体3的过程,需要调控
 ,否则
,否则 的产率较低。原因有:
的产率较低。原因有:ⅰ.
 较低时,c(
较低时,c( )较低;
)较低;ⅱ.
 较高时,
较高时,(6)高温煅烧固体3,生成的
 与
与 的物质的量之比
的物质的量之比 =
=
您最近一年使用:0次
2024-06-10更新
|
114次组卷
|
2卷引用:北京市朝阳区人朝分实验学校2023-2024学年高三下学期化学三模
名校
解题方法
4 . 选择性还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
已知:ⅰ. 在164℃以上时可加速分解成
在164℃以上时可加速分解成 ;
;
ⅱ.当NO与 的物质的量相同时,会发生快速反应:
的物质的量相同时,会发生快速反应:
(1)钒基催化剂(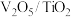 )可用于
)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。___________ 。
②若烟气中含有硫的氧化物,则会降低 的反应速率,可能的原因是
的反应速率,可能的原因是___________ 。
(2)臭氧对 反应具有一定的辅助作用:
反应具有一定的辅助作用: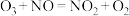 。在不同温度下,经相同时间后测得不同
。在不同温度下,经相同时间后测得不同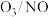 投料比时NO的脱除率如图所示。
投料比时NO的脱除率如图所示。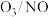 投料比为0.5时,NO脱除率较高的原因是
投料比为0.5时,NO脱除率较高的原因是___________ 。
②350℃后,NO脱除率均有不同程度下降,可能的原因是___________ (答出两点)。
(3)以电化学结合 氧化法除去烟气中的
氧化法除去烟气中的 和
和 ,装置如图所示。
,装置如图所示。 ,则经过质子交换膜的
,则经过质子交换膜的 为
为___________ mol。
②从资源利用角度说明结合电解法与 氧化法的优点
氧化法的优点___________ 。
 )。
)。已知:ⅰ.
 在164℃以上时可加速分解成
在164℃以上时可加速分解成 ;
;ⅱ.当NO与
 的物质的量相同时,会发生快速反应:
的物质的量相同时,会发生快速反应:
(1)钒基催化剂(
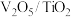 )可用于
)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应机理如图所示。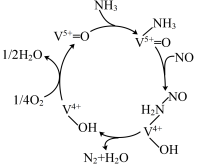
②若烟气中含有硫的氧化物,则会降低
 的反应速率,可能的原因是
的反应速率,可能的原因是(2)臭氧对
 反应具有一定的辅助作用:
反应具有一定的辅助作用: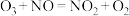 。在不同温度下,经相同时间后测得不同
。在不同温度下,经相同时间后测得不同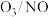 投料比时NO的脱除率如图所示。
投料比时NO的脱除率如图所示。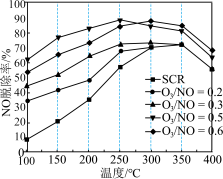
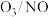 投料比为0.5时,NO脱除率较高的原因是
投料比为0.5时,NO脱除率较高的原因是②350℃后,NO脱除率均有不同程度下降,可能的原因是
(3)以电化学结合
 氧化法除去烟气中的
氧化法除去烟气中的 和
和 ,装置如图所示。
,装置如图所示。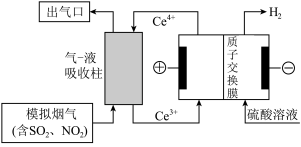
 ,则经过质子交换膜的
,则经过质子交换膜的 为
为②从资源利用角度说明结合电解法与
 氧化法的优点
氧化法的优点
您最近一年使用:0次
名校
解题方法
5 . 铁酸钡( )是一种压电材料。以重晶石(
)是一种压电材料。以重晶石( ,杂质主要有
,杂质主要有 、
、 等)为原料,采用下列路线可制备粉状
等)为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉将 还原为BaS的化学方程式为
还原为BaS的化学方程式为___________ 。
(2)①用水“浸取”时主要发生反应的离子方程式为___________ 。
②流程中先用水浸取,再用盐酸酸化,相比于焙烧后的产物直接用盐酸浸取主要的优势在于___________ 。
(3)“浓缩结晶”所得 中常含有少量杂质金属离子,因此在制备高纯
中常含有少量杂质金属离子,因此在制备高纯 时需要先将
时需要先将 纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到
纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到 溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度
溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度 。
。
①加入双氧水的作用为___________ 。
②为何不在浓缩结晶之前加入双氧水和氨水除去杂质金属离子?___________ 。
(4)“沉淀”步骤生成难溶的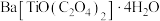
已知: 在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
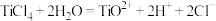 ;
;
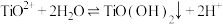 ;
;
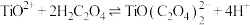
实验表明,“沉淀”反应的最佳pH条件为2.5附近。从平衡移动角度分析pH太高或太低对生成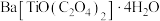 沉淀不利的原因:
沉淀不利的原因:___________ 。
(5)在氮气气氛中“热分解”生成粉状钛酸钡,对应的化学反应方程式为___________ 。
 )是一种压电材料。以重晶石(
)是一种压电材料。以重晶石( ,杂质主要有
,杂质主要有 、
、 等)为原料,采用下列路线可制备粉状
等)为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉将
 还原为BaS的化学方程式为
还原为BaS的化学方程式为(2)①用水“浸取”时主要发生反应的离子方程式为
②流程中先用水浸取,再用盐酸酸化,相比于焙烧后的产物直接用盐酸浸取主要的优势在于
(3)“浓缩结晶”所得
 中常含有少量杂质金属离子,因此在制备高纯
中常含有少量杂质金属离子,因此在制备高纯 时需要先将
时需要先将 纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到
纯化。纯化的步骤为:将酸浸液加热至95℃浓缩,冷却结晶后得到 溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度
溶于水中,加入双氧水,然后加入氨水调节pH,过滤除去沉淀。滤液经加热浓缩,冷却结晶,即得到高纯度 。
。①加入双氧水的作用为
②为何不在浓缩结晶之前加入双氧水和氨水除去杂质金属离子?
(4)“沉淀”步骤生成难溶的
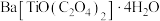
已知:
 在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程:
在水中剧烈水解,在“沉淀”步骤的反应体系中,根据pH不同,发生以下过程: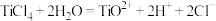 ;
;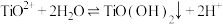 ;
;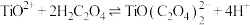
实验表明,“沉淀”反应的最佳pH条件为2.5附近。从平衡移动角度分析pH太高或太低对生成
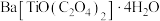 沉淀不利的原因:
沉淀不利的原因:(5)在氮气气氛中“热分解”生成粉状钛酸钡,对应的化学反应方程式为
您最近一年使用:0次
名校
6 . 以铬铁矿(主要成分为 ,还含有MgO、
,还含有MgO、 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图。
的一种工艺流程如图。 与纯碱焙烧转化为
与纯碱焙烧转化为 ,
, 与纯碱焙烧转化为
与纯碱焙烧转化为 。
。
(1)过程Ⅰ中 转化为
转化为 和
和 ,反应中
,反应中 与
与 的化学计量数之比为
的化学计量数之比为______ 。
(2)滤渣1主要含有______ 。
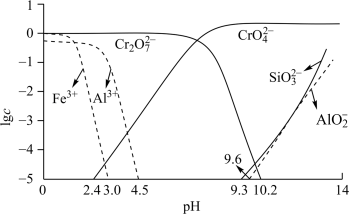
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如下图所示。 溶液的目的是
溶液的目的是____________ 。
②过程Ⅳ发生反应 ,计算该反应的
,计算该反应的
______ 。
(4)利用膜电解技术,以 溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备
溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备 ,装置如图。
,装置如图。______ 。
a.阴离子交换膜 b.质子交换膜 c.阳离子交换膜
②结合方程式解释 产生的原理
产生的原理______ 。
(5)测定产品中 的质量分数。
的质量分数。
称取 产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用
产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用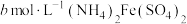 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液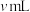 。产品中
。产品中 (摩尔质量为
(摩尔质量为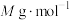 )的质量分数为
)的质量分数为______ 。
已知:酸性条件下 被还原为
被还原为 。
。
 ,还含有MgO、
,还含有MgO、 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图。
的一种工艺流程如图。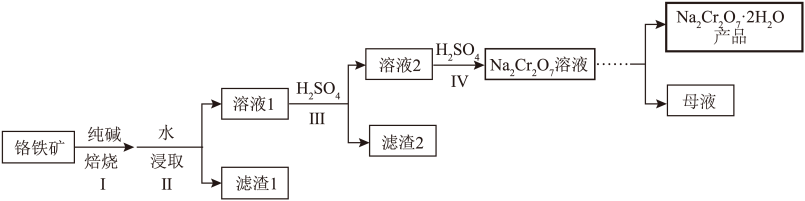
 与纯碱焙烧转化为
与纯碱焙烧转化为 ,
, 与纯碱焙烧转化为
与纯碱焙烧转化为 。
。(1)过程Ⅰ中
 转化为
转化为 和
和 ,反应中
,反应中 与
与 的化学计量数之比为
的化学计量数之比为(2)滤渣1主要含有
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如下图所示。
 溶液的目的是
溶液的目的是②过程Ⅳ发生反应
 ,计算该反应的
,计算该反应的
(4)利用膜电解技术,以
 溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备
溶液为阳极室电解质溶液,NaOH溶液为阴极室电解质溶液也可以制备 ,装置如图。
,装置如图。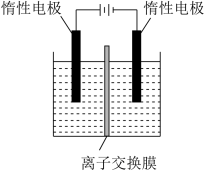
a.阴离子交换膜 b.质子交换膜 c.阳离子交换膜
②结合方程式解释
 产生的原理
产生的原理(5)测定产品中
 的质量分数。
的质量分数。称取
 产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用
产品,用500mL容量瓶配制为待测液。取25mL待测液于锥形瓶中,加入蒸馏水和稀硫酸等,用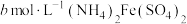 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液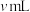 。产品中
。产品中 (摩尔质量为
(摩尔质量为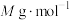 )的质量分数为
)的质量分数为已知:酸性条件下
 被还原为
被还原为 。
。
您最近一年使用:0次
2024-06-04更新
|
311次组卷
|
2卷引用:2024届北京市朝阳区高三下学期二模化学试题
7 . 化学小组实验探究 与
与 悬浊液的反应。
悬浊液的反应。
资料:i. (无色),
(无色), 易被氧气氧化为
易被氧气氧化为 。
。
ii. 很不稳定,易转化为
很不稳定,易转化为 。
。
iii. 在酸性溶液中易转化为
在酸性溶液中易转化为 、
、 。
。
实验一:I.向 溶液中加入浓
溶液中加入浓 溶液,制得
溶液,制得 悬浊液,测得
悬浊液,测得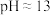 。
。
Ⅱ.向 悬浊液中通入
悬浊液中通入 产生大量白色沉淀A,测得
产生大量白色沉淀A,测得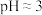 。
。
(1)产生 的离子方程式是
的离子方程式是___________ 。
(2)推测白色沉淀A中可能含有 、
、 、
、 、
、 、
、 。为检验白色沉淀成分,进行实验二:
。为检验白色沉淀成分,进行实验二:
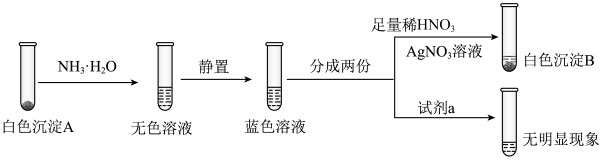
实验二:将实验一中所得的白色沉淀A过滤、洗涤,并进行如下实验。 、
、 ,试剂a为
,试剂a为___________ 。
②根据上述实验推测白色沉淀A为 ,推测依据是
,推测依据是___________ 。
③产生白色沉淀A的离子方程式是___________ 。
④实验二中无色溶液变为蓝色溶液的离子方程式为___________ 。
(3)为排除实验一溶液中 的影响,小组同学进行了实验三
的影响,小组同学进行了实验三
实验三:
I.向 溶液中加入浓
溶液中加入浓 溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的
溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的 固体加水得悬浊液,测得
固体加水得悬浊液,测得 。
。
Ⅱ.向悬浊液中通入SO2至过量,观察到局部先产生少量浅黄色沉淀,而后转化为紫红色固体,溶液变为绿色[含 ],测得溶液
],测得溶液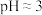 。
。
Ⅲ.向 溶液中通入
溶液中通入 至过量,无明显现象。
至过量,无明显现象。
①补全步骤I中的操作和现象___________ 。
②经确认浅黄色沉淀为 ,紫红色固体为
,紫红色固体为 。
。 与
与 悬浊液发生了氧化还原反应。结合化学用语解释产生
悬浊液发生了氧化还原反应。结合化学用语解释产生 的原因
的原因___________ 。
③解释实验三中步骤Ⅲ与步骤Ⅱ现象不同的原因___________ 。
(4)综合上述实验, 与二价铜反应的产物与
与二价铜反应的产物与___________ 等因素有关(答出两点即可)。
 与
与 悬浊液的反应。
悬浊液的反应。资料:i.
 (无色),
(无色), 易被氧气氧化为
易被氧气氧化为 。
。ii.
 很不稳定,易转化为
很不稳定,易转化为 。
。iii.
 在酸性溶液中易转化为
在酸性溶液中易转化为 、
、 。
。实验一:I.向
 溶液中加入浓
溶液中加入浓 溶液,制得
溶液,制得 悬浊液,测得
悬浊液,测得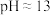 。
。Ⅱ.向
 悬浊液中通入
悬浊液中通入 产生大量白色沉淀A,测得
产生大量白色沉淀A,测得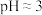 。
。(1)产生
 的离子方程式是
的离子方程式是(2)推测白色沉淀A中可能含有
 、
、 、
、 、
、 、
、 。为检验白色沉淀成分,进行实验二:
。为检验白色沉淀成分,进行实验二:实验二:将实验一中所得的白色沉淀A过滤、洗涤,并进行如下实验。
 、
、 ,试剂a为
,试剂a为②根据上述实验推测白色沉淀A为
 ,推测依据是
,推测依据是③产生白色沉淀A的离子方程式是
④实验二中无色溶液变为蓝色溶液的离子方程式为
(3)为排除实验一溶液中
 的影响,小组同学进行了实验三
的影响,小组同学进行了实验三实验三:
I.向
 溶液中加入浓
溶液中加入浓 溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的
溶液,过滤,洗涤沉淀,取洗涤液,___________(填操作和现象)。将洗净的 固体加水得悬浊液,测得
固体加水得悬浊液,测得 。
。Ⅱ.向悬浊液中通入SO2至过量,观察到局部先产生少量浅黄色沉淀,而后转化为紫红色固体,溶液变为绿色[含
 ],测得溶液
],测得溶液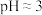 。
。Ⅲ.向
 溶液中通入
溶液中通入 至过量,无明显现象。
至过量,无明显现象。①补全步骤I中的操作和现象
②经确认浅黄色沉淀为
 ,紫红色固体为
,紫红色固体为 。
。 与
与 悬浊液发生了氧化还原反应。结合化学用语解释产生
悬浊液发生了氧化还原反应。结合化学用语解释产生 的原因
的原因③解释实验三中步骤Ⅲ与步骤Ⅱ现象不同的原因
(4)综合上述实验,
 与二价铜反应的产物与
与二价铜反应的产物与
您最近一年使用:0次
2024-06-04更新
|
288次组卷
|
4卷引用:北京市海淀区第一零一中学2023-2024学年高三下学期三模化学试题
8 . 新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂( )做电极材料。对
)做电极材料。对 废旧电极(含杂质
废旧电极(含杂质 、石墨粉)回收并获得高纯
、石墨粉)回收并获得高纯 的工业流程图如下:
的工业流程图如下:
(1)过程ⅰ研磨粉碎的目的是___________ 。
(2)过程ⅱ加入足量 溶液的目的是除去
溶液的目的是除去 ,相关离子方程式为
,相关离子方程式为___________ 。
(3)过程ⅲ采用不同氧化剂分别进行实验,均采用 含量为3.7%的原料,控制
含量为3.7%的原料,控制 为3.5,浸取1.5h后,实验结果如下表所示:
为3.5,浸取1.5h后,实验结果如下表所示:
①实验2中, 能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为
能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为___________ 。
②过程ⅱ最终选择 作为氧化剂,原因是
作为氧化剂,原因是___________ 。
③过程ⅲ得到的浸出液循环两次的目的是___________ 。
(4)浸出液中存在大量 和
和 。结合
。结合平衡移动 原理,解释过程ⅳ得到磷酸铁晶体的原因___________ 。
(5)对比过程ⅳ和ⅴ,说明过程ⅳ不用饱和 溶液的原因:
溶液的原因:___________ 。
(6)过程ⅵ的操作为:将 粗品加水溶解,蒸发结晶至有大量固体析出,
粗品加水溶解,蒸发结晶至有大量固体析出,___________ 。
 )做电极材料。对
)做电极材料。对 废旧电极(含杂质
废旧电极(含杂质 、石墨粉)回收并获得高纯
、石墨粉)回收并获得高纯 的工业流程图如下:
的工业流程图如下:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程ⅰ研磨粉碎的目的是
(2)过程ⅱ加入足量
 溶液的目的是除去
溶液的目的是除去 ,相关离子方程式为
,相关离子方程式为(3)过程ⅲ采用不同氧化剂分别进行实验,均采用
 含量为3.7%的原料,控制
含量为3.7%的原料,控制 为3.5,浸取1.5h后,实验结果如下表所示:
为3.5,浸取1.5h后,实验结果如下表所示:| 序号 | 酸 | 氧化剂 | 浸出液中 浓度( 浓度(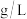 ) ) | 滤渣中 含量/% 含量/% |
| 实验1 |  |  | 9.02 | 0.10 |
| 实验2 |  |  | 9.05 | 0.08 |
| 实验3 |  |  | 7.05 | 0.93 |
 能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为
能与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为②过程ⅱ最终选择
 作为氧化剂,原因是
作为氧化剂,原因是③过程ⅲ得到的浸出液循环两次的目的是
(4)浸出液中存在大量
 和
和 。结合
。结合(5)对比过程ⅳ和ⅴ,说明过程ⅳ不用饱和
 溶液的原因:
溶液的原因:(6)过程ⅵ的操作为:将
 粗品加水溶解,蒸发结晶至有大量固体析出,
粗品加水溶解,蒸发结晶至有大量固体析出,
您最近一年使用:0次
2024-06-04更新
|
183次组卷
|
3卷引用:北京市海淀区第一零一中学2023-2024学年高三下学期三模化学试题
名校
解题方法
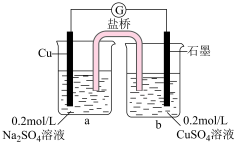
9 . 某小组同学探究Mg与 溶液的反应。
溶液的反应。
已知:i.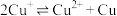
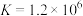
ⅱ.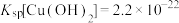
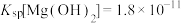
ⅲ. 为无色、
为无色、 为黄色
为黄色
实验I:将长约15cm打磨光亮的镁条放入2mL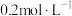
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:
(1)第一阶段析出红色固体发生反应的离子方程式是______ 。
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因______ 。
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是______ 。
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是______ 。
③小组同学采用电化学装置进行验证。______ 。从而证明了甲同学的猜想。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是______ 。
实验Ⅱ:改用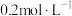
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
(5)经验证蓝色沉淀为 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是______ (填序号)。
a.反应放热,促使 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀
b.存在平衡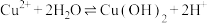 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀
c.由于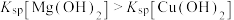 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀
(6)综上所述,影响Mg与 溶液反应的影响因素是
溶液反应的影响因素是______ 。
 溶液的反应。
溶液的反应。已知:i.
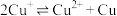
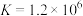
ⅱ.
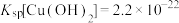
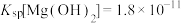
ⅲ.
 为无色、
为无色、 为黄色
为黄色实验I:将长约15cm打磨光亮的镁条放入2mL
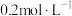
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:| 时间 | 第一阶段 0~1min | 第二阶段 1~8min | 第三阶段 8~25min | 第四阶段 25min~18h |
| 实验现象 | 镁条表面出现红色固体,伴有大量气体产生 | 仍然伴有大量气体,溶液变为淡蓝色,试管底部有蓝色沉淀产生 | 气体量不断减少,沉淀变为黄色 | 沉淀变为橙色,红色铜几乎不可见 |
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是
③小组同学采用电化学装置进行验证。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是
实验Ⅱ:改用
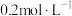
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。(5)经验证蓝色沉淀为
 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是a.反应放热,促使
 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀b.存在平衡
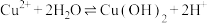 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀c.由于
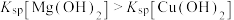 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀(6)综上所述,影响Mg与
 溶液反应的影响因素是
溶液反应的影响因素是
您最近一年使用:0次
2024-06-04更新
|
251次组卷
|
2卷引用:北京市通州区2023-2024学年高三下学期模拟考试(一模)化学试题
名校
10 . 高一年级小村同学最近通过学习了解到:“肼”( )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1) 属于
属于_______ 化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_______ (填“离子键”或“极性键”或“非极性键”)
(2)已知①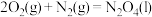
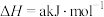
②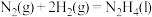
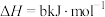
③
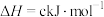
某型号火箭采用液态肼和液态 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式________ 。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式________ ,理论上每消耗64 g肼可除去标准状况下
________ L。
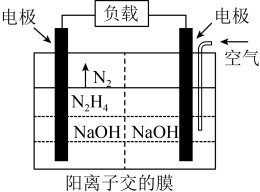
(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式_________ 。
 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。(1)
 属于
属于(2)已知①
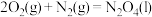
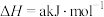
②
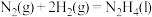
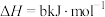
③

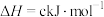
某型号火箭采用液态肼和液态
 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式

(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式

您最近一年使用:0次

 (mol)
(mol)

