1 . 2023年杭州亚运会使用甲醇( )作为主火炬燃料。
)作为主火炬燃料。
(1) 是一种清洁、可再生燃料,燃烧时发生反应:
是一种清洁、可再生燃料,燃烧时发生反应: 。
。
在该反应中每消耗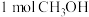 ,生成
,生成 的物质的量是
的物质的量是_______  ,生成
,生成 的质量是
的质量是_______ g。
(2) 燃烧时,火焰为淡蓝色。在
燃烧时,火焰为淡蓝色。在 中添加含
中添加含_______ (填序号)元素的化合物,可使火炬的火焰呈黄色。
a.钠 b.钾
(3) 可由废弃的
可由废弃的 制得,其原理为:
制得,其原理为:
在该反应中,作还原剂的物质是_______ ,每生成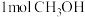 ,转移电子的物质的量是
,转移电子的物质的量是_______  。
。
(4)一种富集烟气中 的方法示意图如下。
的方法示意图如下。
_______  (填“>”或“<”)。
(填“>”或“<”)。
②写出“解吸”过程的化学方程式:_______ 。
 )作为主火炬燃料。
)作为主火炬燃料。(1)
 是一种清洁、可再生燃料,燃烧时发生反应:
是一种清洁、可再生燃料,燃烧时发生反应: 。
。在该反应中每消耗
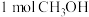 ,生成
,生成 的物质的量是
的物质的量是 ,生成
,生成 的质量是
的质量是(2)
 燃烧时,火焰为淡蓝色。在
燃烧时,火焰为淡蓝色。在 中添加含
中添加含a.钠 b.钾
(3)
 可由废弃的
可由废弃的 制得,其原理为:
制得,其原理为:
在该反应中,作还原剂的物质是
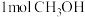 ,转移电子的物质的量是
,转移电子的物质的量是 。
。(4)一种富集烟气中
 的方法示意图如下。
的方法示意图如下。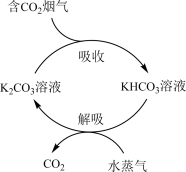

 (填“>”或“<”)。
(填“>”或“<”)。②写出“解吸”过程的化学方程式:
您最近一年使用:0次
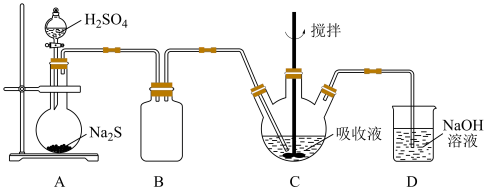
2 . 硫化氢的转化是资源利用和环境保护的重要研究课题。实验室模拟脱除硫化氢并获得硫黄的装置如下。
资料: (黑色),
(黑色),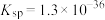 。
。 发生装置。A中反应的化学方程式为
发生装置。A中反应的化学方程式为_______ 。
(2)C中,以 为吸收液脱除
为吸收液脱除 。
。
① 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生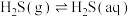 以及电离:
以及电离:_______ 、 。
。
②将脱除 的反应补充完整:
的反应补充完整:_______ 。 浓度:滤出沉淀,取v mL滤液,除去杂质,加入适量稀硫酸,用
浓度:滤出沉淀,取v mL滤液,除去杂质,加入适量稀硫酸,用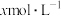 的
的 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液y mL。滴定时发生的离子反应:
溶液y mL。滴定时发生的离子反应: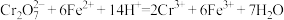 。滤液中
。滤液中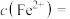
_______  。
。
(3)实验发现,在 溶液中加入一定浓度的
溶液中加入一定浓度的 可以明显提高
可以明显提高 的脱除率。做对比研究:
的脱除率。做对比研究:
①ⅱ中产生 的离子方程式为
的离子方程式为_______ 。
②ⅲ中,加入 后,脱除率几乎达到100%。结合方程式解释原因:
后,脱除率几乎达到100%。结合方程式解释原因:_______ 。
③pH减小会降低ⅰ中脱除率,但对ⅱ中的脱除率几乎无影响,解释原因:_______ 。
④充分反应后,滤出ⅲ中沉淀,通入 ,吸收液再生。
,吸收液再生。
资料:
 (黑色),
(黑色),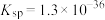 。
。
 发生装置。A中反应的化学方程式为
发生装置。A中反应的化学方程式为(2)C中,以
 为吸收液脱除
为吸收液脱除 。
。①
 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生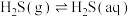 以及电离:
以及电离: 。
。②将脱除
 的反应补充完整:
的反应补充完整:

 _______
_______ 。
。
 浓度:滤出沉淀,取v mL滤液,除去杂质,加入适量稀硫酸,用
浓度:滤出沉淀,取v mL滤液,除去杂质,加入适量稀硫酸,用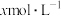 的
的 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液y mL。滴定时发生的离子反应:
溶液y mL。滴定时发生的离子反应: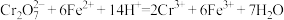 。滤液中
。滤液中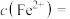
 。
。(3)实验发现,在
 溶液中加入一定浓度的
溶液中加入一定浓度的 可以明显提高
可以明显提高 的脱除率。做对比研究:
的脱除率。做对比研究:| 实验序号 | ⅰ | ⅱ | ⅲ |
| 吸收液 |  溶液 溶液 |  溶液 溶液 |  溶液+ 溶液+ 溶液 溶液 |
 脱除率 脱除率 | ≈92% | ≈100% | ≈100% |
 脱除产物 脱除产物 | S |  | S |
 的离子方程式为
的离子方程式为②ⅲ中,加入
 后,脱除率几乎达到100%。结合方程式解释原因:
后,脱除率几乎达到100%。结合方程式解释原因:③pH减小会降低ⅰ中脱除率,但对ⅱ中的脱除率几乎无影响,解释原因:
④充分反应后,滤出ⅲ中沉淀,通入
 ,吸收液再生。
,吸收液再生。
您最近一年使用:0次
解题方法
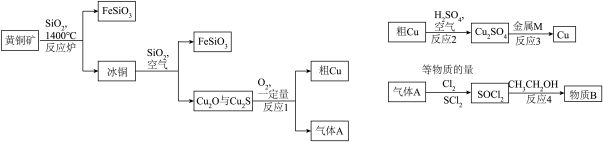
3 . 有关黄铜矿(CuFeS2)的转换关系如下图所示,请完成有关问题。___________ ,SOCl2的中心原子杂化方式为___________ 。
(2)下列说法中,不正确的是___________。
(3)请写出反应1的化学方程式:___________ 。
(4)反应4生成的物质B难溶于水,同时生成两种酸性气体,则反应4的化学反应方程式为:___________ ,请设计实验检验物质B中的氯元素___________ 。
(2)下列说法中,不正确的是___________。
| A.反应2中另有氢气产生,是氧化还原反应 |
| B.气体A具有漂白性,可以使紫色石蕊溶液褪色 |
| C.FeS2在工业中,是一种制取硫酸的原料,不常用来炼铁 |
| D.金属M可以是相对活泼金属,如Fe,Mg等 |
(3)请写出反应1的化学方程式:
(4)反应4生成的物质B难溶于水,同时生成两种酸性气体,则反应4的化学反应方程式为:
您最近一年使用:0次
解题方法
4 . 绿矾( )可用作除草剂、净水剂或抗贫血药等。某研究小组利用工业制硫酸的硫铁矿烧渣(主要成分为
)可用作除草剂、净水剂或抗贫血药等。某研究小组利用工业制硫酸的硫铁矿烧渣(主要成分为 、
、 和
和 ,不考虑其他杂质)制备绿矾,其简易流程如下(反应条件略)。
,不考虑其他杂质)制备绿矾,其简易流程如下(反应条件略)。
(1)步骤Ⅰ中,酸浸前将硫铁矿烧渣粉碎,其目的是______ ;写出 与
与 反应的离子方程式
反应的离子方程式______ 。
(2)步骤Ⅱ中,用活化硫铁矿( )还原
)还原 (不考虑其他反应)。
(不考虑其他反应)。
①补齐该反应的离子方程式:______ 。
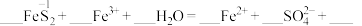
②为了检验 是否被完全还原,小组同学的操作和现象是
是否被完全还原,小组同学的操作和现象是______ 。
(3)步骤Ⅲ中,加 调溶液pH到5.8左右,随后在步骤Ⅳ中通入空气,使溶液的pH降到5.2,用离子方程式表示步骤Ⅳ中通入空气使溶液pH降低的原因
调溶液pH到5.8左右,随后在步骤Ⅳ中通入空气,使溶液的pH降到5.2,用离子方程式表示步骤Ⅳ中通入空气使溶液pH降低的原因______ 。
溶液中金属离子(c=0.01mol/L)开始沉淀和沉淀完全的pH(20℃)
(4)步骤Ⅴ是将滤液加热浓缩至一定浓度,保持温度在20℃,用硫酸调pH约为2,加入一定量的乙醇,有 晶体析出。结合图中数据和分子极性相关知识,分析加入乙醇促进
晶体析出。结合图中数据和分子极性相关知识,分析加入乙醇促进 晶体析出的原因
晶体析出的原因______ 。
 )可用作除草剂、净水剂或抗贫血药等。某研究小组利用工业制硫酸的硫铁矿烧渣(主要成分为
)可用作除草剂、净水剂或抗贫血药等。某研究小组利用工业制硫酸的硫铁矿烧渣(主要成分为 、
、 和
和 ,不考虑其他杂质)制备绿矾,其简易流程如下(反应条件略)。
,不考虑其他杂质)制备绿矾,其简易流程如下(反应条件略)。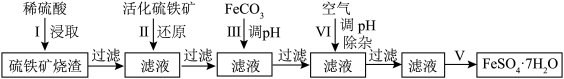
(1)步骤Ⅰ中,酸浸前将硫铁矿烧渣粉碎,其目的是
 与
与 反应的离子方程式
反应的离子方程式(2)步骤Ⅱ中,用活化硫铁矿(
 )还原
)还原 (不考虑其他反应)。
(不考虑其他反应)。①补齐该反应的离子方程式:
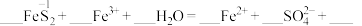
②为了检验
 是否被完全还原,小组同学的操作和现象是
是否被完全还原,小组同学的操作和现象是(3)步骤Ⅲ中,加
 调溶液pH到5.8左右,随后在步骤Ⅳ中通入空气,使溶液的pH降到5.2,用离子方程式表示步骤Ⅳ中通入空气使溶液pH降低的原因
调溶液pH到5.8左右,随后在步骤Ⅳ中通入空气,使溶液的pH降到5.2,用离子方程式表示步骤Ⅳ中通入空气使溶液pH降低的原因溶液中金属离子(c=0.01mol/L)开始沉淀和沉淀完全的pH(20℃)
金属离子 |
|
|
|
开始沉淀时的pH | 2.2 | 3.7 | 7.5 |
沉淀完全时的pH | 3.2 | 4.7 | 9.0 |
(4)步骤Ⅴ是将滤液加热浓缩至一定浓度,保持温度在20℃,用硫酸调pH约为2,加入一定量的乙醇,有
 晶体析出。结合图中数据和分子极性相关知识,分析加入乙醇促进
晶体析出。结合图中数据和分子极性相关知识,分析加入乙醇促进 晶体析出的原因
晶体析出的原因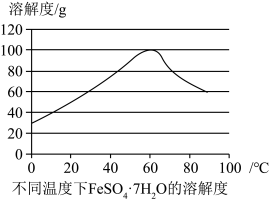
您最近一年使用:0次
解题方法
5 . 利用废覆铜板回收铜并制备Fe3O4纳米颗粒的一种流程如下:
(1)为了提高“盐浸池”中的化学反应速率,可采取的措施是________ (至少写一条)。
(2)沉铜池中反应的化学方程式为________ 。
(3)加入适量的双氧水是为了将溶液中Fe2+氧化成Fe3+,反应的离子方程式为________ ;氯气也可以将Fe2+氧化成Fe3+,与氯气相比,双氧水的优点是________ 。
(4)结合流程设计从“滤渣”中回收利用物质的合理方案________ 。
(5)若制232gFe3O4纳米颗粒,则理论上消耗H2O2的质量为________ g。
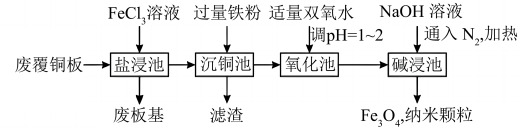
(1)为了提高“盐浸池”中的化学反应速率,可采取的措施是
(2)沉铜池中反应的化学方程式为
(3)加入适量的双氧水是为了将溶液中Fe2+氧化成Fe3+,反应的离子方程式为
(4)结合流程设计从“滤渣”中回收利用物质的合理方案
(5)若制232gFe3O4纳米颗粒,则理论上消耗H2O2的质量为
您最近一年使用:0次
6 . 烟气脱硝是降低大气中氮氧化物污染的重要措施之一,主要反应有6NO2+8NH3=7N2+12H2O
(1)该反应中,还原剂是_____ (填化学式),NO2发生了_____ 反应(填“氧化”或“还原”)。
(2)反应中每脱除1molNO2,转移电子的物质的量为_____ mol。
(3)实验室加热NH4Cl和Ca(OH)2的混合物可制备NH3,选用的装置为_____ 。
(1)该反应中,还原剂是
(2)反应中每脱除1molNO2,转移电子的物质的量为
(3)实验室加热NH4Cl和Ca(OH)2的混合物可制备NH3,选用的装置为
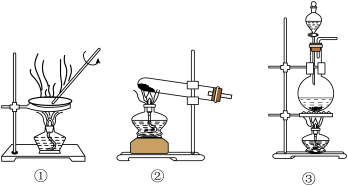
您最近一年使用:0次
7 . 某小组以工业浓盐酸呈黄色为线索,探究 在水溶液中呈现不同颜色的原因。
在水溶液中呈现不同颜色的原因。
查阅资料: 在溶液中以络离子的形式存在,如
在溶液中以络离子的形式存在,如 (浅紫色)、
(浅紫色)、 (黄色)等,
(黄色)等, 、
、 、
、 等与
等与 的络合能力较弱,通常将
的络合能力较弱,通常将 简写为
简写为 。
。
(1)取少量黄色的盐酸样品,滴入 溶液,通过
溶液,通过_____ 现象,说明样品中存在 。
。
(2)为了研究浓盐酸的黄色与 的关系,进行如下实验:取样品加入足量硝酸银、产生大量白色沉淀,静置后溶液颜色变浅。
的关系,进行如下实验:取样品加入足量硝酸银、产生大量白色沉淀,静置后溶液颜色变浅。
①加入 溶液后,将
溶液后,将 沉淀,其目的是
沉淀,其目的是____ 。
②推测(1)中涉及的与 络合的微粒,在相同条件下其络合能力由强到弱的顺序是
络合的微粒,在相同条件下其络合能力由强到弱的顺序是____ 。
(3)继续研究溶液中 的颜色。
的颜色。
①用晶体配制 和
和 溶液,溶液均呈黄色,酸化后颜色均变浅。已知
溶液,溶液均呈黄色,酸化后颜色均变浅。已知 在溶液中发生水解反应得到
在溶液中发生水解反应得到 等一系列黄色产物。
等一系列黄色产物。
ⅰ.以得到 为例,写出该水解反应的离子方程式:
为例,写出该水解反应的离子方程式:_____ 。
ⅱ.解释酸化使溶液颜色变浅的原因:_____ 。
②将几滴新制的 溶液小心缓慢滴入浓硫酸中,立刻观察到溶液中产生浅紫色,经证实是
溶液小心缓慢滴入浓硫酸中,立刻观察到溶液中产生浅紫色,经证实是 的颜色。
的颜色。
ⅰ.该实验中, 溶液与浓硫酸发生反应的化学方程式是
溶液与浓硫酸发生反应的化学方程式是____ 。
ⅱ.本实验中,利用了硫酸的性质:氧化性、_____ 。
 在水溶液中呈现不同颜色的原因。
在水溶液中呈现不同颜色的原因。查阅资料:
 在溶液中以络离子的形式存在,如
在溶液中以络离子的形式存在,如 (浅紫色)、
(浅紫色)、 (黄色)等,
(黄色)等, 、
、 、
、 等与
等与 的络合能力较弱,通常将
的络合能力较弱,通常将 简写为
简写为 。
。(1)取少量黄色的盐酸样品,滴入
 溶液,通过
溶液,通过 。
。(2)为了研究浓盐酸的黄色与
 的关系,进行如下实验:取样品加入足量硝酸银、产生大量白色沉淀,静置后溶液颜色变浅。
的关系,进行如下实验:取样品加入足量硝酸银、产生大量白色沉淀,静置后溶液颜色变浅。①加入
 溶液后,将
溶液后,将 沉淀,其目的是
沉淀,其目的是②推测(1)中涉及的与
 络合的微粒,在相同条件下其络合能力由强到弱的顺序是
络合的微粒,在相同条件下其络合能力由强到弱的顺序是(3)继续研究溶液中
 的颜色。
的颜色。①用晶体配制
 和
和 溶液,溶液均呈黄色,酸化后颜色均变浅。已知
溶液,溶液均呈黄色,酸化后颜色均变浅。已知 在溶液中发生水解反应得到
在溶液中发生水解反应得到 等一系列黄色产物。
等一系列黄色产物。ⅰ.以得到
 为例,写出该水解反应的离子方程式:
为例,写出该水解反应的离子方程式:ⅱ.解释酸化使溶液颜色变浅的原因:
②将几滴新制的
 溶液小心缓慢滴入浓硫酸中,立刻观察到溶液中产生浅紫色,经证实是
溶液小心缓慢滴入浓硫酸中,立刻观察到溶液中产生浅紫色,经证实是 的颜色。
的颜色。ⅰ.该实验中,
 溶液与浓硫酸发生反应的化学方程式是
溶液与浓硫酸发生反应的化学方程式是ⅱ.本实验中,利用了硫酸的性质:氧化性、
您最近一年使用:0次
解题方法
8 . 实验室利用海带(含碘化物、无机盐和有机化合物等)提取碘的步骤如下。
ⅰ.将海带进行灼烧、浸泡、过滤,取滤液;
ⅱ.向其中加入稀 和
和 ;
;
ⅲ.继续加入有机试剂,充分振荡、静置,取下层溶液;
ⅳ.向其中加入 溶液,充分振荡、静置,取上层溶液;
溶液,充分振荡、静置,取上层溶液;
ⅴ.加入 溶液,充分反应后,过滤得到
溶液,充分反应后,过滤得到 。
。
已知:
回答下列2个小题。
1.下列关于步骤ⅰ ⅲ的说法,不正确的是
ⅲ的说法,不正确的是
2.下列关于步骤ⅲ ⅴ的说法,不正确的是
ⅴ的说法,不正确的是
ⅰ.将海带进行灼烧、浸泡、过滤,取滤液;
ⅱ.向其中加入稀
 和
和 ;
;ⅲ.继续加入有机试剂,充分振荡、静置,取下层溶液;
ⅳ.向其中加入
 溶液,充分振荡、静置,取上层溶液;
溶液,充分振荡、静置,取上层溶液;ⅴ.加入
 溶液,充分反应后,过滤得到
溶液,充分反应后,过滤得到 。
。已知:

回答下列2个小题。
1.下列关于步骤ⅰ
 ⅲ的说法,不正确的是
ⅲ的说法,不正确的是| A.灼烧海带不仅除去了有机化合物,而且富集了碘元素 |
B.步骤ⅱ, 与 与 反应的产物中有 反应的产物中有 和 和 |
C.步骤ⅲ,有机试剂可为 |
D.步骤ⅲ的目的是富集 ,并与水中的杂质分离 ,并与水中的杂质分离 |
 ⅴ的说法,不正确的是
ⅴ的说法,不正确的是| A.步骤ⅲ和ⅳ,均需用到分液漏斗 |
B.步骤ⅳ需使用足量的稀 溶液 溶液 |
| C.步骤ⅳ,钠盐在水中的溶解度大于在有机溶剂中的 |
D.步骤ⅴ,每生成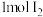 转移 转移 |
您最近一年使用:0次
9 . 化学对于推动汽车工业的发展起着极为重要的作用。
(1)如图为三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图判断更适合作汽车燃料的可燃物为___________ (填“ ”、“B”或“C”)。
”、“B”或“C”)。 等污染物,
等污染物, 主要来源于汽车内燃机中高温环境下
主要来源于汽车内燃机中高温环境下 和
和 的反应。已知:断裂
的反应。已知:断裂 化学键所吸收的能量如下:
化学键所吸收的能量如下:
①当 参与反应时
参与反应时___________ (填“吸收”或“释放”)的能量为___________ 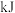 。
。
②汽车尾气中装有三元催化器,可使 和
和 发生反应而去除。该反应利用了
发生反应而去除。该反应利用了 的
的___________ 性。
(3)为了减小对环境的影响,电动汽车代替部分燃油汽车。如图为目前研究较多的一类甲烷燃料电池的工作原理示意图。___________ 极。
②固体氧化物的作用是___________ 。
③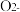 迁移的方向为
迁移的方向为___________ (填“从A到B”或“从B到A”)。
④甲烷燃烧时化学能转化为热能,而燃料电池可将化学能转化为电能,原因是电池装置可将___________ ,并通过能导电的物质形成闭合回路,产生电流。
(4)汽车安全气囊是保护生命安全的重要装置。当汽车发生碰撞时,安全气囊中的气体发生剂产生大量气体使气囊迅速膨胀起到缓冲作用。某气体发生剂由叠氮化钠 等多种物质按一定比例混合而成。
等多种物质按一定比例混合而成。
已知: 是主要的产气物质,汽车碰撞时,点火器点火引发
是主要的产气物质,汽车碰撞时,点火器点火引发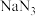 迅速分解产生
迅速分解产生 和
和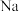 ,并释放大量的热。
,并释放大量的热。
①用化学方程式表示 的作用
的作用___________ 。
②添加 的主要目的是
的主要目的是___________ , 的量过多导致的不利影响是
的量过多导致的不利影响是___________ 。
(1)如图为三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图判断更适合作汽车燃料的可燃物为
 ”、“B”或“C”)。
”、“B”或“C”)。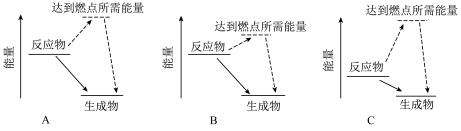
 等污染物,
等污染物, 主要来源于汽车内燃机中高温环境下
主要来源于汽车内燃机中高温环境下 和
和 的反应。已知:断裂
的反应。已知:断裂 化学键所吸收的能量如下:
化学键所吸收的能量如下:| 化学键 | 氮氮键 | 氧氧键 | 氮氧键 |
吸收能量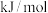 | 946 | 498 | 632 |
 参与反应时
参与反应时 。
。②汽车尾气中装有三元催化器,可使
 和
和 发生反应而去除。该反应利用了
发生反应而去除。该反应利用了 的
的(3)为了减小对环境的影响,电动汽车代替部分燃油汽车。如图为目前研究较多的一类甲烷燃料电池的工作原理示意图。
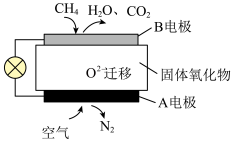
②固体氧化物的作用是
③
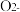 迁移的方向为
迁移的方向为④甲烷燃烧时化学能转化为热能,而燃料电池可将化学能转化为电能,原因是电池装置可将
(4)汽车安全气囊是保护生命安全的重要装置。当汽车发生碰撞时,安全气囊中的气体发生剂产生大量气体使气囊迅速膨胀起到缓冲作用。某气体发生剂由叠氮化钠
 等多种物质按一定比例混合而成。
等多种物质按一定比例混合而成。已知:
 是主要的产气物质,汽车碰撞时,点火器点火引发
是主要的产气物质,汽车碰撞时,点火器点火引发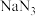 迅速分解产生
迅速分解产生 和
和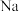 ,并释放大量的热。
,并释放大量的热。①用化学方程式表示
 的作用
的作用②添加
 的主要目的是
的主要目的是 的量过多导致的不利影响是
的量过多导致的不利影响是
您最近一年使用:0次
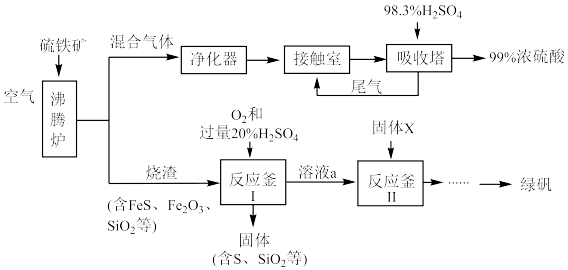
10 . 某精选的硫铁矿主要成分为二硫化亚铁(FeS2)和二氧化硅。利用其生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如图:___________ 。
(2)吸收塔中发生反应的化学方程式为___________ 。
(3)反应釜Ⅰ中固体S产生的原因可能有___________ 。
(4)反应釜Ⅱ,当固体X为铁粉时,铁粉的作用有___________ 。
(5)反应釜Ⅱ,当固体X为硫铁矿时,在氧化亚铁硫杆菌催化作用下,溶液a与FeS2发生反应。
①将离子方程式补充完整:_______________ 。
FeS2+ + Fe2++
Fe2++ +
+
②研究温度对该反应的影响,发现随温度升高反应速率加快,但是当温度高于25℃时,反应速率下降。分析下降的原因是___________ 。
(6)从矿物资源充分利用的角度对该流程进行优化改进,可采取的措施是___________ 。
(2)吸收塔中发生反应的化学方程式为
(3)反应釜Ⅰ中固体S产生的原因可能有
(4)反应釜Ⅱ,当固体X为铁粉时,铁粉的作用有
(5)反应釜Ⅱ,当固体X为硫铁矿时,在氧化亚铁硫杆菌催化作用下,溶液a与FeS2发生反应。
①将离子方程式补充完整:
FeS2+ +
 Fe2++
Fe2++ +
+ ②研究温度对该反应的影响,发现随温度升高反应速率加快,但是当温度高于25℃时,反应速率下降。分析下降的原因是
(6)从矿物资源充分利用的角度对该流程进行优化改进,可采取的措施是
您最近一年使用:0次
2024-07-16更新
|
70次组卷
|
2卷引用: 北京市丰台区2023-2024学年高一下学期期末考试化学试卷




