1 . 某小组同学探究三种价态( 、
、 、
、 )硫元素间的相互转化。可以选用的试剂有:①
)硫元素间的相互转化。可以选用的试剂有:① 水溶液、②浓硫酸、③稀硫酸、④
水溶液、②浓硫酸、③稀硫酸、④ 溶液、⑤
溶液、⑤ 溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨
溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨ 溶液。
溶液。
(1)补全实验表格ⅰ:______ 、ⅱ:_____ 、ⅲ:_______ 。
(2)实验5的化学方程式为________ 。
(3)为了进一步验证实验1中 的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量
的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。
①实验a的目的是通过检验________ ,证明转化得以实现。
②加稀盐酸的作用是_______ 。
乙同学认为还需要补充实验b:取等量的 溶液,向其中先加过量稀盐酸,再加足量
溶液,向其中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。
③补充实验b的原因是______ 。
④综合实验a和b,实验1中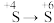 转化得以实现的证据是
转化得以实现的证据是_______ 。
(4)分析实验3和实验4现象不同的可能原因________ 。
(5)上述实验中能体现 氧化性的是
氧化性的是_______ (填实验序号)。
 、
、 、
、 )硫元素间的相互转化。可以选用的试剂有:①
)硫元素间的相互转化。可以选用的试剂有:① 水溶液、②浓硫酸、③稀硫酸、④
水溶液、②浓硫酸、③稀硫酸、④ 溶液、⑤
溶液、⑤ 溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨
溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨ 溶液。
溶液。| 实验序号 | 预期的价态转化 | 选择的试剂(填入试剂编号) | 实验现象 |
| 1 | 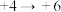 | ④⑥ | |
| 2 | ⅰ | ⅱ | |
| 3 |  | ①⑤ | 出现浑浊 |
| 4 | ④⑤ | 无明显现象 | |
| 5 | 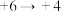 | ⅲ |
(2)实验5的化学方程式为
(3)为了进一步验证实验1中
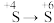 的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量
的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。①实验a的目的是通过检验
②加稀盐酸的作用是
乙同学认为还需要补充实验b:取等量的
 溶液,向其中先加过量稀盐酸,再加足量
溶液,向其中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。③补充实验b的原因是
④综合实验a和b,实验1中
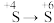 转化得以实现的证据是
转化得以实现的证据是(4)分析实验3和实验4现象不同的可能原因
(5)上述实验中能体现
 氧化性的是
氧化性的是
您最近一年使用:0次
名校
2 . 某小组进行“反应物浓度对反应速率影响”实验研究。分别取 不同浓度的葡萄糖溶液和
不同浓度的葡萄糖溶液和 溶液于试管中,再依次向试管中滴加
溶液于试管中,再依次向试管中滴加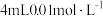 酸性
酸性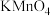 溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。
溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。
(2)酸性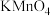 溶液与
溶液与 溶液反应时,某种历程可表示如图。
溶液反应时,某种历程可表示如图。不合理 的是
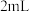 不同浓度的葡萄糖溶液和
不同浓度的葡萄糖溶液和 溶液于试管中,再依次向试管中滴加
溶液于试管中,再依次向试管中滴加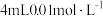 酸性
酸性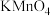 溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。
溶液,通过色度计监测溶液透光率随时间的变化关系。实验结果如图所示。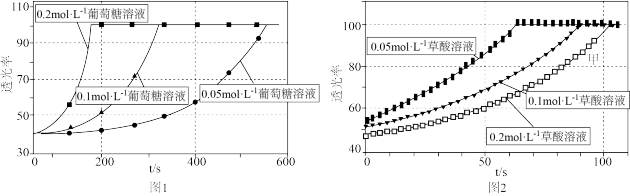
(2)酸性
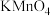 溶液与
溶液与 溶液反应时,某种历程可表示如图。
溶液反应时,某种历程可表示如图。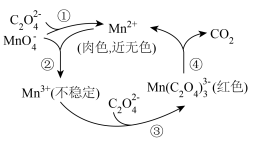
| A.从图1可知,该实验条件下,葡萄糖溶液浓度越大,反应速率越大 |
B.理论上,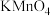 和 和 的反应中参与反应的 的反应中参与反应的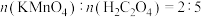 |
| C.图2中曲线甲反应速率加快的原因可能与反应生成有催化作用的物质有关 |
D.图2中 溶液浓度不同时,数据呈现的原因是:随 溶液浓度不同时,数据呈现的原因是:随 浓度增大,反应历程中①、②、③、④速率均减小 浓度增大,反应历程中①、②、③、④速率均减小 |
您最近一年使用:0次
2024-05-28更新
|
199次组卷
|
2卷引用:2024届北京市顺义区高三下学期二模化学试卷
3 . 在碘水、淀粉、稀 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: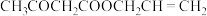
AAAI为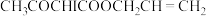
下列说法不正确 的是
 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: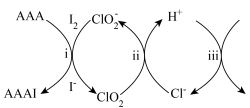
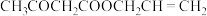
AAAI为
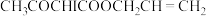
下列说法
| A.i为取代反应 | B.ii的反应为 |
C.iii中,生成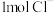 转移 转移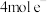 | D.最终溶液呈蓝色 |
您最近一年使用:0次
名校
4 . 高一年级小村同学最近通过学习了解到:“肼”(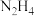 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1)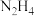 属于
属于_______ 化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_______ (填“离子键”或“极性键”或“非极性键”)
(2)已知①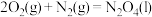
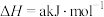
②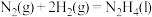
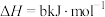
③
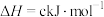
某型号火箭采用液态肼和液态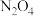 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式________ 。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式________ ,理论上每消耗64 g肼可除去标准状况下
________ L。
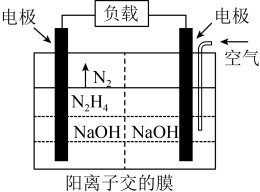
(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式_________ 。
 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。(1)
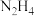 属于
属于(2)已知①
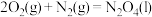
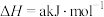
②
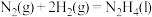
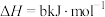
③

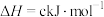
某型号火箭采用液态肼和液态
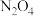 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式

(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式

您最近一年使用:0次
5 . 从海带浸泡液(碘元素主要以 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。 的作用为
的作用为_______ (填“氧化剂”或“还原剂”)。
(2)为提高①的化学反应速率,可采取的措施是_______ (写出一条即可)。
(3)补全②的离子方程式:_______ 。
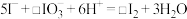
(4)②中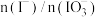 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。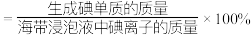
分析图中信息,选择最佳条件:_______ 。
 存在)中获取
存在)中获取 ,含碘物质的转化过程如下。
,含碘物质的转化过程如下。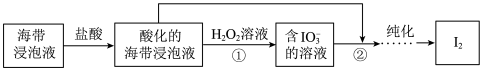
 的作用为
的作用为(2)为提高①的化学反应速率,可采取的措施是
(3)补全②的离子方程式:
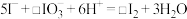
(4)②中
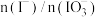 和pH对碘离子的氧化率的影响如下图所示。
和pH对碘离子的氧化率的影响如下图所示。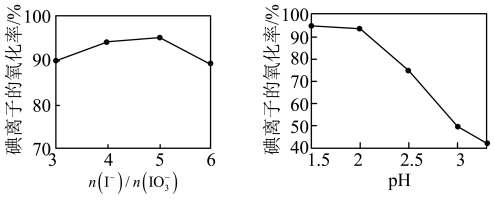
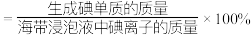
分析图中信息,选择最佳条件:
您最近一年使用:0次
解题方法
6 . 从某工厂铜电解车间产生的难溶副产物黑铜泥(主要成分为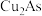 和
和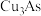 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。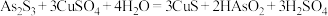 ;
;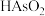 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。
(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是___________ 。
(2)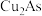 和
和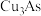 被氧化为
被氧化为 和
和 。
。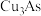 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
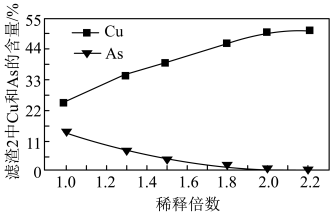
(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。___________ 。
(4)上述流程中可循环使用的物质是___________ 。
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用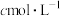 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将___________ (填“偏大”“偏小”或“不变”)。
②样品中砷的质量分数为___________ 。
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因___________ 。
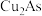 和
和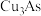 )和废水车间产生的含砷废渣(主要成分为
)和废水车间产生的含砷废渣(主要成分为 )中回收铜和砷的一种流程示意图如下。
)中回收铜和砷的一种流程示意图如下。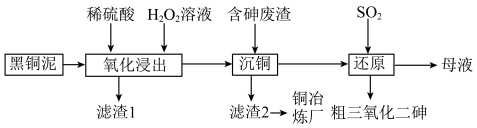
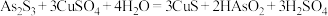 ;
;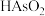 易分解生成微溶于水的
易分解生成微溶于水的 ;随着硫酸浓度的增大,
;随着硫酸浓度的增大, 在硫酸溶液中的溶解度变小。
在硫酸溶液中的溶解度变小。(1)升温能加快氧化浸出的速率。温度过高时,浸出速率反而会下降,原因是
(2)
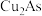 和
和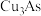 被氧化为
被氧化为 和
和 。
。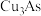 被氧化的离子方程式为
被氧化的离子方程式为(3)沉铜前,需要对氧化浸出液进行稀释。稀释倍数对沉铜的影响如下图所示。
(4)上述流程中可循环使用的物质是
(5)粗三氧化二砷中砷含量的测定。
ⅰ.取0.1g样品于锥形瓶中,加入NaOH溶液,使样品完全溶解;
ⅱ.加入适量乙酸铅溶液,消除-2价硫的干扰;
ⅲ.用稀硫酸调pH=8,加入3g碳酸氢钠和少量淀粉溶液;
ⅳ.用
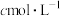 碘标准溶液(溶质按
碘标准溶液(溶质按 计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。
计)滴定,将砷氧化至最高价态。到达滴定终点时,消耗碘标准溶液VmL。已知:样品中砷只以+3价的形式存在。
①若样品中有-2价硫,没有步骤ⅱ,测定结果将
②样品中砷的质量分数为
③步骤ⅲ中加入碳酸氢钠,能保持滴定过程中溶液pH基本稳定,结合化学用语解释原因
您最近一年使用:0次
解题方法
7 . 某化学小组探究硫酸铁铵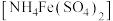 与
与 、
、 的反应。
的反应。
已知: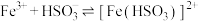 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
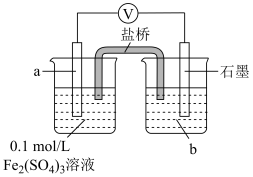
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
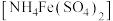 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入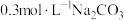 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入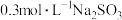 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
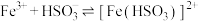 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL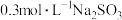 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL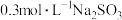 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
8 . 以 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
资料:i.水溶液中: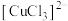 呈无色;
呈无色;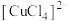 呈黄色;
呈黄色; 呈棕色。
呈棕色。
ii. ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。
将等体积的溶液a分别加到等量铜粉中,实验记录如下:
(1)Ⅰ中产生白色沉淀的离子方程式是____________ 。
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将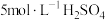 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。
依据电极反应式,分析产生 的原因
的原因____________ 。
②Ⅱ中溶液变为黄色,用离子方程式解释可能原因____________ 。
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1: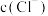 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因____________ 。
②假设2: 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。
实验验证:______ (填操作和现象),证实假设2不合理。
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因______ 。
(5)结合现象和化学反应原理解释选择 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因____________ 。
 溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。
溶液、浓盐酸为腐蚀液,能将覆铜板上不需要的铜腐蚀。某小组对此反应过程进行探究。资料:i.水溶液中:
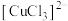 呈无色;
呈无色;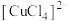 呈黄色;
呈黄色; 呈棕色。
呈棕色。ii.
 ;CuCl为白色固体,难溶于水。
;CuCl为白色固体,难溶于水。将等体积的溶液a分别加到等量铜粉中,实验记录如下:
实验 | 溶液a | 现象 |
Ⅰ |  溶液( 溶液( ) ) | 产生白色沉淀,溶液蓝色变浅,5h时铜粉剩余 |
Ⅱ | 浓盐酸(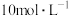 ) ) | 产生无色气泡,溶液无色;继而溶液变为黄色;较长时间后溶液变为棕色,5h时铜粉剩余 |
Ⅲ |  溶液( 溶液( )和浓盐酸( )和浓盐酸(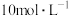 ) ) | 溶液由黄绿色变为棕色,无气泡;随着反应进行,溶液颜色变浅,后接近于无色,5h时铜粉几乎无剩余 |
(1)Ⅰ中产生白色沉淀的离子方程式是
(2)对于实验Ⅱ的现象进行分析。
①经检验Ⅱ中气体为
 。分析气体产生的原因,进行实验:将
。分析气体产生的原因,进行实验:将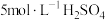 溶液加到铜粉中,溶液慢慢变蓝,未检测到
溶液加到铜粉中,溶液慢慢变蓝,未检测到 。
。依据电极反应式,分析产生
 的原因
的原因②Ⅱ中溶液变为黄色,用离子方程式解释可能原因
(3)对比实验Ⅰ、Ⅲ,分析实验Ⅲ中将溶液a加到铜粉中未产生白色沉淀的原因。
①假设1:
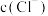 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:取Ⅰ中洗涤后的沉淀,加入饱和NaCl溶液,白色沉淀溶解。结合平衡移动原理解释沉淀溶解的原因
②假设2:
 增大,白色沉淀不能稳定存在。
增大,白色沉淀不能稳定存在。实验验证:
(4)实验Ⅱ、Ⅲ对比,实验Ⅱ中产生气泡,实验Ⅲ中无气泡。分析可能原因
(5)结合现象和化学反应原理解释选择
 与浓盐酸的混合液而不单独选择
与浓盐酸的混合液而不单独选择 溶液或浓盐酸做腐蚀液的原因
溶液或浓盐酸做腐蚀液的原因
您最近一年使用:0次
解题方法
9 . 废电池中含磷酸铁锂,提锂后的废渣主要含 、
、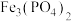 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。 、
、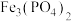 均难溶于水。
均难溶于水。
ii.将 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。
(1)酸浸前,将废渣粉碎的目的是________ 。
(2)从平衡移动的角度解释加入硝酸溶解 的原因:
的原因:________ 。
(3)在酸浸液中加入 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中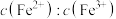 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用:________ 。 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:________ 。
(5)过滤得到电池级 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有________ 。
(6)磷酸铁锂-石墨电池的总反应: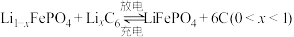 。
。
①高温条件下, 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是________ 。
②放电时负极的电极反应式是________ 。
 、
、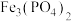 和金属铝等,以废渣为原料制备电池级
和金属铝等,以废渣为原料制备电池级 的一种工艺流程如下。
的一种工艺流程如下。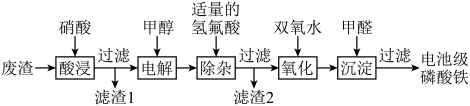
 、
、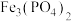 均难溶于水。
均难溶于水。ii.将
 转化为
转化为 有利于更彻底除去
有利于更彻底除去 。
。(1)酸浸前,将废渣粉碎的目的是
(2)从平衡移动的角度解释加入硝酸溶解
 的原因:
的原因:(3)在酸浸液中加入
 进行电解,电解原理的示意图如下图所示,电解过程中
进行电解,电解原理的示意图如下图所示,电解过程中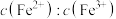 不断增大。结合电极反应说明
不断增大。结合电极反应说明 在电解中的作用:
在电解中的作用: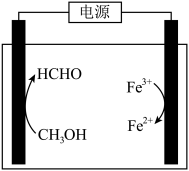
 。向“氧化”后的溶液中加入HCHO,加热,产生NO和
。向“氧化”后的溶液中加入HCHO,加热,产生NO和 ,当液面上方不再产生红棕色气体时,静置一段时间,产生
,当液面上方不再产生红棕色气体时,静置一段时间,产生 沉淀。阐述此过程中HCHO的作用:
沉淀。阐述此过程中HCHO的作用:(5)过滤得到电池级
 后,滤液中主要的金属阳离子有
后,滤液中主要的金属阳离子有(6)磷酸铁锂-石墨电池的总反应:
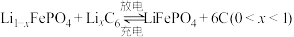 。
。①高温条件下,
 、葡萄糖(
、葡萄糖( )和
)和 可制备电极材料
可制备电极材料 ,同时生成CO和
,同时生成CO和 ,反应的化学方程式是
,反应的化学方程式是②放电时负极的电极反应式是
您最近一年使用:0次
解题方法
10 . 从电子废料(含Au、Ag和Cu等)中可回收金,主要流程如下: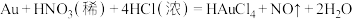
下列说法不正确 的是
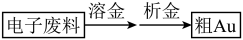
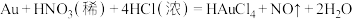
下列说法
A.浓盐酸促进了Au和 的反应,其原因是降低了 的反应,其原因是降低了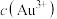 ,增强了Au的还原性 ,增强了Au的还原性 |
B.依据王水溶金原理,NaCN饱和溶液与 也可使Au溶解 也可使Au溶解 |
C. 可实现析金发生反应: 可实现析金发生反应: |
D.以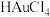 为电解质进行粗金的电解精炼,可能会有AgCl覆盖在阴极发生钝化 为电解质进行粗金的电解精炼,可能会有AgCl覆盖在阴极发生钝化 |
您最近一年使用:0次