名校
1 . NaCl是一种化工原料,可以制备多种物质,如下图所示。

请根据以上转化关系填写下列空白。
(1)写出反应①的离子方程式:___________ ,该反应中氧化产物与还原产物的质量比为___________ 。
(2)反应②可用于制取漂白粉,写出化学反应方程式并用双线桥法标出电子转移的方向和数目:___________ ;漂白粉需要密封保存,其原因是___________ (用化学方程式表示)
(3)反应③是侯氏制碱法的核心反应,写出化学反应方程式:___________ ;侯氏制碱法将___________ 和___________ 联合起来,也称联合制碱法。

请根据以上转化关系填写下列空白。
(1)写出反应①的离子方程式:
(2)反应②可用于制取漂白粉,写出化学反应方程式并用双线桥法标出电子转移的方向和数目:
(3)反应③是侯氏制碱法的核心反应,写出化学反应方程式:
您最近一年使用:0次
2024-01-01更新
|
115次组卷
|
2卷引用:湖北省荆州中学2023-2024学年高一上学期期中考试化学试题
名校
2 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)日常使用的金属材料,大多数属于合金。合金有许多优良的物理、化学或机械性能。生活中比较常见的合金有___________ (填写一类即可,下同)。近年来,为满足某些尖端技术发展的需要,人们有设计和合成了许多新型合金,例如:___________ 。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式: )的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
)的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:

①葡萄糖的摩尔质量为___________ 。
②该注射液中葡萄糖的物质的量浓度为___________ (保留两位小数)
(3)某饮用矿泉水中,测得含有 、
、 、
、 、
、 和
和 五种主要离子(不考虑溶液中少量的
五种主要离子(不考虑溶液中少量的 和
和 或其他离子),其中
或其他离子),其中 :
: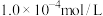 ,
, :
: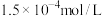 ,
, :
: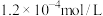 ,
, :
: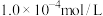 ,则溶液中
,则溶液中 的物质的量浓度是
的物质的量浓度是______  。
。
(4)水是万物之源,为探究高铁酸钾(化学式为: )在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
)在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:___________ 。
(1)日常使用的金属材料,大多数属于合金。合金有许多优良的物理、化学或机械性能。生活中比较常见的合金有
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式:
 )的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
)的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
(3)某饮用矿泉水中,测得含有
 、
、 、
、 、
、 和
和 五种主要离子(不考虑溶液中少量的
五种主要离子(不考虑溶液中少量的 和
和 或其他离子),其中
或其他离子),其中 :
: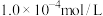 ,
, :
: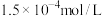 ,
, :
: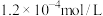 ,
, :
: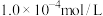 ,则溶液中
,则溶液中 的物质的量浓度是
的物质的量浓度是 。
。(4)水是万物之源,为探究高铁酸钾(化学式为:
 )在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
)在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
您最近一年使用:0次
2023-12-21更新
|
94次组卷
|
2卷引用:湖北省云学联盟2023-2024学年高一上学期12月月考化学试题
名校
解题方法
3 . 向KIO3的溶液中,通入H2S发生反应后,生产碘单质、硫酸钾、硫酸和水,在此反应中氧化剂和还原剂的数量比为:
| A.4:5 | B.8:5 | C.5:8 | D.5:4 |
您最近一年使用:0次
名校
解题方法
4 . 下图是自然界中的氮循环过程。下列有关叙述错误的是


| A.反应①、反应②及工业合成氨均属于氮的固定 |
B.反应④中,生成 至少需要提供 至少需要提供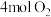 |
C.反应③的反应方程式为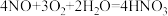 |
| D.过程中参与循环的元素有氮元素,还有氢和氧元素 |
您最近一年使用:0次
2023-12-08更新
|
284次组卷
|
3卷引用:湖北省十一校2023-2024学年高三上学期第一次联考化学试题
5 . 黄铁矿与焦炭充分混合( 与C的质量比为
与C的质量比为 ),在有限量的空气中缓慢燃烧,结果可得到硫磺,过程中可能发生的反应之一为:
),在有限量的空气中缓慢燃烧,结果可得到硫磺,过程中可能发生的反应之一为: 。下列有关说法不正确的是。
。下列有关说法不正确的是。
 与C的质量比为
与C的质量比为 ),在有限量的空气中缓慢燃烧,结果可得到硫磺,过程中可能发生的反应之一为:
),在有限量的空气中缓慢燃烧,结果可得到硫磺,过程中可能发生的反应之一为: 。下列有关说法不正确的是。
。下列有关说法不正确的是。A. 晶体中存在非极性共价键 晶体中存在非极性共价键 |
B.当有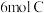 参加反应时,共转移 参加反应时,共转移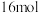 电子 电子 |
C. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
D.当有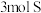 生成时,有 生成时,有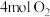 被焦炭还原 被焦炭还原 |
您最近一年使用:0次
2023-12-06更新
|
225次组卷
|
5卷引用:湖北省沙市中学2024届高三下学期模拟预测化学试题
湖北省沙市中学2024届高三下学期模拟预测化学试题浙江省金丽衢十二校2023-2024学年高三上学期联考模拟预测化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省四校联考2023-2024学年高二下学期3月月考化学试题(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
6 . 氯气( )是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:
)是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:
Ⅰ.实验室制备84消毒液.

(1)装置甲中盛放高锰酸钾的仪器名称是______ ,装置甲中反应的离子方程式为______ .
(2)装置乙的作用是______ .
(3)装置丙中制备次氯酸钠为放热反应,该反应需要控制温度在40℃以下,写出一种(除搅拌外)控制该反应温度的操作方法______ .
Ⅱ.氯气的应用
(4)可用 和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是
和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是______ .(填化学式)
(5)向KI溶液滴加过量氯水会生成 ,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:
,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:_________

(6) 是次氯酸的酸酐,其制备方法之一是将
是次氯酸的酸酐,其制备方法之一是将 通入HgO中即可制得,同时生成
通入HgO中即可制得,同时生成 .请写出对应的化学方程式并用双线桥表示电子的转移:
.请写出对应的化学方程式并用双线桥表示电子的转移:______ .
 )是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:
)是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等,例如日常生活用品84消毒液.84消毒液是常用消毒剂,某化学兴趣小组在实验室利用氯气制备84消毒液,请回答下列问题:Ⅰ.实验室制备84消毒液.

(1)装置甲中盛放高锰酸钾的仪器名称是
(2)装置乙的作用是
(3)装置丙中制备次氯酸钠为放热反应,该反应需要控制温度在40℃以下,写出一种(除搅拌外)控制该反应温度的操作方法
Ⅱ.氯气的应用
(4)可用
 和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是
和冷的石灰乳反应制备漂白粉,漂白粉中的有效成分是(5)向KI溶液滴加过量氯水会生成
 ,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:
,发生反应的离子方程式如下,请补全产物,并将离子方程式配平:
(6)
 是次氯酸的酸酐,其制备方法之一是将
是次氯酸的酸酐,其制备方法之一是将 通入HgO中即可制得,同时生成
通入HgO中即可制得,同时生成 .请写出对应的化学方程式并用双线桥表示电子的转移:
.请写出对应的化学方程式并用双线桥表示电子的转移:
您最近一年使用:0次
2023-12-04更新
|
79次组卷
|
3卷引用:湖北省宜昌市三峡高级中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
7 . 化合物 (结构简式为
(结构简式为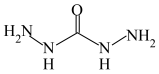 )是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为
)是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为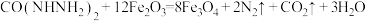 。下列说法正确的是
。下列说法正确的是
 (结构简式为
(结构简式为 )是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为
)是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为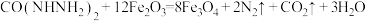 。下列说法正确的是
。下列说法正确的是| A.该反应是熵减过程 |
B. 可写成 可写成 ,属于混合物 ,属于混合物 |
| C.反应中C、N元素均被氧化 |
D.每生成 ,反应中转移 ,反应中转移 电子 电子 |
您最近一年使用:0次
2023-12-02更新
|
261次组卷
|
5卷引用:湖北省九师联盟2024届高三11月质检化学试题
湖北省九师联盟2024届高三11月质检化学试题贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题河南省部分名校2023-2024学年高三上学期11月期中化学试题江西省部分地区2023-2024学年高三上学期11月期中化学试题(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
解题方法
8 . 水是生命之源,保护水资源人人有责。
Ⅰ.高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法是:在强碱性条件下,NaClO溶液和FeCl3溶液反应生成高铁酸钠和氯化钠。
(1)高铁酸钠中铁元素的化合价为_______ 。
(2)反应中高铁酸钠是_______ 产物(填“氧化”或“还原”)。
(3)写出制备高铁酸钠的离子方程式_______ 。
(4)使用氯气对自来水消毒时,氯气与水中的有机物反应生成对人体有害的物质,人们开始使用新的自来水消毒剂,如氯元素的某种氧化物,写出这种新消毒剂的名称_______ 。
Ⅱ.工业酸性废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O 转化为Cr3+。
转化为Cr3+。
(5)绿矾是结晶水合物,风化是指在室温和干燥的空气里,结晶水合物失去结晶水的现象,则风化属于_______ 变化(填“物理”或“化学”)。
(6)在溶液中Cr2O 存在反应:Cr2O
存在反应:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+,该反应
+2H+,该反应_______ 氧化还原反应(填“属于”或“不属于”)。
(7)写出处理工业酸性废水时发生反应的离子方程式_______ 。
Ⅰ.高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法是:在强碱性条件下,NaClO溶液和FeCl3溶液反应生成高铁酸钠和氯化钠。
(1)高铁酸钠中铁元素的化合价为
(2)反应中高铁酸钠是
(3)写出制备高铁酸钠的离子方程式
(4)使用氯气对自来水消毒时,氯气与水中的有机物反应生成对人体有害的物质,人们开始使用新的自来水消毒剂,如氯元素的某种氧化物,写出这种新消毒剂的名称
Ⅱ.工业酸性废水中含有的重铬酸根离子(Cr2O
 )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,将Cr2O 转化为Cr3+。
转化为Cr3+。(5)绿矾是结晶水合物,风化是指在室温和干燥的空气里,结晶水合物失去结晶水的现象,则风化属于
(6)在溶液中Cr2O
 存在反应:Cr2O
存在反应:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+,该反应
+2H+,该反应(7)写出处理工业酸性废水时发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
9 . 请按照要求用对应的化学术语回答下列问题。
(1) 是一种酸式盐,请写出
是一种酸式盐,请写出 在水中的电离方程式
在水中的电离方程式___________ 。
(2)将饱和 溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为
溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为___________ 。
(3) 可以作为供氧剂,其与
可以作为供氧剂,其与 反应时若生成标准状况下11.2L
反应时若生成标准状况下11.2L  ,则电子转移数目为
,则电子转移数目为___________ 。
(4) 溶于水可以产生具有漂白性的物质,
溶于水可以产生具有漂白性的物质, 与水反应的离子方程式为:
与水反应的离子方程式为:___________ 。
(5)某温度下将 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11∶1,则
的个数之比为11∶1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(6)在标准状况下,将V L氨气溶于0.1L水中,所得溶液的密度为 ,则此氨水的物质的量浓度为
,则此氨水的物质的量浓度为___________  。
。
(1)
 是一种酸式盐,请写出
是一种酸式盐,请写出 在水中的电离方程式
在水中的电离方程式(2)将饱和
 溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为
溶液滴入到沸水中,继续煮沸至液体变为红褐色,反应的离子方程式为(3)
 可以作为供氧剂,其与
可以作为供氧剂,其与 反应时若生成标准状况下11.2L
反应时若生成标准状况下11.2L  ,则电子转移数目为
,则电子转移数目为(4)
 溶于水可以产生具有漂白性的物质,
溶于水可以产生具有漂白性的物质, 与水反应的离子方程式为:
与水反应的离子方程式为:(5)某温度下将
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11∶1,则
的个数之比为11∶1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(6)在标准状况下,将V L氨气溶于0.1L水中,所得溶液的密度为
 ,则此氨水的物质的量浓度为
,则此氨水的物质的量浓度为 。
。
您最近一年使用:0次
解题方法
10 . 锑( )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:

已知:①水合肼为 ,有很强的还原性;
,有很强的还原性;
② 在碱性条件下易转化为
在碱性条件下易转化为 ;
;
③常温下, 的溶解度为
的溶解度为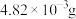 ,
, 的溶解度为0.79g。
的溶解度为0.79g。
回答下列问题:
(1) 的电子式为
的电子式为_______ 。
(2)脱氯渣的主要成分有 、
、 、
、 和
和_______ 。
(3)“还原脱氯”过程中会产生无色无味无毒气体,则 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(4)“氧化分银”中,不直接用硝酸的原因是_______ 。
(5)“氧化分银”中,银被氧化的离子方程式为_______ 。
(6)“沉铅过滤”中主要析出 的原因是
的原因是_______ 。
(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。
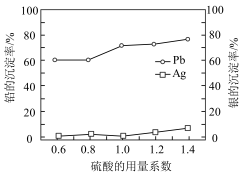
硫酸的用量系数最佳选择是_______ ,理由是_______ 。
 )冶炼过程中产生的副产物主要成分为
)冶炼过程中产生的副产物主要成分为 、
、 、
、 和
和 等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
等,因含银量很高,是重要的银提取原料。从该副产物中提取银的工艺流程如下:
已知:①水合肼为
 ,有很强的还原性;
,有很强的还原性;②
 在碱性条件下易转化为
在碱性条件下易转化为 ;
;③常温下,
 的溶解度为
的溶解度为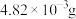 ,
, 的溶解度为0.79g。
的溶解度为0.79g。回答下列问题:
(1)
 的电子式为
的电子式为(2)脱氯渣的主要成分有
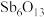 、
、 、
、 和
和(3)“还原脱氯”过程中会产生无色无味无毒气体,则
 发生反应的化学方程式为
发生反应的化学方程式为(4)“氧化分银”中,不直接用硝酸的原因是
(5)“氧化分银”中,银被氧化的离子方程式为
(6)“沉铅过滤”中主要析出
 的原因是
的原因是(7)“沉铅过滤”中硫酸的用量系数对铅和银的沉淀率影响如图所示。

硫酸的用量系数最佳选择是
您最近一年使用:0次



