解题方法
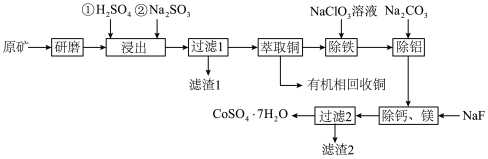
1 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知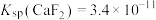 ,
,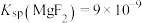 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中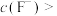
___________  。
。
(6)由“过滤2”后的母液得到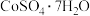 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
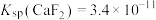 ,
,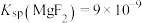 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中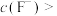
 。
。(6)由“过滤2”后的母液得到
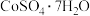 的操作是
的操作是
您最近一年使用:0次
名校
解题方法
2 . 水中溶解的氧气高温下对锅炉有很强的腐蚀性,可以用联氨(N2H4)处理锅炉水中的溶解氧。其中一种反应机理如图所示。下列说法错误的是

| A.联氨(N2H4)易溶于水,所得溶液中存在四种氢键 |
| B.稳定性:H2O2<N2H4,是因为H2O2分子中孤电子对较多 |
C.①中发生的反应为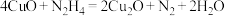 |
D.该过程中产生的氮气和消耗的氧气之比为: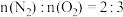 |
您最近一年使用:0次
2024-04-05更新
|
174次组卷
|
2卷引用:湖北省云学名校联盟2023-2024学年高二下学期3月联考化学试卷
解题方法
3 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
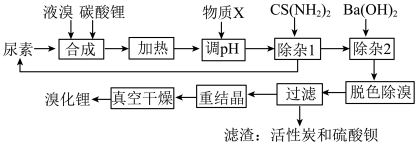
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
365次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
4 . 日常生活中使用多种杀菌消毒剂,它们用于杀灭细菌、病毒和其他有害微生物,从而维护卫生和健康。下列试剂不是常用杀菌消毒剂的是
| A.次氯酸钠 | B.高锰酸钾 | C.双氧水 | D.对氨基苯甲酸 |
您最近一年使用:0次
2024-04-02更新
|
275次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
解题方法
5 . 丙烷催化氧化是制备丙烯的常见方法,如图为采用羰基催化剂催化氧化丙烷的机理,下列说法正确的是

| A.该机理中,有非极性键的断裂.无非极性键的形成 |
| B.羰基催化剂的活性温度高 |
C.若 参与反应,最终催化剂中含有 参与反应,最终催化剂中含有 |
D.理论上消耗1mol 可制得2mol 可制得2mol |
您最近一年使用:0次
2024-03-31更新
|
390次组卷
|
4卷引用:2024届湖北省武汉市黄陂区第七高级中学高三下学期一模化学试题
2024届湖北省武汉市黄陂区第七高级中学高三下学期一模化学试题 2024届湖南省九校联考高三下学期二模考试化学试题(已下线)压轴题04?化学反应机理、历程、能垒图分析(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)单项选择题6-10
名校
解题方法
6 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: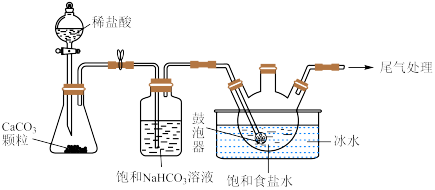
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
291次组卷
|
5卷引用:湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
7 . 某制药厂的废钯催化剂含 、
、 、
、 、
、 、
、 和活性炭,提取贵金属
和活性炭,提取贵金属 的流程如下:
的流程如下:
②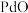 性质较稳定,难溶于酸、碱,可溶于王水;
性质较稳定,难溶于酸、碱,可溶于王水;
③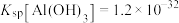 、
、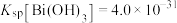 。
。
回答下列问题:
(1)“焙烧”步骤的主要目的是除去活性炭,通常控制温度600℃、焙烧时间约 ,焙烧温度过高或时间过长均导致钯浸出率降低,原因是
,焙烧温度过高或时间过长均导致钯浸出率降低,原因是_____________ 。
(2)“浸渣”的成分是少量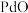 及
及______ 。
(3)“浸出”步骤中生成配合物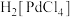 ,写出该反应的化学方程式
,写出该反应的化学方程式______ 。
(4)“氨化”步骤中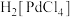 转化为
转化为 ,反应后溶液
,反应后溶液 ,此时溶液中
,此时溶液中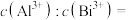
___________ 。
(5)“沉钯”步骤中的离子方程式为_____ 。
(6) 存在两种平面结构,将其记为A和B。查得25℃时A、B在水中的溶解度分别为0.2577g、0.0366g,A具有广谱的抗癌活性,写出A的结构式
存在两种平面结构,将其记为A和B。查得25℃时A、B在水中的溶解度分别为0.2577g、0.0366g,A具有广谱的抗癌活性,写出A的结构式__________ ( 中共价键不必画出)。
中共价键不必画出)。
 、
、 、
、 、
、 、
、 和活性炭,提取贵金属
和活性炭,提取贵金属 的流程如下:
的流程如下:
②
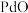 性质较稳定,难溶于酸、碱,可溶于王水;
性质较稳定,难溶于酸、碱,可溶于王水;③
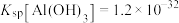 、
、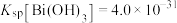 。
。回答下列问题:
(1)“焙烧”步骤的主要目的是除去活性炭,通常控制温度600℃、焙烧时间约
 ,焙烧温度过高或时间过长均导致钯浸出率降低,原因是
,焙烧温度过高或时间过长均导致钯浸出率降低,原因是(2)“浸渣”的成分是少量
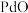 及
及(3)“浸出”步骤中生成配合物
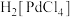 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)“氨化”步骤中
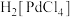 转化为
转化为 ,反应后溶液
,反应后溶液 ,此时溶液中
,此时溶液中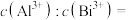
(5)“沉钯”步骤中的离子方程式为
(6)
 存在两种平面结构,将其记为A和B。查得25℃时A、B在水中的溶解度分别为0.2577g、0.0366g,A具有广谱的抗癌活性,写出A的结构式
存在两种平面结构,将其记为A和B。查得25℃时A、B在水中的溶解度分别为0.2577g、0.0366g,A具有广谱的抗癌活性,写出A的结构式 中共价键不必画出)。
中共价键不必画出)。
您最近一年使用:0次
2024-03-29更新
|
554次组卷
|
3卷引用:湖北省圆创联盟2024届高三三月联合测评(一模)化学试卷
解题方法
8 . 草酸钴主要用作制氧化钴的原料,也可用于制取其他钴化合物。利用废料铝钴膜(含有LiCoO2、Al、Fe)制备草酸钴的工艺如下:
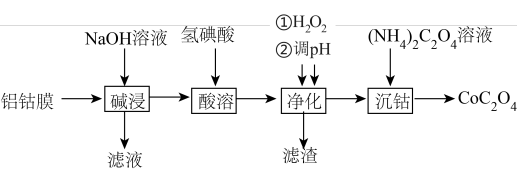
已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
(1)钴酸锂LiCoO2中钴元素的化合价为__________ 。
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式__________ 。
(3)“酸溶”过程LiCoO2发生反应的离子方程式为__________ 。
(4)“净化”过程加入H2O2的目的是__________ 。
(5)调节pH的范围是__________ ,滤渣的成分是__________ (填化学式)。
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法__________ 。

已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
| Fe2+ | Fe3+ | Al3+ | Co2+ | |
| 沉淀开始的pH | 6.5 | 1.5 | 3.3 | 6.6 |
| 沉淀完全的pH | 9.7 | 3.2 | 4.7 | 9.2 |
(1)钴酸锂LiCoO2中钴元素的化合价为
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式
(3)“酸溶”过程LiCoO2发生反应的离子方程式为
(4)“净化”过程加入H2O2的目的是
(5)调节pH的范围是
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法
您最近一年使用:0次
名校
9 .  是重要的化工原料,下列流程涉及
是重要的化工原料,下列流程涉及 的制备与用途。有关说法正确的是
的制备与用途。有关说法正确的是
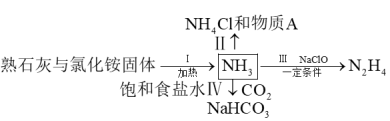
 是重要的化工原料,下列流程涉及
是重要的化工原料,下列流程涉及 的制备与用途。有关说法正确的是
的制备与用途。有关说法正确的是
| A.过程Ⅰ中,实验室制氨可用氢氧化钠代替熟石灰 |
| B.过程Ⅱ中,物质A是一种高效氮肥 |
| C.过程Ⅲ中,参加反应的氧化剂与还原剂的物质的量之比为2:1 |
D.过程Ⅳ中,反应的离子方程式为: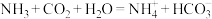 |
您最近一年使用:0次
名校
10 .  与
与 在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法
在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法错误 的是
 与
与 在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法
在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法| A.NO为极性分子 |
| B.H2S的VSEPR模型为三角锥形 |
C.HSNO的结构式为 |
| D.NO与H2S反应生成的两种单质为S、N2 |
您最近一年使用:0次
2024-03-14更新
|
288次组卷
|
3卷引用:湖北省武汉市洪山高级中学2024届高三下学期第 2次模拟考试化学试卷



