名校
解题方法
1 . 某化学兴趣小组为探究酸性高锰酸钾与铜的反应,设计实验如下,在培养皿中加入足量的酸性高锰酸钾溶液,放入铜珠,实验结果如下:
已知: 在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: ,下列说法正确的是
,下列说法正确的是
| 实验 | 现象 |
 | 一段时间后,培养皿中由铜珠向外侧依次呈现: Ⅰ区澄清且紫色褪色明显 Ⅱ区底部覆盖棕黑色固体 Ⅲ区澄清且紫色变浅 |
 在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: ,下列说法正确的是
,下列说法正确的是A.Ⅰ区铜反应后的主要产物,可能是 、也可能是 、也可能是 |
B.Ⅱ区棕黑色固体是 ,由铜和酸性高锰酸钾反应产生 ,由铜和酸性高锰酸钾反应产生 |
C.Ⅲ区紫色变浅说明在Ⅲ区 也发生了氧化还原反应 也发生了氧化还原反应 |
D.如果酸性高锰酸钾大大过量,所有反应完全后,产物中可能没有 |
您最近一年使用:0次
2021-08-23更新
|
1788次组卷
|
10卷引用:湖北省武汉市洪山高级中学2021-2022高一上学期9月月考化学试题
湖北省武汉市洪山高级中学2021-2022高一上学期9月月考化学试题北京市十一学校2022 届高三上学期开学考试(暑期学习检测)化学试题湖南省长沙市第一中学2021-2022高一上学期第一次月考化学试卷河南省濮阳市第一高级中学2021-2022学年高一上学期期中化学(B)试题河北省衡水市2021-2022学年高三上学期三调化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2022年湖南卷高考真题变式题(11-14)甘肃省张掖市高台县第一中学2022-2023学年高三上学期第三次检测化学试题(已下线)易错点3对实验原理分析不透彻而出错福建省厦门第六中学2023-2024学年高一上学期1月月考化学试题
名校
2 . 下列变化或应用中,与氧化还原反应无关 的是
| A.饱和(NH4)2SO4溶液中加入少量鸡蛋清变浑浊 |
| B.油酸甘油酯通过氢化反应变为硬脂酸甘油酯 |
| C.切开土豆、苹果,在空气中放置一段时间后变色 |
| D.食用补铁剂(含琥珀酸亚铁)时常与维生素C同服 |
您最近一年使用:0次
2021-08-17更新
|
627次组卷
|
4卷引用:湖北武汉市2022届高三5月第一次模拟考试化学试题
名校
3 . 磷化氢(PH3)是一种在空气中能自燃的剧毒气体,具有还原性,可作为电子工业原料。PH3的一种工业制法流程如下:
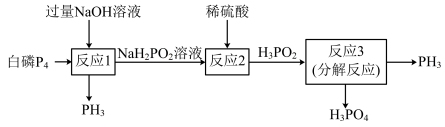
| A.H3PO2为一元弱酸 |
| B.该过程最好在无氧条件下进行 |
| C.不考虑损失,1 mol P4参与反应,可产生2.5 mol PH3 |
| D.反应1中氧化产物和还原产物的物质的量之比为1︰3 |
您最近一年使用:0次
2021-07-20更新
|
1064次组卷
|
12卷引用:湖北省十堰市郧阳中学2023届高三11月月考化学训练题
湖北省十堰市郧阳中学2023届高三11月月考化学训练题重庆市第十一中学校2021届高三下学期4月二诊化学试题山东省师范大学附属中学2022届高三上学期开学考试化学试题(已下线)基础卷05-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)2022年山东省高考真题变式题(单选题)四川省成都市石室中学2021-2022学年高二下学期4月月考试化学试题河南省许昌市高级中学2022-2023学年高三上半年第一次模拟考试化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)巩固训练13福建省福州市闽侯县第一中学2023-2024学年高一下学期3月月考化学试题
解题方法
4 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等有很广泛的应用,可利用Ca(HS)2与CaCN2合成得到。查阅资料:①CS(NH2)2易溶于水;②CS(NH2)2在150℃时生成NHSCN;③CS(NH2)2易被强氧化剂氧化。请回答下列问题:
(1)制备Ca(HS)2溶液

①装置A中发生反应的离子方程式为_______ ;
②装置B中盛装的试剂是_______ ;
③装置C中长直导管的作用是_______ ,当C中出现_______ 现象时,可停止反应。
(2)制备硫脲[CS(NH2)2]。将得到的Ca(HS)2溶液与CaCN2溶液混合,加热至80℃,反应一段时间即可生成硫脲,同时生成一种强碱_______ ,合适的加热方式是_______ 。
(3)硫脲的定量测定。用酸性高锰酸钾溶液滴定硫脲,生成N2, 等,则氧化剂与还原剂的物质的量之比为
等,则氧化剂与还原剂的物质的量之比为_______ ;将硫脲粗产品0.4g,配成500mL溶液,取50mL,用0.1mol/L酸性高锰酸钾溶液滴定,消耗酸性高锰酸钾14.00mL,粗产品中硫脲的含量为_______ (杂质不参加反应)。
(1)制备Ca(HS)2溶液

①装置A中发生反应的离子方程式为
②装置B中盛装的试剂是
③装置C中长直导管的作用是
(2)制备硫脲[CS(NH2)2]。将得到的Ca(HS)2溶液与CaCN2溶液混合,加热至80℃,反应一段时间即可生成硫脲,同时生成一种强碱
(3)硫脲的定量测定。用酸性高锰酸钾溶液滴定硫脲,生成N2,
 等,则氧化剂与还原剂的物质的量之比为
等,则氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解题方法
5 . 由于6s2惰性电子对效应,金Au、汞Hg、铊TI、铅Pb、铋Bi的最稳定氧化态分别为-1,0,+1,+2,+3.下 列说法正确的是
| A.根据这个规律,人们制出负一价的金的化合物CsAu |
B.与汞同族锌镉为较活泼金属而汞为不活泼金属,且对于+1氧化态,Hg倾向于形成Hg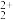 |
| C.二氧化铅氧化性很强,可和浓盐酸反应制取氯气PbO2 + 4HCl(浓) = PbCl2+ Cl2↑+ 2H2O |
D.铋酸钠与硫酸锰反应的离子方程式5NaBiO3+ 2Mn2++ 14H+ = 5Bi3++ 2MnO + 5Na++ 7H2O + 5Na++ 7H2O |
您最近一年使用:0次
6 . 化工生产中用次磷酸钠(NaH2PO2)代替甲醛的化学镀铜体系以其pH低、稳定性好、无毒性等优点而受到人们的广泛关注,化学反应原理为CuSO4+ 2NaH2PO2+ 2NaOH = Cu + 2NaH2PO3+ Na2SO4+ H2↑。下列说法正确的是
| A.甲醛在化学镀铜体系中作有机溶剂 |
| B.NaH2PO2中 P元素的化合价为+1价 |
| C.已知H3PO2与足量NaOH反应只生成一种盐类产物,则NaH2PO2为酸式盐 |
| D.上述化学反应中,每转移1 mole-,生成H211.2L |
您最近一年使用:0次
名校
解题方法
7 . 下列关于元素及化合物的结构和性质的论述正确的是
A. 和 和 中的硫原子均采取 中的硫原子均采取 杂化的方式,都存在 杂化的方式,都存在 |
B.键长 ,因此三种氢化物中水最稳定 ,因此三种氢化物中水最稳定 |
C.碳化硅中 键的键长大于金刚石中 键的键长大于金刚石中 键的键长,因此碳化硅的熔点高于金刚石的熔点 键的键长,因此碳化硅的熔点高于金刚石的熔点 |
D. 的非金属性强于 的非金属性强于 ,因此 ,因此 能与 能与 溶液反应置换出 溶液反应置换出 |
您最近一年使用:0次
2021-07-12更新
|
354次组卷
|
4卷引用:一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)
(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)清华大学中学生标准学术能力诊断性测试2022届高三2021年7月诊断性测试化学试题(已下线)第37讲 分子结构与性质(精练)-2022年一轮复习讲练测新疆石河子第一中学2021-2022学年高二4月月考化学试题
8 . NSR技术( 的储存和还原在不同时段交替进行)可有效降低柴油和汽油发动机尾气中
的储存和还原在不同时段交替进行)可有效降低柴油和汽油发动机尾气中 的排放,其工作原理如下图。下列说法正确的是
的排放,其工作原理如下图。下列说法正确的是

 的储存和还原在不同时段交替进行)可有效降低柴油和汽油发动机尾气中
的储存和还原在不同时段交替进行)可有效降低柴油和汽油发动机尾气中 的排放,其工作原理如下图。下列说法正确的是
的排放,其工作原理如下图。下列说法正确的是
A.发动机尾气中的 来源于 来源于 和 和 的直接化合 的直接化合 |
B.还原阶段,参加反应的 、 、 、 、 的物质的量分别为amol,bmol,cmol,则有 的物质的量分别为amol,bmol,cmol,则有 |
C.存储阶段,Ba存储 的化学方程式为: 的化学方程式为: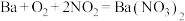 |
D.反应过程的总反应方程式为: |
您最近一年使用:0次
2021-07-07更新
|
151次组卷
|
2卷引用:湖北省襄阳市、宜昌市、荆州市、荆门市等七市2020-2021学年高二下学期期末考试化学试题
解题方法
9 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备 和
和 ,并探究其性质。
,并探究其性质。

回答下列问题:
(1) 的作用是
的作用是___________ 。
(2) 中发生反应的化学方程式是
中发生反应的化学方程式是___________ 。
(3) 中生成
中生成 的离子方程式是
的离子方程式是___________ 。
(4) 的作用是
的作用是___________ 。
(5)取少量 和
和 溶液分别置于①号和②号试管中,滴加
溶液分别置于①号和②号试管中,滴加 溶液。①号试管溶液颜色不变;②号试管溶液变为棕色,加入苯,振荡,静置后
溶液。①号试管溶液颜色不变;②号试管溶液变为棕色,加入苯,振荡,静置后___________ (填“上层”或“下层”)溶液显紫色。可知该条件下 的氧化能力
的氧化能力___________ (填“大于”或“小于”) 的氧化能力。
的氧化能力。
(6)反应结束后,取两等份 中溶液,第一份加入足量的
中溶液,第一份加入足量的 溶液,充分反应后,加入
溶液,充分反应后,加入 萃取;第二份加入足量的硫酸酸化的
萃取;第二份加入足量的硫酸酸化的 溶液,充分反应后加入
溶液,充分反应后加入 萃取。实验测得第一份与第二份得到的
萃取。实验测得第一份与第二份得到的 的物质的量之比为
的物质的量之比为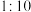 。则第二份生成
。则第二份生成 多的原因是
多的原因是___________ ;原反应后的 溶液中含氯的离子的物质的量浓度之比
溶液中含氯的离子的物质的量浓度之比
___________ (不考虑离子的水解)。
 和
和 ,并探究其性质。
,并探究其性质。
回答下列问题:
(1)
 的作用是
的作用是(2)
 中发生反应的化学方程式是
中发生反应的化学方程式是(3)
 中生成
中生成 的离子方程式是
的离子方程式是(4)
 的作用是
的作用是(5)取少量
 和
和 溶液分别置于①号和②号试管中,滴加
溶液分别置于①号和②号试管中,滴加 溶液。①号试管溶液颜色不变;②号试管溶液变为棕色,加入苯,振荡,静置后
溶液。①号试管溶液颜色不变;②号试管溶液变为棕色,加入苯,振荡,静置后 的氧化能力
的氧化能力 的氧化能力。
的氧化能力。(6)反应结束后,取两等份
 中溶液,第一份加入足量的
中溶液,第一份加入足量的 溶液,充分反应后,加入
溶液,充分反应后,加入 萃取;第二份加入足量的硫酸酸化的
萃取;第二份加入足量的硫酸酸化的 溶液,充分反应后加入
溶液,充分反应后加入 萃取。实验测得第一份与第二份得到的
萃取。实验测得第一份与第二份得到的 的物质的量之比为
的物质的量之比为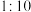 。则第二份生成
。则第二份生成 多的原因是
多的原因是 溶液中含氯的离子的物质的量浓度之比
溶液中含氯的离子的物质的量浓度之比
您最近一年使用:0次
解题方法
10 . “黑火药”是我国古代四大发明之一,其反应原理是 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.二氧化碳是含非极性键的共价化合物 | B.硝酸钾是含极性共价键的离子化合物 |
| C.上述反应中被还原的元素只有氮元素 | D.产生11.2L氮气时转移6mol电子 |
您最近一年使用:0次



