2023·全国·模拟预测
名校
解题方法
1 . 一种利用微生物从黄铜矿(主要成分为 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是

 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是
A.转化过程中 和 和 可以循环使用 可以循环使用 |
B.微生物的作用下, 作催化剂 作催化剂 |
C.若 中的铜元素最终全部转化为 中的铜元素最终全部转化为 ,当有2mol ,当有2mol 生成时,理论上消耗4.25mol 生成时,理论上消耗4.25mol |
D.在硫酸介质中用 替代 替代 也能高效实现将 也能高效实现将 氧化为 氧化为 |
您最近一年使用:0次
2023-04-11更新
|
392次组卷
|
5卷引用:内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷(已下线)化学押题卷(二)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题(已下线)选择题6-10
2 . I.图为含氯元素物质的“价类二维图”,请结合该图和所学知识完成下列问题。
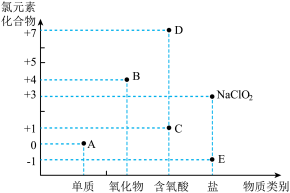
(1)D的电离方程式为_______
(2)A、B和 均可作为消毒剂。
均可作为消毒剂。
① 的消毒效率是A的
的消毒效率是A的_______ 倍(还原产物都是E,消毒效率以单位物质的量的物质得到的电子数表示)。
②B在杀菌消毒过程中会产生 ,需将
,需将 转化为E除去,下列试剂可实现转化的是
转化为E除去,下列试剂可实现转化的是_______ (填标号)。
a. b.
b. c.
c. d.
d.
(3)将 传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
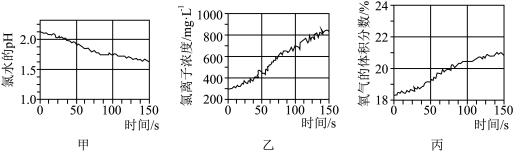
由图可推知,光照时发生的反应为_______ (写出化学方程式)。
II.实验室制取A并进一步制取无水 的实验装置如图所示。
的实验装置如图所示。
已知:无水 在空气中易与水发生作用,加热易升华。
在空气中易与水发生作用,加热易升华。
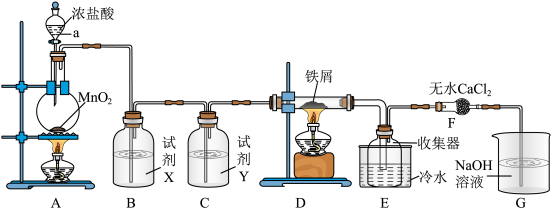
回答下列问题:
(4)仪器a的名称是_______ ,装置A所发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为_______ 。
(5)试剂X、试剂Y依次是_______ 、_______ 。
(6)装置F中无水 的作用是
的作用是_______
(7)某温度下,将氯气通入G装置中,反应得到 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______ 。

(1)D的电离方程式为
(2)A、B和
 均可作为消毒剂。
均可作为消毒剂。①
 的消毒效率是A的
的消毒效率是A的②B在杀菌消毒过程中会产生
 ,需将
,需将 转化为E除去,下列试剂可实现转化的是
转化为E除去,下列试剂可实现转化的是a.
 b.
b. c.
c. d.
d.
(3)将
 传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
由图可推知,光照时发生的反应为
II.实验室制取A并进一步制取无水
 的实验装置如图所示。
的实验装置如图所示。已知:无水
 在空气中易与水发生作用,加热易升华。
在空气中易与水发生作用,加热易升华。
回答下列问题:
(4)仪器a的名称是
(5)试剂X、试剂Y依次是
(6)装置F中无水
 的作用是
的作用是(7)某温度下,将氯气通入G装置中,反应得到
 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近一年使用:0次
解题方法
3 . 如图所示,向无色的 溶液中加入氯水,得到棕黄色溶液,下列说法不正确的是
溶液中加入氯水,得到棕黄色溶液,下列说法不正确的是

 溶液中加入氯水,得到棕黄色溶液,下列说法不正确的是
溶液中加入氯水,得到棕黄色溶液,下列说法不正确的是
| A.与氯水颜色相比较,溶液颜色发生变化,可证明已发生了反应 |
B.发生的氧化还原反应可表示为: |
C. 和 和 分子中都只含有非极性共价键 分子中都只含有非极性共价键 |
| D.该实验结果证明:氯元素的非金属性强于碘元素 |
您最近一年使用:0次
解题方法
4 . 我国锂云母矿石储量丰富,现有产自内蒙古的锂云母矿石(主要成分为SiO2·Al2O3·2(Li,K)(F,OH)],内含少量镁、钙、铁的氧化物),工业上欲采用硫酸法用其制备Li2CO3具体流程如下:
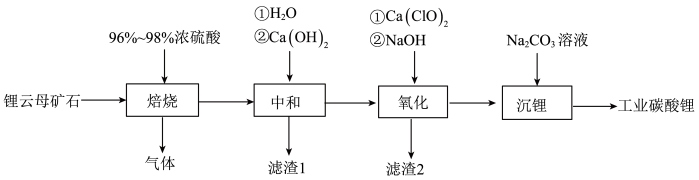
查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

Ⅱ.“焙烧”过程中铁的氧化物未参与反应
Ⅲ.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓) Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
Ⅳ.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:
(1)“焙烧”温度理论上选择_______ 为宜,同时为提高“焙烧”效率,还可采取的措施有_______ ;
(2)“焙烧”产生的气体可用NaOH溶液吸收,且元素化合价均不发生变化,该反应的化学方程式为_______ ;
(3)在“中和”过程中,为使Fe3+和Al3+完全沉淀,pH值至少调整为_______ ;部分金属氢氧化物的pKsp(pKsp=-lgKsp)如图所示:

(4)“中和”所得“滤渣1”中除氢氧化物沉淀外还含有_______ ;
(5)“氧化”过程中发生氧化还原反应的离子方程式为_______ ;
(6)“滤渣2”的主要成分是_______ ;
(7)工业上还可以通过“苛化反应”,利用Li2CO3(s)+Ca2+(aq) CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性
CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性_______ 。[已知Ksp(Li2CO3)=8.64×10-4;KspCaCO3)=2.5×10-9]

查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

Ⅱ.“焙烧”过程中铁的氧化物未参与反应
Ⅲ.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓)
 Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2OⅣ.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:
(1)“焙烧”温度理论上选择
(2)“焙烧”产生的气体可用NaOH溶液吸收,且元素化合价均不发生变化,该反应的化学方程式为
(3)在“中和”过程中,为使Fe3+和Al3+完全沉淀,pH值至少调整为

(4)“中和”所得“滤渣1”中除氢氧化物沉淀外还含有
(5)“氧化”过程中发生氧化还原反应的离子方程式为
(6)“滤渣2”的主要成分是
(7)工业上还可以通过“苛化反应”,利用Li2CO3(s)+Ca2+(aq)
 CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性
CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性
您最近一年使用:0次
解题方法
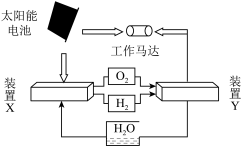
5 . 2022年11月30日神十四和神十五在中国空间站合体。航天员在太空舱需要的氧气除了从地球运输外,在空间站制取的原理为:①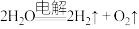 ;②
;② 。下列有关说法不正确的是
。下列有关说法不正确的是
 ;②
;② 。下列有关说法不正确的是
。下列有关说法不正确的是
| A.①②均为氧化还原反应 |
B.反应①中每生成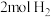 ,同时生成 ,同时生成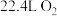 |
C.反应②中 被还原可得到 被还原可得到 |
D.常温常压下, 的摩尔质量为 的摩尔质量为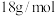 |
您最近一年使用:0次
2023-02-19更新
|
140次组卷
|
2卷引用:内蒙古赤峰市红山区2022-2023学年高一上学期期末质量检测化学试题
名校
解题方法
6 . 硫酸是重要的化工产品,可用于生产化肥、农药、炸药、染料等。工业制硫酸的原理(反应条件和部分生成物已略去)如图所示:
(1) 中硫元素的化合价是
中硫元素的化合价是_______ ,“过程Ⅰ”发生的反应为 ,其中氧化产物是
,其中氧化产物是_______ (填化学式)。
(2)“过程Ⅱ”中由 制备
制备 的化学方程式为
的化学方程式为_______ 。
(3)生产过程中的废气含有 ,可用双碱法脱硫处理,过程如图所示,其中可循环使用的物质是
,可用双碱法脱硫处理,过程如图所示,其中可循环使用的物质是_______ ,写出双碱法脱硫的总反应方程式_______ 。 含量,进行如下实验:取VL空气(标准状况),缓慢通入足量碘水,向所得溶液中加入稍过量的
含量,进行如下实验:取VL空气(标准状况),缓慢通入足量碘水,向所得溶液中加入稍过量的 溶液,产生白色沉淀,过滤、洗涤、干燥、称重,质量为mg。
溶液,产生白色沉淀,过滤、洗涤、干燥、称重,质量为mg。
①空气缓慢通入碘水时主要反应的离子方程式为_______ 。
②空气中 的体积分数为
的体积分数为_______ (用含V、m的代数式表示)。

(1)
 中硫元素的化合价是
中硫元素的化合价是 ,其中氧化产物是
,其中氧化产物是(2)“过程Ⅱ”中由
 制备
制备 的化学方程式为
的化学方程式为(3)生产过程中的废气含有
 ,可用双碱法脱硫处理,过程如图所示,其中可循环使用的物质是
,可用双碱法脱硫处理,过程如图所示,其中可循环使用的物质是
 含量,进行如下实验:取VL空气(标准状况),缓慢通入足量碘水,向所得溶液中加入稍过量的
含量,进行如下实验:取VL空气(标准状况),缓慢通入足量碘水,向所得溶液中加入稍过量的 溶液,产生白色沉淀,过滤、洗涤、干燥、称重,质量为mg。
溶液,产生白色沉淀,过滤、洗涤、干燥、称重,质量为mg。①空气缓慢通入碘水时主要反应的离子方程式为
②空气中
 的体积分数为
的体积分数为
您最近一年使用:0次
2023-02-10更新
|
929次组卷
|
4卷引用:内蒙古自治区赤峰第四中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
7 . 一氯化碘(ICl)是一种卤素互化物。卤素互化物具有强氧化性稀溶液,可与金属直接反应,也可用作有机合成中的碘化剂,一般可由卤素单质直接化合制得。有关一氯化碘制备及性质验证,请回答下列问题:
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:
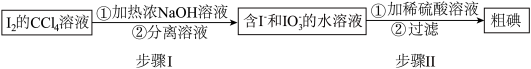
(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和_______ ,步骤Ⅱ的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。
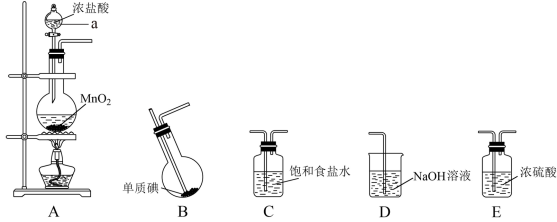
查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;_______
(4)B装置烧瓶需放在冷水中,其目的是:_______ ,B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_______ 。
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式_______ 。
(6)请设计简单的实验证明ICl的氧化性比I2强:_______ 。
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:

(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;
(4)B装置烧瓶需放在冷水中,其目的是:
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式
(6)请设计简单的实验证明ICl的氧化性比I2强:
您最近一年使用:0次
2023-01-19更新
|
407次组卷
|
2卷引用:内蒙古自治区呼和浩特市2022-2023学年高三上学期质量普查调研考试化学试题
名校
解题方法
8 . PH3是一种易自燃的气体,能被CuSO4溶液吸收生成Cu3P。实验室利用白磷与过量的NaOH溶液制备PH3,其装置如图所示(加热装置已略去;反应过程中同时有NaH2PO2生成)。下列说法错误的是


| A.不可用排空气法收集PH3 |
| B.制取PH3时,n(PH3):n(NaH2PO2)=3:1 |
| C.加入白磷前应先通入氮气 |
| D.CuSO4溶液吸收PH3利用了Cu2+的氧化性 |
您最近一年使用:0次
2022-12-09更新
|
81次组卷
|
3卷引用:内蒙古乌兰浩特市第一中学2022-2023学年高三上学期期中考试化学试题
9 . 下列物质的应用不是利用了氧化还原反应的是
| A.用生石灰脱去燃煤产生的SO2并且最终转化为稳定的CaSO4 |
| B.火箭发射时火箭燃料剧烈的反应 |
| C.用煮沸的豆浆和石膏稀溶液可制作豆腐脑或豆腐 |
| D.绿色植物进行光合作用将CO2和H2O转化成葡萄糖和氧气 |
您最近一年使用:0次
解题方法
10 . 某研究性学习小组拟用如下装置设计实验,来探究纯净、干燥的氯气与氨气的反应。按要求回答下列问题:

(1)装置A中盛装浓盐酸的仪器名称是_______ ;装置D的作用是_______ ;装置E中饱和食盐水的作用是_______ ;
(2)导气管的正确连接顺序中,a与_______ 连接(填小写字母);
(3)装置F中发生8NH3+3Cl2=6NH4Cl+N2,该反应中氧化剂与还原剂的物质的量之比是_______ ,为使两种气体充分接触,明显地看到_______ 现象,则装置F中j与_______ 连接(填小写字母);
(4)装置B中所发生反应的化学方程式是_______ ;
(5)该学习小组研究发现,整套实验方案的主要缺陷是缺少_______ 装置。

(1)装置A中盛装浓盐酸的仪器名称是
(2)导气管的正确连接顺序中,a与
(3)装置F中发生8NH3+3Cl2=6NH4Cl+N2,该反应中氧化剂与还原剂的物质的量之比是
(4)装置B中所发生反应的化学方程式是
(5)该学习小组研究发现,整套实验方案的主要缺陷是缺少
您最近一年使用:0次



