解题方法
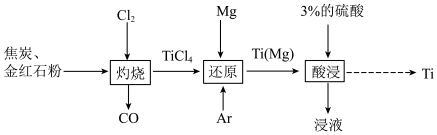
1 . 钛( )被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是
)被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是 )为原料制备高纯度钛的流程如图。回答下列问题:
)为原料制备高纯度钛的流程如图。回答下列问题:
已知:常温下,钛不与7%以下的盐酸、5%以下的硫酸反应,能与浓盐酸、浓硫酸反应。
(1) 中
中 的化合价为
的化合价为_______ 。
(2)“灼烧”时生成 反应的化学方程式为
反应的化学方程式为_______ ,在该反应中氧化剂是_______ (填化学式),标准状况下生成11.2L氧化产物时转移电子的物质的量为_______ 。
(3)“还原”中通入氩气( )的作用是
)的作用是_______ 。由冶炼钛的原理可推知,钛在金属活动顺序表中的位置可能是_______ (填标号)。
A.铝之前 B.镁与铜之间 C.铜之后
(4)“酸浸”之后,过滤、洗涤、干燥后得到钛。检验钛是否洗净的操作是_______
(5)“浸液”经过蒸发浓缩、降温结晶、过滤,得到晶体 ,若
,若 的摩尔质量为
的摩尔质量为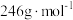 ,则
,则 的化学式为
的化学式为_______ 。
 )被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是
)被誉为“第三金属”,广泛用于航天、国防领域。以金红石(主要成分是 )为原料制备高纯度钛的流程如图。回答下列问题:
)为原料制备高纯度钛的流程如图。回答下列问题:已知:常温下,钛不与7%以下的盐酸、5%以下的硫酸反应,能与浓盐酸、浓硫酸反应。

(1)
 中
中 的化合价为
的化合价为(2)“灼烧”时生成
 反应的化学方程式为
反应的化学方程式为(3)“还原”中通入氩气(
 )的作用是
)的作用是A.铝之前 B.镁与铜之间 C.铜之后
(4)“酸浸”之后,过滤、洗涤、干燥后得到钛。检验钛是否洗净的操作是
(5)“浸液”经过蒸发浓缩、降温结晶、过滤,得到晶体
 ,若
,若 的摩尔质量为
的摩尔质量为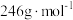 ,则
,则 的化学式为
的化学式为
您最近一年使用:0次
2023-07-14更新
|
132次组卷
|
3卷引用:青海省海东市2022-2023学年高一下学期期末考试化学试题
名校
2 . 3.2g铜与30mL8mol•L-1硝酸充分反应,硝酸的还原产物仅为NO和NO2,反应后溶液中含有amolH+,下列说法正确的是(气体均换算成标准状况下,不考虑硝酸的挥发)
| A.所得NO的物质的量为(0.5a-0.02)mol | B.反应后的溶液中不存在NO |
| C.生成NO2的体积为(0.16+1.5a)L | D.该反应中Cu作还原剂,被还原 |
您最近一年使用:0次
2023-06-03更新
|
65次组卷
|
3卷引用:青海省海东市2022-2023学年高一下学期6月联考化学试题
3 . 设NA为阿伏加德罗常数的值。下列说法错误的是
| A.标准状况下2.24L CO2与O3的混合气体中所含原子的数目为0.3NA |
| B.7.8g Na2O2与足量水反应转移电子数目为0.2 NA |
| C.常温下1L pH=2的醋酸溶液中所含H+数目为0.01 NA |
| D.1mol乙酸乙酯含有碳氢键的数目为8 NA |
您最近一年使用:0次
解题方法
4 . 从某工业废水中获取的砷滤饼的主要成分有As2S3、CuS、Bi2S3。采用硫化钠浸出砷-硫酸沉淀砷的工艺可回收砷滤饼中的铜和铋并制得砷酸(H3AsO4),工艺流程如下:
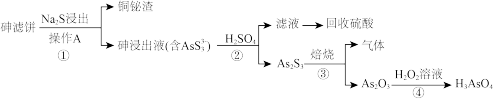
回答下列问题:
(1)操作A的名称是_______ 。
(2)步骤②发生非氧化还原反应,离子方程式为_______ 。
(3)步骤③“焙烧”反应中氧化剂与还原剂的物质的量之比为_______ ,吸收“焙烧”生成的气体的试剂是_______ 。
(4)步骤④的化学方程式为_______ 。
(5)为确定最优工艺条件,采用单因素实验考查硫化钠浸出砷和硫酸沉淀砷的影响因素。
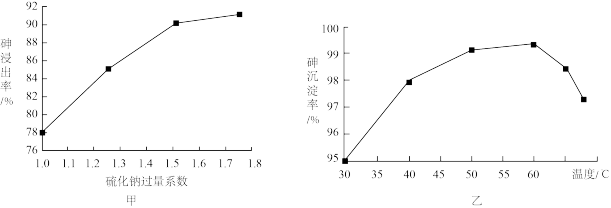
①控制反应温度为35℃,反应时间为1.5 h,硫化钠过量系数对砷浸出率的影响的实验结果如图甲。实际选取硫化钠过量系数为1.5,原因是_______ 。
②反应温度对硫酸沉淀砷的影响实验结果如图乙。结合步骤②的反应,说明砷沉淀率在60 ℃之前随温度升高而增大可能的原因:_______ 。
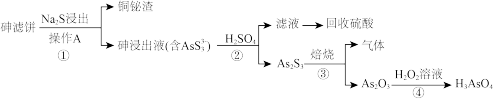
回答下列问题:
(1)操作A的名称是
(2)步骤②发生非氧化还原反应,离子方程式为
(3)步骤③“焙烧”反应中氧化剂与还原剂的物质的量之比为
(4)步骤④的化学方程式为
(5)为确定最优工艺条件,采用单因素实验考查硫化钠浸出砷和硫酸沉淀砷的影响因素。

①控制反应温度为35℃,反应时间为1.5 h,硫化钠过量系数对砷浸出率的影响的实验结果如图甲。实际选取硫化钠过量系数为1.5,原因是
②反应温度对硫酸沉淀砷的影响实验结果如图乙。结合步骤②的反应,说明砷沉淀率在60 ℃之前随温度升高而增大可能的原因:
您最近一年使用:0次
解题方法
5 . 硫酸是一种重要的工业原料,可用于制造肥料、炸药、颜料等。工业上在生产硫酸的过程中会产生大量污染物。
I.工业上生产硫酸:

II.尾气中硫的氧化物X的吸收和综合利用:

(1)物质X的大量排放会造成的环境问题是___________ (写出一种)。
(2)某含硫矿物的主要成分为 ,以其为原料制备硫酸时,铁元素转化成氧化铁,写出发生反应的化学方程式:
,以其为原料制备硫酸时,铁元素转化成氧化铁,写出发生反应的化学方程式:___________ 。
(3)方案II中用石灰石、空气处理工业尾气,将硫的氧化物X转化为 固体的过程中主要发生反应的化学方程式为
固体的过程中主要发生反应的化学方程式为___________ 、___________ 。
(4)某次检测测得尾气中物质X的体积分数为12.8%,为将物质X完全氧化(设尾气中其他成分不与氧气反应,且尾气中不含氧气),理论上参与反应的空气(其中氧气的体积分数约为20%)与尾气的体积比为___________ 。
(5)在以 为催化剂将硫的氧化物X转化成硫的氧化物Y的实际生产中,催化剂使用一段时间后,会含有
为催化剂将硫的氧化物X转化成硫的氧化物Y的实际生产中,催化剂使用一段时间后,会含有 等。从废钒催化剂中回收
等。从废钒催化剂中回收 的流程如下:
的流程如下:

①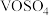 中V元素的化合价为
中V元素的化合价为___________ 价,“浸取还原”时,为了缩短浸取所需的时间,你认为可行的措施为___________ (写出一种)。
②若上述回收流程中,“浸取还原”时消耗的 与“氧化”时消耗的
与“氧化”时消耗的 (
( 转化为
转化为 )的物质的量之比为9:4,则该废矾催化剂中
)的物质的量之比为9:4,则该废矾催化剂中 与
与 的物质的量之比为
的物质的量之比为___________ 。(废矾催化剂中其他物质在“浸取还原”和“氧化”过程中均不参与反应)
I.工业上生产硫酸:

II.尾气中硫的氧化物X的吸收和综合利用:

(1)物质X的大量排放会造成的环境问题是
(2)某含硫矿物的主要成分为
 ,以其为原料制备硫酸时,铁元素转化成氧化铁,写出发生反应的化学方程式:
,以其为原料制备硫酸时,铁元素转化成氧化铁,写出发生反应的化学方程式:(3)方案II中用石灰石、空气处理工业尾气,将硫的氧化物X转化为
 固体的过程中主要发生反应的化学方程式为
固体的过程中主要发生反应的化学方程式为(4)某次检测测得尾气中物质X的体积分数为12.8%,为将物质X完全氧化(设尾气中其他成分不与氧气反应,且尾气中不含氧气),理论上参与反应的空气(其中氧气的体积分数约为20%)与尾气的体积比为
(5)在以
 为催化剂将硫的氧化物X转化成硫的氧化物Y的实际生产中,催化剂使用一段时间后,会含有
为催化剂将硫的氧化物X转化成硫的氧化物Y的实际生产中,催化剂使用一段时间后,会含有 等。从废钒催化剂中回收
等。从废钒催化剂中回收 的流程如下:
的流程如下:
①
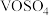 中V元素的化合价为
中V元素的化合价为②若上述回收流程中,“浸取还原”时消耗的
 与“氧化”时消耗的
与“氧化”时消耗的 (
( 转化为
转化为 )的物质的量之比为9:4,则该废矾催化剂中
)的物质的量之比为9:4,则该废矾催化剂中 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
6 . 金属钒主要用于冶炼特种钢,被誉为“合金的维生素”。人们在化工实践中,以富钒炉渣(其中的钒以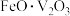 、
、 等形式存在,还有少量的
等形式存在,还有少量的 、
、 等)为原料提取金属钒的工艺流程如图所示。
等)为原料提取金属钒的工艺流程如图所示。

提示:①钒有多种价态,其中+5价最稳定;
② 在碱性条件下可转化为VO
在碱性条件下可转化为VO 。
。
(1)试列举可加快“高温氧化”速率的措施:___________ (填一条)。
(2)“气体Y”和“滤渣1”的化学式分别为___________ 、___________ 。
(3)“沉硅、沉铝”中得到含铝沉淀的离子方程式为___________ 。
(4)“高温氧化”过程中,若有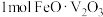 被氧化,则转移的电子数为
被氧化,则转移的电子数为___________ NA。
(5)写出“焙烧”时 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
(6)在“高温还原”反应中,氧化钙最终转化为___________ (写化学式)。
(7)用铝热反应也可将 还原为钒,相应的化学方程式为
还原为钒,相应的化学方程式为___________ 。
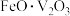 、
、 等形式存在,还有少量的
等形式存在,还有少量的 、
、 等)为原料提取金属钒的工艺流程如图所示。
等)为原料提取金属钒的工艺流程如图所示。
提示:①钒有多种价态,其中+5价最稳定;
②
 在碱性条件下可转化为VO
在碱性条件下可转化为VO 。
。(1)试列举可加快“高温氧化”速率的措施:
(2)“气体Y”和“滤渣1”的化学式分别为
(3)“沉硅、沉铝”中得到含铝沉淀的离子方程式为
(4)“高温氧化”过程中,若有
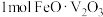 被氧化,则转移的电子数为
被氧化,则转移的电子数为(5)写出“焙烧”时
 发生反应的化学方程式:
发生反应的化学方程式:(6)在“高温还原”反应中,氧化钙最终转化为
(7)用铝热反应也可将
 还原为钒,相应的化学方程式为
还原为钒,相应的化学方程式为
您最近一年使用:0次
2021-12-21更新
|
662次组卷
|
5卷引用:青海省海东市2022届高考一模理科综合化学试题
7 . 在含有2molH2SO4的浓硫酸中加入足量锌粉,使其充分反应,则下列推断中错误的是
①放出的气体中除SO2外还有H2
②只放出SO2气体,其物质的量为1mol
③反应结束时转移电子的物质的量可能为4mol
①放出的气体中除SO2外还有H2
②只放出SO2气体,其物质的量为1mol
③反应结束时转移电子的物质的量可能为4mol
| A.① | B.② | C.②③ | D.①② |
您最近一年使用:0次
2021-11-05更新
|
107次组卷
|
4卷引用:【全国百强校】青海省平安县第一高级中学2017-2018学年高一下学期期中考试(A卷)化学试题
8 . 铁是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工业上常用 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:

①试剂D为___________ (填名称)。
②滤液B的溶质为___________ (填化学式)。
③通入气体F时发生反应的离子方程式为___________ 。
④实验中若要证明蚀刻废液中不含 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为___________ 。
(2)水热法制备 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:
①水热法制备 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为___________ (填元素符号)。
②该反应的化学方程式中
___________ 。
③每生成 ,反应转移的电子为
,反应转移的电子为___________  。
。
(1)工业上常用
 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:
①试剂D为
②滤液B的溶质为
③通入气体F时发生反应的离子方程式为
④实验中若要证明蚀刻废液中不含
 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为(2)水热法制备
 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:①水热法制备
 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为②该反应的化学方程式中

③每生成
 ,反应转移的电子为
,反应转移的电子为 。
。
您最近一年使用:0次
2021-01-30更新
|
460次组卷
|
5卷引用:青海省海东市2020-2021学年高一上学期期末考试化学试题
9 . 亚硝酸钠有咸味,有毒,暴露于空气中会与氧气反应生成硝酸钠。
已知: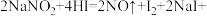 _____。
_____。
(1)上述方程式中横线处应填的是___________ 。
(2)上述反应的还原剂为___________ (填化学式);若反应中有 (标准状况下)气体生成则反应中转移电子的物质的量为
(标准状况下)气体生成则反应中转移电子的物质的量为___________  。
。
(3)在酸性条件下,高锰酸钾可将 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:___________ 。
(4) 加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:
加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:___________ 。反应中被氧化的元素和被还原的元素的物质的量之比为___________ 。
(5)某厂废液中,含有2%~5%的 ,直接排放会造成污染,
,直接排放会造成污染, 能使
能使 转化为
转化为 ,则反应中氧化剂和还原剂的质量之比为
,则反应中氧化剂和还原剂的质量之比为___________ 。
已知:
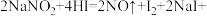 _____。
_____。(1)上述方程式中横线处应填的是
(2)上述反应的还原剂为
 (标准状况下)气体生成则反应中转移电子的物质的量为
(标准状况下)气体生成则反应中转移电子的物质的量为 。
。(3)在酸性条件下,高锰酸钾可将
 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:(4)
 加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:
加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:(5)某厂废液中,含有2%~5%的
 ,直接排放会造成污染,
,直接排放会造成污染, 能使
能使 转化为
转化为 ,则反应中氧化剂和还原剂的质量之比为
,则反应中氧化剂和还原剂的质量之比为
您最近一年使用:0次
10 .  在一定条件下可以把M2+氧化成M3+,若反应的还原产物为R3+,已知反应中氧化剂与还原剂的物质的量之比为1∶6,则n为
在一定条件下可以把M2+氧化成M3+,若反应的还原产物为R3+,已知反应中氧化剂与还原剂的物质的量之比为1∶6,则n为
 在一定条件下可以把M2+氧化成M3+,若反应的还原产物为R3+,已知反应中氧化剂与还原剂的物质的量之比为1∶6,则n为
在一定条件下可以把M2+氧化成M3+,若反应的还原产物为R3+,已知反应中氧化剂与还原剂的物质的量之比为1∶6,则n为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2021-01-30更新
|
285次组卷
|
3卷引用:青海省海东市2020-2021学年高一上学期期末考试化学试题
青海省海东市2020-2021学年高一上学期期末考试化学试题(已下线)专题04 氧化还原反应-备战2021届高考化学二轮复习题型专练安徽省滁州市定远县育才学校2021-2022学年高一上学期第一次月考化学试题



