名校
解题方法
1 .  (四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为
(四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为 ,含少量
,含少量 、
、 和
和 等)为原料制备四氢铝钠的流程如下。
等)为原料制备四氢铝钠的流程如下。 是酸性氧化物;
是酸性氧化物;
② 。
。
回答下列问题:
(1)浸渣的主要成分是___________ (填化学式)。
(2)“除杂”时铝元素转化的离子方程式为___________ 。
(3)将“沉铝”后的滤液蒸干、灼烧得到的固体是___________ (填化学式)。实验室进行“蒸干、灼烧”时不需要使用的仪器有___________ (填字母)。
A.酒精灯 B.烧杯 C.坩埚 D.蒸发皿
(4)实验室用氢气和钠共热制备 ,
, 的电子式为
的电子式为___________ 。
(5)写出 和
和 反应制备
反应制备 的化学方程式:
的化学方程式:___________ 。
(6)在化学上,含氢还原剂的还原能力用“有效氢”表示。“有效氢”的定义是单位质量含氢还原剂的还原能力相当于多少克氢气。一般地,含氢还原剂中氢元素被氧化成 ,还原能力用失去电子数多少表示。
,还原能力用失去电子数多少表示。 、
、 的“有效氢”之比为
的“有效氢”之比为___________ 。
 (四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为
(四氢铝钠)是一种强还原剂和供氢剂,在有机合成中广泛应用。以铝土矿(主要成分为 ,含少量
,含少量 、
、 和
和 等)为原料制备四氢铝钠的流程如下。
等)为原料制备四氢铝钠的流程如下。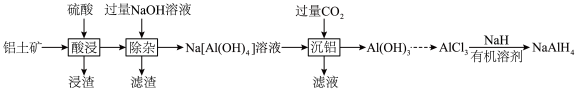
 是酸性氧化物;
是酸性氧化物;②
 。
。回答下列问题:
(1)浸渣的主要成分是
(2)“除杂”时铝元素转化的离子方程式为
(3)将“沉铝”后的滤液蒸干、灼烧得到的固体是
A.酒精灯 B.烧杯 C.坩埚 D.蒸发皿
(4)实验室用氢气和钠共热制备
 ,
, 的电子式为
的电子式为(5)写出
 和
和 反应制备
反应制备 的化学方程式:
的化学方程式:(6)在化学上,含氢还原剂的还原能力用“有效氢”表示。“有效氢”的定义是单位质量含氢还原剂的还原能力相当于多少克氢气。一般地,含氢还原剂中氢元素被氧化成
 ,还原能力用失去电子数多少表示。
,还原能力用失去电子数多少表示。 、
、 的“有效氢”之比为
的“有效氢”之比为
您最近一年使用:0次
2 . 回答下列问题:
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生___________ 反应,说明亚硝酸钠具有___________ 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有___________ 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是___________ ,反应中被氧化的氮原子与未被氧化的氮原子个数比为___________ 。
(3)过氧化氢溶液可作为采矿业废液消毒剂,如消除废液中剧毒的氰化钾(KCN,其中氮元素为-3价),反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平)。
①该反应是否属于氧化还原反应?___________ (填“是”或“否”),理由是___________ 。若是,则被还原的元素是___________ 。
②生成物A的化学式是___________ 。
③该反应中发生氧化反应的物质是___________ ,理由是___________ 。
④若生成4个NH3分子,转移电子数为___________ 。
⑤用双线桥法表示反应中电子转移的方向和数目:___________ 。
(1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=CeF3+16NH3↑+12H2O+N2↑,该反应中还原剂是
(3)过氧化氢溶液可作为采矿业废液消毒剂,如消除废液中剧毒的氰化钾(KCN,其中氮元素为-3价),反应方程式为KCN+H2O2+H2O=A+NH3↑(已配平)。
①该反应是否属于氧化还原反应?
②生成物A的化学式是
③该反应中发生氧化反应的物质是
④若生成4个NH3分子,转移电子数为
⑤用双线桥法表示反应中电子转移的方向和数目:
您最近一年使用:0次
解题方法
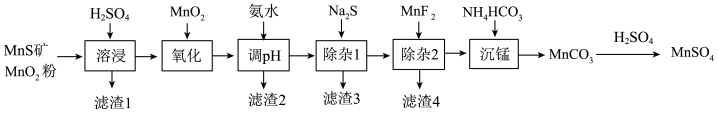
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(主要成分为MnS,还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备,工艺流程如图所示,回答下列问题:
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
(1)已知“溶浸”中发生反应的化学方程式为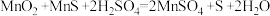 ,当生成0.5molMnSO4时,该反应中转移的电子数为
,当生成0.5molMnSO4时,该反应中转移的电子数为_____ ,该反应中n(还原剂):n(氧化剂)=_____ ,“滤渣1”的主要成分为_____ (化学式)。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,酸性条件下MnO2氧化Fe2+反应的离子方程式为_____ 。
(3)“除杂1”的目的是去Zn2+和Ni2+,“除杂2”的目的是将Mg2+转化为MgF2沉淀从而除去Mg2+,试推测“调pH”是为了除_____ (填元素符号),溶液的pH范围应调节在_____ ~6(当某金属离子沉淀完全视作该金属离子已除净)。
(4)写出“沉锰”时发生反应的离子方程式_____ 。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为Li3NixCoyMnzO6,其中Ni、Co、Mn、O的化合价次为+2、+3、+4、-2,当x=y=1时,z=_____ ,试用氧化物的形式表示镍钴锰三元材料:_____ [某些含氧酸盐可以写成氧化物的形式(例如:NaAlO2以表示为NaO·Al2O3]。

相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
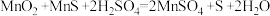 ,当生成0.5molMnSO4时,该反应中转移的电子数为
,当生成0.5molMnSO4时,该反应中转移的电子数为(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,酸性条件下MnO2氧化Fe2+反应的离子方程式为
(3)“除杂1”的目的是去Zn2+和Ni2+,“除杂2”的目的是将Mg2+转化为MgF2沉淀从而除去Mg2+,试推测“调pH”是为了除
(4)写出“沉锰”时发生反应的离子方程式
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为Li3NixCoyMnzO6,其中Ni、Co、Mn、O的化合价次为+2、+3、+4、-2,当x=y=1时,z=
您最近一年使用:0次
2023-07-09更新
|
156次组卷
|
2卷引用:山西省忻州市2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
4 . 当氨分子中的三个氢原子依次被其它原子或基团取代时,所形成的化合物叫做氨的衍生物。主要有N2H4(肼)、HN3(叠氮化氢,溶于水称为叠氮酸)、NH2OH(羟胺)。水合肼(N2H4·H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。下面是工业水合肼法制备叠氮化钠的工艺流程。

资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
回答下列问题:
I.合成水合肼。实验室合成水合肼装置如下图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在400C以下反应一段时间后,再迅速升温至1100℃继续反应可以制得水合肼。

(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO碱性溶液,不能反向滴加的原因是______________ ;制取N2H4•H2O的离子方程式为_______________________ 。
II.制备叠氮化钠。实验室可利用下图中所示的装置及药品制备叠氮化钠。

(2)①根据实验发现温度在20℃左右反应的转化率最高,因此可采取的措施是_______________ ;流程中蒸馏A溶液时,装置中旋塞K1、K2、K3的开关情况是_______________________ 。
②写出该方法制备叠氮化钠的化学方程式:________________________ 。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为____________________ ,减压过滤,晶体用乙醇洗涤2〜3次后,干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol•L的NaClO溶液_____________ mL。
III.羟胺(NH2OH)是一种还原剂,可以通过下列过程得到:乙烯和N2O4气体混合后,光照,发生加成反应,得到化合物A。A结构对称,所有相同元素的原子化学环境相同。A在某浓度的硫酸溶液中回馏,可得到化合物B,同时得到CO和CO2组成的混合气体(相对氢气密度为18)。经分析,B为不含碳元素的硫酸盐,其硫和氧元素的质量分数分别为19.51%和58.54%。若将A换成CH3CH2NO2进行类似的反应,也能得到B,但没有气体放出。B在液氨中即得到NH2OH。
(5)NH2OH具有弱碱性,可与酸反应生成盐,该盐阳离子的电子式为_______________ 。
(6)写出A→B的化学方程式________________________ 。

资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
| 物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
| 熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
| 沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
I.合成水合肼。实验室合成水合肼装置如下图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在400C以下反应一段时间后,再迅速升温至1100℃继续反应可以制得水合肼。

(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO碱性溶液,不能反向滴加的原因是
II.制备叠氮化钠。实验室可利用下图中所示的装置及药品制备叠氮化钠。

(2)①根据实验发现温度在20℃左右反应的转化率最高,因此可采取的措施是
②写出该方法制备叠氮化钠的化学方程式:
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol•L的NaClO溶液
III.羟胺(NH2OH)是一种还原剂,可以通过下列过程得到:乙烯和N2O4气体混合后,光照,发生加成反应,得到化合物A。A结构对称,所有相同元素的原子化学环境相同。A在某浓度的硫酸溶液中回馏,可得到化合物B,同时得到CO和CO2组成的混合气体(相对氢气密度为18)。经分析,B为不含碳元素的硫酸盐,其硫和氧元素的质量分数分别为19.51%和58.54%。若将A换成CH3CH2NO2进行类似的反应,也能得到B,但没有气体放出。B在液氨中即得到NH2OH。
(5)NH2OH具有弱碱性,可与酸反应生成盐,该盐阳离子的电子式为
(6)写出A→B的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下。
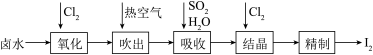
(1)“氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程式_____________ 。
(2)“吹出”在吹出塔中进行,含碘卤水从_______ (填“塔顶”或“塔底”)进入, 请解释这样做的原因_______________________
(3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_______ ;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO 进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO
进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO 的物质的量之比为
的物质的量之比为_______ 。
(4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO ,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2
,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2______ g。

(1)“氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程式
(2)“吹出”在吹出塔中进行,含碘卤水从
(3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为
 进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO
进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO 的物质的量之比为
的物质的量之比为(4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO
 ,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2
,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2
您最近一年使用:0次
解题方法
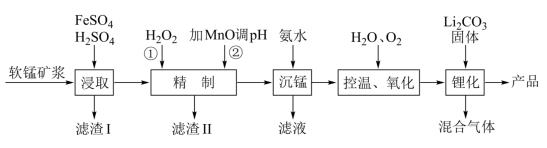
6 . 锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂(LiMn2O4)。流程如图:
已知:Ksp[Fe(OH)3]=2.6×10-39,,Ksp[Mn(OH)2]=1.6×10-13,Ksp[Fe(OH)2]=4.9×10-17,Ksp[Al(OH)3]=1.0×10-33,lg2≈0.3
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_______ 。
(2)“精制”中加入H2O2的量比理论值大得多,其主要原因是______ ;若Mn2+的浓度为1.0mol•L-1,则加MnO调节pH的范围为_______ (离子浓度≤1.0×10-6mol•L-1时,可认为沉淀完全)。
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是_______ (用化学方程式表示)。

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2,K2S2O8中S元素的化合价为_______ ;此反应的氧化剂和还原剂的物质的量之比为________ 。
(5)“锂化”是将MnO2和Li2CO3按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。写出反应的化学方程式_______ 。

已知:Ksp[Fe(OH)3]=2.6×10-39,,Ksp[Mn(OH)2]=1.6×10-13,Ksp[Fe(OH)2]=4.9×10-17,Ksp[Al(OH)3]=1.0×10-33,lg2≈0.3
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为
(2)“精制”中加入H2O2的量比理论值大得多,其主要原因是
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2,K2S2O8中S元素的化合价为
(5)“锂化”是将MnO2和Li2CO3按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。写出反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。
、PdO(不与碱反应)。
回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(4)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(5)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(6)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=_______ 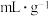 ,氢气的浓度r=
,氢气的浓度r=_______ (结果保留两位小数)。(吸附容量R即1g钯吸附氢气的体积;氢气的浓度r为1mol Pd吸附氢气的物质的量)
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“还原”时反应还生成无污染的气体,化学方程式为
(4)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(5)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
(6)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=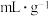 ,氢气的浓度r=
,氢气的浓度r=
您最近一年使用:0次
名校
解题方法
8 . 锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂(LiMn2O4)。流程如图:
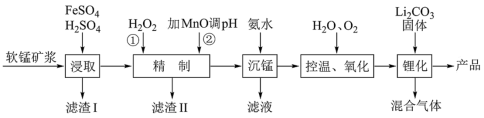
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为______ 。
(2)滤渣II的主要成分是______ ;“精制”中加入H2O2的量比理论值大得多,其主要原因是_____ 。
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是______ (用化学方程式表示)。
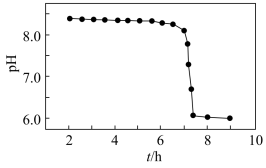
(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为______ 。
(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是_____ 。
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy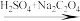 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为______ 。

(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为
(2)滤渣II的主要成分是
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为
 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy
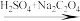 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
您最近一年使用:0次
2023-01-10更新
|
598次组卷
|
3卷引用:山东省烟台第一中学2022-2023学年高一上学期月考化学试题
名校
解题方法
9 . 氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
Ⅰ.(1)NaClO中Cl的化合价为__________ ,有较强的_______ (填氧化、还原)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________ 。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO ,此反应的离子方程式为
,此反应的离子方程式为_____ 。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身被还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为________ 。
Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
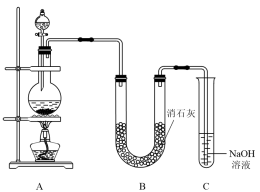
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式____ ;
(2)C装置的作用是________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是_______ 。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进_____ 。
Ⅰ.(1)NaClO中Cl的化合价为
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO
 ,此反应的离子方程式为
,此反应的离子方程式为②ClO2可将废水中的Mn2+转化为MnO2而除去,本身被还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为
Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式
(2)C装置的作用是
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进
您最近一年使用:0次
10 . 化学反应常常涉及到气体,气体在千变万化的化学反应中充当着重要角色。完成下列计算:
(1)足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下1.68 L O2混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol•L-1NaoH 溶液至Cu2+恰好完全沉淀,则所用氧气的物质的量为___ ,消耗NaOH 溶液的体积是_____ 。
(2)某化工厂以甲就为原料中合成甲醇的反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)①(反应中CH4转化率为100%),CO(g)+2H2(g)→CH3OH(g)②(反应中CO有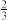 转化),合成工艺如下:
转化),合成工艺如下:

虚线框内为改进后的工艺中新增流程,所有气体体积均折算为标准状况。
①原工艺中,当充入反应器①的甲烷和水蒸汽的体积分别为672 m3和1750 m3时,最后的反应剩余物中n (CO) =___ ,n(H2)= ____ 。
②为充分利用反应剩余物,该厂在原工艺的基础上,将下列反应运用于正产甲醇原料气:2CH4(g)+O2(g)→2CO(g)+4H2(g) ③(反应中CH4转化率为100%),若新工艺中充入反应器①的甲烷和水蒸汽的体积分别为a m3和3a m3,反应剩余物中V(H2):V(CO)=3: 1。试计算充入反应器③的甲烷的体积_______ 。
(1)足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下1.68 L O2混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol•L-1NaoH 溶液至Cu2+恰好完全沉淀,则所用氧气的物质的量为
(2)某化工厂以甲就为原料中合成甲醇的反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)①(反应中CH4转化率为100%),CO(g)+2H2(g)→CH3OH(g)②(反应中CO有
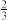 转化),合成工艺如下:
转化),合成工艺如下:
虚线框内为改进后的工艺中新增流程,所有气体体积均折算为标准状况。
①原工艺中,当充入反应器①的甲烷和水蒸汽的体积分别为672 m3和1750 m3时,最后的反应剩余物中n (CO) =
②为充分利用反应剩余物,该厂在原工艺的基础上,将下列反应运用于正产甲醇原料气:2CH4(g)+O2(g)→2CO(g)+4H2(g) ③(反应中CH4转化率为100%),若新工艺中充入反应器①的甲烷和水蒸汽的体积分别为a m3和3a m3,反应剩余物中V(H2):V(CO)=3: 1。试计算充入反应器③的甲烷的体积
您最近一年使用:0次



