2014·福建·高考真题
真题
名校
1 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为__________________ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________ (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液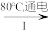 NaClO3溶液
NaClO3溶液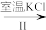 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□_____ 。
②Ⅱ中转化的基本反应类型是___________________ ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是______________________________ 。
(4)一定条件,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
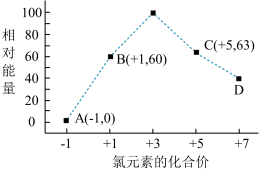
①D是_________________ (填离子符号)。
②B→A+C反应的热化学方程式为_____________________ (用离子符号表示)。
(1)与氯元素同族的短周期元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
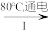 NaClO3溶液
NaClO3溶液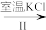 KClO3晶体
KClO3晶体①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□
②Ⅱ中转化的基本反应类型是
(4)一定条件,在水溶液中1 mol Cl-、ClO
 (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
①D是
②B→A+C反应的热化学方程式为
您最近一年使用:0次
2019-01-30更新
|
2008次组卷
|
9卷引用:上海市格致中学2015届高三上学期摸底考试化学试题
(已下线)上海市格致中学2015届高三上学期摸底考试化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)(已下线)2015届江西省金溪一中高三暑期化学试卷(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)江西省九江一中2020-2021学年高二上学期月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第1单元03巩固练
2 . 氯气在生产生活中有广泛的用途,制取氯气的途径有多种。完成下列填空:
(1)工业上用电解饱和食盐水制取氯气,氯气在电解池的______ 极产生;氯气与氢氧化钠反应得到消毒剂次氯酸钠,发生反应的化学方程式为________ ;向次氯酸钠溶液中加入少量稀盐酸,可以增强消毒效果,这是因为生成了_____ (填物质名称)。
(2)实验室制取氯气的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,该反应中,氯气是
MnCl2+Cl2↑+2H2O,该反应中,氯气是______ (填“氧化”或“还原”)产物;若反应过程中转移了2 mol电子,则在标准状况下可以得到_______ L氯气。
(3)实验室常用排饱和食盐水的方法收集氯气,请用平衡移动原理解释用饱和食盐水而不用水的原因。___________
(4)有机化工中会利用反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为
2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为_________________ 。t0时刻改变某一条件,Cl2的物质的量变化曲线如图中AB段所示,则t0时改变的条件一定是__________ 。
a.降低温度 b.增大压强 c.加入HCl
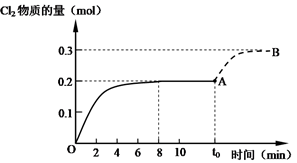
(1)工业上用电解饱和食盐水制取氯气,氯气在电解池的
(2)实验室制取氯气的化学方程式为MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,该反应中,氯气是
MnCl2+Cl2↑+2H2O,该反应中,氯气是(3)实验室常用排饱和食盐水的方法收集氯气,请用平衡移动原理解释用饱和食盐水而不用水的原因。
(4)有机化工中会利用反应4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为
2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为a.降低温度 b.增大压强 c.加入HCl
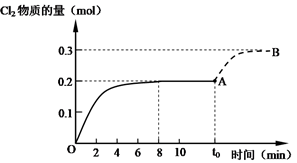
您最近一年使用:0次
名校
解题方法
3 . 氧化还原反应在生产、生活中具有广泛的用途。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是_____ (选填编号)。
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。
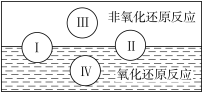
试写出有水参加且符合反应类型 IV 的一个化学方程式:___________________ 。
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
_____ NaIO3+ NaHSO3→ I2+ Na2SO4+ H2SO4+ H2O
②该反应还原剂是_____ ,_____ 元素被还原,若生成 1mol 氧化产物则转移电子数目为_____ NA。
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-_____ I-(填“>”或“<”),完成该反应_____________________________________ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a. 海水提溴 b. 工业制氯碱 c. 海水晒盐 d. 海带提碘
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关”可用下图表示。

试写出有水参加且符合反应类型 IV 的一个化学方程式:
(3)工业上利用 NaIO3和 NaHSO3反应来制取单质 I2。
①配平下列化学方程式并标明电子转移的方向和数目:
②该反应还原剂是
(4)已知:HSO3-、I2、I-、SO42-和一些未知物组成的一个氧化还原反应,其中SO42-是氧化产物,该反应中还原性HSO3-
您最近一年使用:0次
2017-12-22更新
|
282次组卷
|
2卷引用:上海交通大学附属中学2017-2018学年高一12月月考化学试题
4 . 铁及其化合物在生产、生活中存在广泛用途。

(1)如图是铁元素在元素周期表中的有关信息。
补全铁原子的核外电子排布式_____________ 3p63d64s2。“55.85”是________________________ 。自然界中存在的54Fe和56Fe,它们互称为_____________ 。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是_____________ 。通常证明某溶液中含Fe2+的化学方法是_____________________ 。
(3)SO2 有强还原性,写出其与 FeCl3 溶液反应的离子方程式______________________ 。
若有 0.4mol FeCl3 发生反应,则需要标准状况下的 SO2______________ 升。
(4)发黄的深井水通常含 Fe3+,若向水中加入 Na2CO3 溶液,则产生红褐色沉淀和无色无味的气体。请从平衡移动角度解释这一现象___________________ 。

(1)如图是铁元素在元素周期表中的有关信息。
补全铁原子的核外电子排布式
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是
(3)SO2 有强还原性,写出其与 FeCl3 溶液反应的离子方程式
若有 0.4mol FeCl3 发生反应,则需要标准状况下的 SO2
(4)发黄的深井水通常含 Fe3+,若向水中加入 Na2CO3 溶液,则产生红褐色沉淀和无色无味的气体。请从平衡移动角度解释这一现象
您最近一年使用:0次
2017-05-03更新
|
390次组卷
|
3卷引用:上海市闵行区2017届高三二模化学试题
5 . 硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)Na2S溶液中,水的电离程度会______ (填“增大”“减小”或“不变”);微热该溶液,pH会_____ (填“增大”“减小”或“不变”)。
(2)Na2S溶液中各离子浓度由大到小的顺序为:_____________________________ 。
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:_____ Na2S+_____ Na2SO3+_____ H2SO4→_____ Na2SO4+_____ S +
+_____ H2O
(4)配平上述化学方程式,标出电子转移的方向和数目__________ 。反应中被氧化的元素是____________ 。
(5)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:________________________________________________________________________ 。
(1)Na2S溶液中,水的电离程度会
(2)Na2S溶液中各离子浓度由大到小的顺序为:
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:
 +
+(4)配平上述化学方程式,标出电子转移的方向和数目
(5)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:
您最近一年使用:0次
2017-12-26更新
|
535次组卷
|
3卷引用:上海市虹口区2018届高三上学期教学质量监控测试化学试题
上海市虹口区2018届高三上学期教学质量监控测试化学试题上海市罗店中学2018-2019学年高二第二学期期中考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 练
解题方法
6 . A~D 是原子序数在 20 以内的元素,其性质或结构信息如下表:

请根据表中的信息回答下列问题:
(1)C 离子的结构示意图:_____________ ,B 原子的电子式:______________ 。
(2)写出和 B 的氢化物所含电子数相同的 3 种复杂微粒,这三种微粒分别是: 阴离子:_____ ,阳离子____________ ,电中性微粒:_____________ 。
(3)A 元素与 D 元素组成的化合物有非常重要的用途,写出实验室制备该气体的化学方程式:______________ 。

请根据表中的信息回答下列问题:
(1)C 离子的结构示意图:
(2)写出和 B 的氢化物所含电子数相同的 3 种复杂微粒,这三种微粒分别是: 阴离子:
(3)A 元素与 D 元素组成的化合物有非常重要的用途,写出实验室制备该气体的化学方程式:
您最近一年使用:0次
13-14高三上·上海杨浦·期中
7 . 碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。
完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
____ KI+____ CuSO4→ ____ I2+____ Cu2I2↓+ ____________
该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。
写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是____________________ 。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:
2Cu2I2+Hg → Cu2HgI4(玫瑰红)+ 2Cu
产物Cu2HgI4中,Cu元素显____ 价。
当有1 molCu2I2参与反应时,转移电子____ mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____ (选填编号)
完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
该反应中氧化剂与还原剂的物质的量之比为
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。
写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:
2Cu2I2+Hg → Cu2HgI4(玫瑰红)+ 2Cu
产物Cu2HgI4中,Cu元素显
当有1 molCu2I2参与反应时,转移电子
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
您最近一年使用:0次
8 . 碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛.完成下列填空.
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.请完成并配平下述反应:
______ KI+________ CuSO4→______ I2+_______ Cu2I2↓+_______
该反应中氧化剂与还原剂的物质的量之比为__________ .
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是_______________ .
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg→Cu2HgI4(玫瑰红)+2Cu产物Cu2HgI4中,Cu元素显________ 价.当有1molCu2I2参与反应时,转移电子_________ mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是_________ (选填编号)
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.请完成并配平下述反应:
该反应中氧化剂与还原剂的物质的量之比为
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg→Cu2HgI4(玫瑰红)+2Cu产物Cu2HgI4中,Cu元素显
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
您最近一年使用:0次
9 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是_______ ;
24.碘元素在元素周期表中的位置是_________________ ;为防缺碘,食盐中常添加碘酸钾,该物质内存在____________________ 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是________ ;液溴的保存通常采取的方法是__________ 。
26.通过比较___________ 或________________ 可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O □NaClO3+ □
□NaClO3+ □__________________
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是__________________ 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________ 。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是
24.碘元素在元素周期表中的位置是
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是
26.通过比较
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O
 □NaClO3+ □
□NaClO3+ □②II反应过程能析出KClO3晶体而无其它晶体析出的原因是
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是
您最近一年使用:0次



