名校
解题方法
1 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
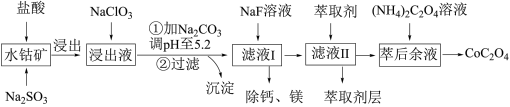
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
5卷引用:2016届广东省肇庆市高三上学期期末质检理综化学试卷
解题方法
2 . 某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
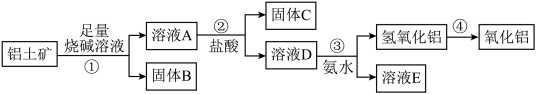
(1)固体B的主要用途有(写出1条即可)_________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:_______________ ;________________ 。
(3)第③步中,生成氢氧化铝的离子方程式是_________________ 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________ 。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________ 。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)

(1)固体B的主要用途有(写出1条即可)
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:
(3)第③步中,生成氢氧化铝的离子方程式是
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
您最近一年使用:0次
名校
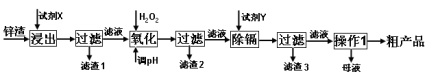
3 . 炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。试回答下列问题:
(1)“浸出”时用到的“试剂X”为______________ (填名称)。
(2)写出“氧化”过程的离子方程式_______________________________________ 。
(3)“调pH”过程可以选用_______________ (填序号)。
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是______________________________ (填化学式,下同)。
(4)“试剂Y”是__________________ 。
(5)“操作1”的方法是__________ ;在“操作1”时,必须采取的实验措施是_____________ 。
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。试回答下列问题:
(1)“浸出”时用到的“试剂X”为
(2)写出“氧化”过程的离子方程式
(3)“调pH”过程可以选用
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是
(4)“试剂Y”是
(5)“操作1”的方法是
您最近一年使用:0次
解题方法
4 . 锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:

(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是_________________ 。
(2)净化1是为了将Mn2+转化为MnO2而除去,试写出该反应的离子方程式__________ 。
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图。pH值中等时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是________________________ 。

(4)滤渣3的主要成分为___________ (填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3•2Zn(OH)2•H2O,写出碳化过程生成“前驱体”的化学方程式___________________ ;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是_______________________ 。

(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是
(2)净化1是为了将Mn2+转化为MnO2而除去,试写出该反应的离子方程式
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图。pH值中等时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是

(4)滤渣3的主要成分为
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3•2Zn(OH)2•H2O,写出碳化过程生成“前驱体”的化学方程式
您最近一年使用:0次
2016-12-09更新
|
448次组卷
|
3卷引用:2015届广东省肇庆一中等五校高三联考(三模)理综化学试卷
解题方法
5 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质。以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示。
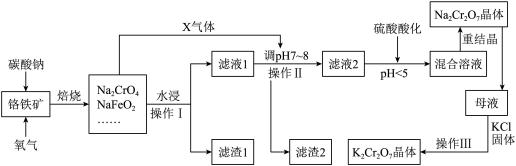
已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O 2CrO42- + 2H+。
2CrO42- + 2H+。
请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有__________ (填化学式)
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式_____________________ 。
(2)“焙烧”过程中,所产生X气体的电子式为_________________________ 。
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):_____ ;_____ 。
(4)滤渣1的主要成分是_______________ 。若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式_________________________________________ 。
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质__________ (填化学式)的含量。
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是____________ 、__________ 、过滤、75%乙醇水溶液洗涤、干燥。

已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O
 2CrO42- + 2H+。
2CrO42- + 2H+。请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式
(2)“焙烧”过程中,所产生X气体的电子式为
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):
(4)滤渣1的主要成分是
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是
您最近一年使用:0次
解题方法
6 .
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:

操作Ⅱ发生反应的离子方程式为____________________ ;
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为_________________ 。
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
回答下列问题:
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是________ (填编号)。
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据________ (填“C1”或“C2”)所显示的温度,其温度应为__________________ 。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有___________ (填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案________ (填“合理”或“不合理”),理由是___________________________ 。
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:

操作Ⅱ发生反应的离子方程式为
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案
您最近一年使用:0次
7 . 回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境.
(1)用足量氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2和(NH4)2SO4两种产品.相关反应的化学方程式为________ 、________ .
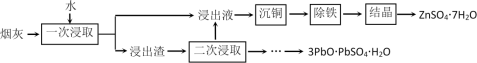
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等.烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是________ .
② “一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以________ (填化学式)残留在浸出渣中,“二次浸取”应选择_________ (填化学式)作浸取剂.
(3)从贵金属阳极泥中可提取粗银.电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为________ .阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为________ .
(1)用足量氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2和(NH4)2SO4两种产品.相关反应的化学方程式为

(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等.烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是
② “一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以
(3)从贵金属阳极泥中可提取粗银.电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为
您最近一年使用:0次
2016-12-09更新
|
538次组卷
|
2卷引用:2015届广东省广州市高三综合测试(二)理综化学试卷
8 . 钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成 分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:

(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:______________ 。
(2)写出焙烧时生成MoO3的化学方程式为:_______________________ 。
(3)写出“碱浸”反应的离子方程式:____________________________________ 。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,求SO42-的去除率(写出计算过程)____________ 。已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.040mol·L-1,Ksp(BaSO4)= 1.0×10-10、Ksp(BaMoO4)= 4.0×10=8,加入Ba(OH)2固体引起的溶液体积变化可忽略。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是______________ 。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4~Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,则NaNO2的作用______________ 。

(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:
(2)写出焙烧时生成MoO3的化学方程式为:
(3)写出“碱浸”反应的离子方程式:
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,求SO42-的去除率(写出计算过程)
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4~Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,则NaNO2的作用
您最近一年使用:0次
14-15高三上·广东汕头·期末
9 . 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
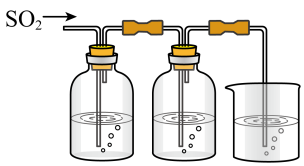
FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在_________ 中,再加水稀释,这样操作的目的是_____________________________ 。
(2)装置C的作用是____________________________________________ 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、__________ 、自然干燥,在这一系列操作中没有用到的仪器有________________________ (填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式_____________________________ ;
②请设计实验方案检验有Fe2+生成____________________________________ ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_________ (填“合理”或“不合理”),理由是______________________ 。
(5)能表明I-的还原性弱于SO2的现象是_____________________________________________ 。

FeCl3溶液含有淀粉的碘水NaOH溶液
ABC
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在
(2)装置C的作用是
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式
②请设计实验方案检验有Fe2+生成
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法(5)能表明I-的还原性弱于SO2的现象是
您最近一年使用:0次
2016-12-09更新
|
441次组卷
|
4卷引用:2014届广东省汕头市高三上学期期末考试理综化学试卷
(已下线)2014届广东省汕头市高三上学期期末考试理综化学试卷2015届甘肃省武威第五中学高三11月月考化学试卷2015届天津市河北区高三总复习质量检测一化学试卷2015届四川省德阳市高三4月模拟练习化学试卷
10 . 氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式:__________________ ;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论:____ ;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式:__________________ ;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。

限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是___________________ ;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂)_____________ ;
③写出该法验证NH3和O2存在的实验原理的化学方程式:___________________________ 。
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式:
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论:
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式:
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7
 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂)
③写出该法验证NH3和O2存在的实验原理的化学方程式:
您最近一年使用:0次



