1 . 已知方程式2H2(g) + O2(g)=2H2O(l) △H1=-571.6kJ/mol,则关于方程式H2O(l) = H2(g) +1/2O2(g) △H2=?的说法正确的是
| A.该反应一定不可能发生 | B.该反应△H2=-571.6kJ/mol |
| C.该反应△H2 =+ 285.8 kJ/mol | D.方程式中化学计量数表示分子数 |
您最近一年使用:0次
2017-12-05更新
|
179次组卷
|
2卷引用:福建省东山第二中学2017-2018学年高二上学期期中考试化学试题
名校
2 . 美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如下图所示),下列有关说法正确的是( )
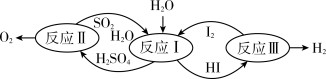

| A.设计该循环是为了制取能源气体O2 |
| B.整个循环过程中产生1 mol O2的同时产生44.8 L H2 |
| C.若反应Ⅰ、Ⅱ、Ⅲ的反应热分别为△H1、△H2、△H3,则△H1+△H2+△H3>0 |
| D.图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 |
您最近一年使用:0次
2017-11-30更新
|
610次组卷
|
8卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
3 . 由图分析,下列说法正确的是
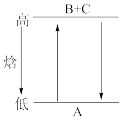

| A.A→B+C和B+C→A两个反应吸收或放出的能量不等 |
| B.A→B+C ΔH<0 |
| C.A具有的焓高于B和C具有的焓的总和 |
| D.A→B+C ΔH>0,则B+C→A ΔH<0 |
您最近一年使用:0次
2017-11-27更新
|
863次组卷
|
5卷引用:2016-2017学年福建省莆田二十五中高二上第一次月考化学卷
2016-2017学年福建省莆田二十五中高二上第一次月考化学卷(已下线)同步君 人教版 选修四 第一章 第一节 第一课时 焓变 反应热甘肃省秦安县第一中学2021-2022学年高二上学期期中考试化学试题(已下线)1.1.2 化学反应的焓变-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)高中化学人教版 选修四 第一章 化学反应与能量 第一节 化学反应与能量的变化 化学反应与能量第一课时(焓变 反应热)
解题方法
4 . 由于当今社会大家毫无节制的开采化石能源,能源短缺已成为人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化.请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键形成的过程.已知反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣93kJ•mol﹣1.试根据表中所列键能数据,计算a 的数值为______________________ kJ/mol.
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=Q1 kJ/mol
②H2O(g)═H2O(l)△H=Q2kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:__________________ .
(3)已知:H2(g)+ 1/2 O2(g)═H2O(1)△H=﹣285.83kJ•mol﹣1
CO(g)+ 1/2 O2(g)═CO2(g)△H=﹣282.9kJ•mol﹣1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为________________________ 计算结果保留一位小数).
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键形成的过程.已知反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣93kJ•mol﹣1.试根据表中所列键能数据,计算a 的数值为
| 化学键 | H﹣H | N﹣H | N≡N |
| 键能/kJ•mol﹣1 | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=Q1 kJ/mol
②H2O(g)═H2O(l)△H=Q2kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:
(3)已知:H2(g)+ 1/2 O2(g)═H2O(1)△H=﹣285.83kJ•mol﹣1
CO(g)+ 1/2 O2(g)═CO2(g)△H=﹣282.9kJ•mol﹣1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为
您最近一年使用:0次
名校
5 . I.(1)25℃、101kPa时,使1.0 g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50 KJ的热量,表示乙烯燃烧热的热化学方程式为_________________________ 。
(2)比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (g) ΔH2
则ΔH1________ ΔH2
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) = 2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) = 4 CO2 (g) +2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =_____ 。
II. 草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4- + 5H2C2O4 + 6H+ = 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
(4)如果研究催化剂对化学反应速率的影响,使用实验_______ 和____ (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_____ 和______ 。
(5)对比实验I和IV,可以研究_________________ 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 _______________________ 。
(2)比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (g) ΔH2
则ΔH1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) = 2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) = 4 CO2 (g) +2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =
II. 草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4- + 5H2C2O4 + 6H+ = 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | / |
| II | 2 mL | 20 | MnSO4固体 |
| III | 2 mL | 30 | / |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
(5)对比实验I和IV,可以研究
您最近一年使用:0次
2017-11-16更新
|
257次组卷
|
3卷引用:福建省永安市第九中学2022-2023学年高二上学期期中考试化学(选考)试题
名校
6 . 发射“神六“时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol |
| B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol |
| C.N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 568.35kJ/mol |
| D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol |
您最近一年使用:0次
2017-11-11更新
|
199次组卷
|
4卷引用:福建省莆田第一中学2017-2018学年高二下学期期初考试化学试题
名校
7 . (1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式___________________________
(2) 已知反应N2+3H2 2NH3 △H=a kJ·mol-1。试根据下表中所列键能数据估算a的数值为
2NH3 △H=a kJ·mol-1。试根据下表中所列键能数据估算a的数值为________________ 。
(3) 丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g) === 3CO2(g)+4H2O(l) ΔH=-akJ·mol-1
途径Ⅱ:C3H8(g) === C3H6(g)+H2(g) ΔH=+bkJ·mol-1
2C3H6(g)+9O2(g) === 6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) === 2H2O(l) ΔH=-d kJ/mol-1(a、b、c、d均为正值)。请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
②在C3H8(g) === C3H6(g)+H2(g)的反应中,反应物具有的总能量________ (填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________ (填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是__________ 。
③b与a、c、d的数学关系式是________________________ 。
(2) 已知反应N2+3H2
 2NH3 △H=a kJ·mol-1。试根据下表中所列键能数据估算a的数值为
2NH3 △H=a kJ·mol-1。试根据下表中所列键能数据估算a的数值为| 化学键 | H—H | N—H | N≡N |
| 键能KJ/mol | 436 | 391 | 945 |
(3) 丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g) === 3CO2(g)+4H2O(l) ΔH=-akJ·mol-1
途径Ⅱ:C3H8(g) === C3H6(g)+H2(g) ΔH=+bkJ·mol-1
2C3H6(g)+9O2(g) === 6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) === 2H2O(l) ΔH=-d kJ/mol-1(a、b、c、d均为正值)。请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
②在C3H8(g) === C3H6(g)+H2(g)的反应中,反应物具有的总能量
③b与a、c、d的数学关系式是
您最近一年使用:0次
名校
解题方法
8 .
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式____________________________________ 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式_____________________________ 。
(3)断裂1 mol化学键所需的能量如表所示:
计算1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的反应热△H = _______________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为________________ 。
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(3)断裂1 mol化学键所需的能量如表所示:
| 共价键 | H—N | H—O | N≡N | O==O |
| 断裂1 mol化学键所需能量/kJ | 393 | 463 | 941 | 496 |
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
11-12高二上·广东广州·期中
名校
解题方法
9 . 在298 K、101 kPa时,已知:
①2H2 (g)+O2 (g)=2H2O(g) ΔH1
②Cl2(g)+H2(g)=2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
①2H2 (g)+O2 (g)=2H2O(g) ΔH1
②Cl2(g)+H2(g)=2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
| A.ΔH3=2ΔH2-ΔH1 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
您最近一年使用:0次
2017-10-18更新
|
243次组卷
|
4卷引用:福建省德化一中、永安一中、漳平一中2017-2018学年高二上学期三校联考化学试题
福建省德化一中、永安一中、漳平一中2017-2018学年高二上学期三校联考化学试题(已下线)2011-2012学年广东省广州市第五中学高二上学期期中考试化学(理)试卷内蒙古包头市第一中学2017-2018学年高二上学期期中考试化学试题陕西省宝鸡市渭滨高中2020-2021学年高二上学期第一次月考化学试题
10 . CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________ kJ·mol-1。标准状况下的煤气(CO、H2)44.8 L与氧气反应生成CO2和H2O,反应过程中转移________ mol电子。
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
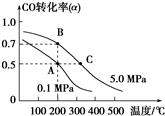
①若A、B两点表示在某时刻达到的平衡状态,此时在B点时容器的体积为6 L,则该温度下的平衡常数K=________ ;此时在A点时容器的体积VA_______ 6 L(填“大于”“小于”或“等于”)。该反应为________ (填“放热反应”或“吸热反应”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________ tC(填“大于”“小于”或“等于”)。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在B点时容器的体积为6 L,则该温度下的平衡常数K=
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
您最近一年使用:0次



