解题方法
1 . 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值。
已知:①CH4(g)+H2O(g) CO(g)+3H2(g)ΔH=+206.2kJ·mol-1
CO(g)+3H2(g)ΔH=+206.2kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)ΔH=-42.3kJ·mol-1
CO2(g)+H2(g)ΔH=-42.3kJ·mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为___________________ 。
(2)为了探究反应条件对反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-42.3kJ·mol-1
CO2(g)+H2(g) ΔH=-42.3kJ·mol-1
的影响,某活动小组设计了三个实验,实验曲线如图3所示
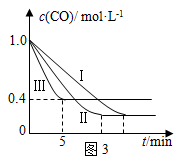
①请依据实验曲线图补充完整表格中的实验条件:X=______ ℃,Y=______ MPa。
②实验Ⅲ从开始至平衡,其平均反应速度率v(CO)=___________ mol·L-1·min-1。
③实验Ⅱ达平衡时CO的转化率________ 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”)。
④在530℃时,平衡常数K=1,若往1L容器中投入0.2molCO(g)、0.2molH2O(g)、0.1molCO2(g) 、0.1 mol H2(g),此时化学反应将_________ (填“正向”、“逆向”或“不”) 移动。
已知:①CH4(g)+H2O(g)
 CO(g)+3H2(g)ΔH=+206.2kJ·mol-1
CO(g)+3H2(g)ΔH=+206.2kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-42.3kJ·mol-1
CO2(g)+H2(g)ΔH=-42.3kJ·mol-1(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为
(2)为了探究反应条件对反应CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-42.3kJ·mol-1
CO2(g)+H2(g) ΔH=-42.3kJ·mol-1的影响,某活动小组设计了三个实验,实验曲线如图3所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol·L-1 | 3.0mol·L-1 |
| Ⅱ | X | Y | 1.0mol·L-1 | 3.0mol·L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol·L-1 | 3.0mol·L-1 |

①请依据实验曲线图补充完整表格中的实验条件:X=
②实验Ⅲ从开始至平衡,其平均反应速度率v(CO)=
③实验Ⅱ达平衡时CO的转化率
④在530℃时,平衡常数K=1,若往1L容器中投入0.2molCO(g)、0.2molH2O(g)、0.1molCO2(g) 、0.1 mol H2(g),此时化学反应将
您最近一年使用:0次
2016-12-09更新
|
201次组卷
|
2卷引用:2015-2016学年福建省三明一中高二下第一次月考化学试卷
12-13高一下·辽宁沈阳·期末
名校
2 . 碘与氢气反应的有关热化学方程式如下,下列说法正确的是
① I2(g)+H2(g) 2HI(g) △H=-9.48 kJ·mol–1
2HI(g) △H=-9.48 kJ·mol–1
② I2(s)+H2(g) 2HI(g) △H=+26.48 kJ·mol–1
2HI(g) △H=+26.48 kJ·mol–1
① I2(g)+H2(g)
 2HI(g) △H=-9.48 kJ·mol–1
2HI(g) △H=-9.48 kJ·mol–1② I2(s)+H2(g)
 2HI(g) △H=+26.48 kJ·mol–1
2HI(g) △H=+26.48 kJ·mol–1| A.①的产物比②的产物稳定 |
| B.②的反应物总能量比①的反应物总能量低 |
C.I2(s)  I2(g) △H=+17.00 kJ·mol–1 I2(g) △H=+17.00 kJ·mol–1 |
| D.在装有1mol I2(g)的密闭容器中通入1 mol H2(g),发生反应时放热9.48 kJ |
您最近一年使用:0次
2016-12-09更新
|
153次组卷
|
8卷引用:2015-2016学年福建省漳州一中高二上学期期末化学试卷
解题方法
3 . (1)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为____________________ 。
(2)已知: 2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1
则Al和FeO发生铝热反应的热化学方程式为:_______________________ 。
(2)已知: 2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1
则Al和FeO发生铝热反应的热化学方程式为:
您最近一年使用:0次
2016-12-09更新
|
399次组卷
|
2卷引用:福建省建瓯市芝华中学2020-2021学年高二上学期第一次阶段考化学试题
4 . 已知:(1)Zn(s)+ 1/2O2(g)=ZnO(s),ΔH= –348.3kJ/mol
(2) Zn(s)+ Ag2O(s)=ZnO(s)+ 2Ag(s),ΔH= –317.3kJ/mol
则2Ag(s)+ 1/2O2(g)=Ag2O(s)的ΔH等于( )
(2) Zn(s)+ Ag2O(s)=ZnO(s)+ 2Ag(s),ΔH= –317.3kJ/mol
则2Ag(s)+ 1/2O2(g)=Ag2O(s)的ΔH等于( )
| A.+31.0kJ/mol | B.-665.6kJ/mol | C.+332.8 kJ/mol | D.-31.0 kJ/mol |
您最近一年使用:0次
2016-12-09更新
|
256次组卷
|
8卷引用:2015-2016学年福建省师大附中高二上学期期末化学试卷
2015-2016学年福建省师大附中高二上学期期末化学试卷福建2020届高三化学总复习专题训练——选修四化学反应原理测试(已下线)1.2.2 反应热的计算 (练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)2019年秋高三化学复习强化练习—— 盖斯定律及应用2020届高三化学二轮冲刺新题专练——盖斯定律的应用12020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】2020届高三化学二轮复习—— 化学能与热能【精编选择25题】2020届高三化学知识点强化训练—化学能与热能
5 . 已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、a kJ·mol-1和462kJ·mol-1,则a为
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、a kJ·mol-1和462kJ·mol-1,则a为
| A.496 | B.118 | C.350 | D.130 |
您最近一年使用:0次
2016-12-09更新
|
383次组卷
|
4卷引用:福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题
福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题2014-2015学年重庆市主城区六校高二上期末联考化学试卷新疆阜康市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)2021年1月浙江高考化学试题变式题11-20
6 . 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为__________________________ ;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。_____ (填“CH4”或“O2”),b处电极上发生的电极反应式是______________ ;
②电镀结束后,装置Ⅰ中KOH溶液的浓度________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________ ;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________ ;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气________ L(标准状况下)。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
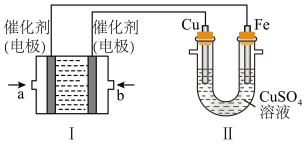
②电镀结束后,装置Ⅰ中KOH溶液的浓度
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗氧气
您最近一年使用:0次
2016-12-09更新
|
242次组卷
|
2卷引用:2014-2015福建省福州市第八中学高二下学期期中化学试卷
名校
7 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应不必加热就一定能发生 |
| C.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH不同 |
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
3卷引用:2014-2015福建省福州市第八中学高二下学期期中化学试卷
14-15高二上·河南周口·阶段练习
名校
解题方法
8 . 煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)=CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+ 1/2 O2(g)=H2O(g) ΔH=E3 ③
CO(g)+ 1/2 O2(g)=CO2(g) ΔH=E4 ④
回答:(1)与途径a相比途径b有较多的优点,即__________ 。
(2)上述四个热化学方程式中的哪个反应ΔH>0?_______ 。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为_________
a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)=CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+ 1/2 O2(g)=H2O(g) ΔH=E3 ③
CO(g)+ 1/2 O2(g)=CO2(g) ΔH=E4 ④
回答:(1)与途径a相比途径b有较多的优点,即
(2)上述四个热化学方程式中的哪个反应ΔH>0?
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为
您最近一年使用:0次
2016-12-09更新
|
339次组卷
|
6卷引用:2014-2015福建省长泰县一中高二上学期期中化学(理)试卷
14-15高二上·福建三明·阶段练习
9 . 已知:H2O(g)=H2O(l) ΔH=Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) ΔH=Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=Q3kJ·mol-1
若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
C2H5OH(g)=C2H5OH(l) ΔH=Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=Q3kJ·mol-1
若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
| A.(Q1+Q2+Q3) kJ | B.0.5(Q1+Q2+Q3) kJ |
| C.(0.5Q1-1.5Q2+0.5Q3) kJ | D.(3Q1-Q2+Q3) kJ |
您最近一年使用:0次
2016-12-09更新
|
174次组卷
|
6卷引用:2014-2015学年福建三明市一中高二上第一次月考化学试卷
(已下线)2014-2015学年福建三明市一中高二上第一次月考化学试卷(已下线)同步君 人教版 选修四 第一章 第三节 第一课时 盖斯定律2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷山西运城盐湖五中2018-2019学年高二第一学期9月月考化学试题西藏自治区拉萨市第二高级中学2019-2020学年高二上学期期末考试化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)
真题
名校
10 . 1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g) ∆H=-236.6kJ/mol
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g) ∆H=-272.7kJ/mol
由此不能判断
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g) ∆H=-236.6kJ/mol
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g) ∆H=-272.7kJ/mol
由此不能判断
| A.1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B.1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C.1,3-丁二烯和2-丁炔相互转化的热效应 |
| D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |
您最近一年使用:0次
2016-12-09更新
|
2871次组卷
|
15卷引用:福建省莆田九中2019-2020学年高二上学期期中考试化学试题
福建省莆田九中2019-2020学年高二上学期期中考试化学试题2014-2015辽宁省沈阳二中高二上学期期末化学试卷2015-2016学年湖北省孝感高中高二5月月考化学试卷河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题(已下线)2018年12月21日 《每日一题》人教选修4-盖斯定律安徽省六安市舒城中学2018-2019学年高二下学期第二次月考化学试题【市级联考】安徽省池州市2019-2020学年高二第一学期九月份素质检测(开学考试)化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 章末综合检测卷黑龙江省大庆实验中学2020-2021学年高二10月月考化学试题四川省广安代市中学校2021-2022学年高二上学期9月考化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)2015届上海市五校高三上学期联合教学质量调研化学试卷2017届全国新课程高考仿真信息理综(一)化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)



