12-13高二下·福建厦门·期中
1 . 铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是_______ 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3=4Al+3LiCl+6H2↑,该反应的氧化剂为_______ 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=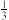 Na3AlH6 (s)+
Na3AlH6 (s)+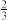 Al (s) + H2(g) ΔH=+ 37 kJ·mol-1
Al (s) + H2(g) ΔH=+ 37 kJ·mol-1
Na3AlH6(s)=3NaH(s)+Al (s) + H2(g) ΔH=+ 70.5 kJ·mol-1
H2(g) ΔH=+ 70.5 kJ·mol-1
则NaAlH4(s)=NaH(s)+Al (s) + H2(g) ΔH=
H2(g) ΔH=_______ 。
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO 形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO
形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO +3H2O =2[Al(OH) 4]-+OH-
+3H2O =2[Al(OH) 4]-+OH-
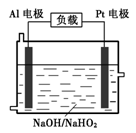
①正极反应式为_______ 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的_______ 倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为_______ 。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3=4Al+3LiCl+6H2↑,该反应的氧化剂为
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=
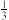 Na3AlH6 (s)+
Na3AlH6 (s)+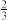 Al (s) + H2(g) ΔH=+ 37 kJ·mol-1
Al (s) + H2(g) ΔH=+ 37 kJ·mol-1Na3AlH6(s)=3NaH(s)+Al (s) +
 H2(g) ΔH=+ 70.5 kJ·mol-1
H2(g) ΔH=+ 70.5 kJ·mol-1则NaAlH4(s)=NaH(s)+Al (s) +
 H2(g) ΔH=
H2(g) ΔH=(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO
 形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO
形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO +3H2O =2[Al(OH) 4]-+OH-
+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为
您最近一年使用:0次
12-13高二下·福建泉州·期中
名校
2 . 科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在25℃、105 Pa时,C(石墨) + O2(g) = CO2(g) ΔH = -393. 5 kJ·mol-1
2CO(g) + O2(g) = 2CO2(g) ΔH =-566.0 kJ·mol-1
下列说法或方程式正确的是
2CO(g) + O2(g) = 2CO2(g) ΔH =-566.0 kJ·mol-1
下列说法或方程式正确的是
| A.在相同条件下:2C(石墨) + O2(g) = 2CO(g) ΔH =-110.5 kJ·mol-1 |
| B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ |
| C.在相同条件下:C(石墨) + CO2(g) = 2CO(g) ΔH =-172.5 kJ·mol-1 |
| D.已知金刚石燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热 |
您最近一年使用:0次
2016-12-09更新
|
1250次组卷
|
3卷引用:2012-2013学年福建省晋江市季延中学高二下学期期中考试化学试卷
(已下线)2012-2013学年福建省晋江市季延中学高二下学期期中考试化学试卷贵州省思南中学2019-2020学年高二9月月考化学试题甘肃省张掖市高台县第一中学2022--2023学年高二上学期10月模拟考试化学试题
10-11高三上·福建泉州·期末
名校
3 . 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g) △H=+255.6kJ•mol-1
b.CH3CH2OH(g)+ O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
则下列说法不正确的是( )
a.CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g) △H=+255.6kJ•mol-1
b.CH3CH2OH(g)+
 O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1则下列说法不正确的是( )
| A.降低温度,可提高b路线中乙醇的转化率 |
| B.从能量消耗的角度来看,b路线制氢更加有利 |
| C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源 |
| D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol-1 |
您最近一年使用:0次
2016-12-09更新
|
1048次组卷
|
9卷引用:福建省连城县第一中学2019-2020学年高二下学期期中考试化学试题
福建省连城县第一中学2019-2020学年高二下学期期中考试化学试题(已下线)福建省泉州市四校2010届高三上学期期末联考(化学)2016届福建省厦门第一中学高三上学期期中考试化学试卷2015-2016学年甘肃省会宁一中高二上期中(理)化学试卷广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题广东省中山市第一中学2018-2019学年高二上学期第一次段考化学试题(已下线)第06练 化学反应的调控-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)2013届甘肃省甘谷一中高三第五次检测化学试卷
4 . 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣889.6kJ/mol
请回答下列问题:
(1)反应物能量总和_______ (填“大于”、“小于”或“等于”)生成物能量总和.
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量_______ (填“>”、“<”或“=”)889.6kJ.
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________ .
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池.
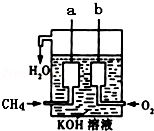
①该电池的负极是________ (填“a”或“b”)电极,该极的电极反应式是_______________ .
②电池工作一段时间后电解质溶液的pH____________ (填“增大”、“减小”或“不变”).
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣889.6kJ/mol
请回答下列问题:
(1)反应物能量总和
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池.

①该电池的负极是
②电池工作一段时间后电解质溶液的pH
您最近一年使用:0次
11-12高二·福建龙岩·阶段练习
解题方法
5 . 回答下列问题:
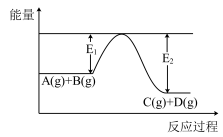
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H______ 0(填“>”、“<”或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2(g)+ H2(g) △H2=-7.0 kJ/mol
则甲酸的分子式为___________ ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为_______________ 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应:____________ 。
II若试管内液面下降,则发生___________ 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在_______ (填“甲”或“乙”)溶液中腐蚀的速度快。
(1)反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2(g)+ H2(g) △H2=-7.0 kJ/mol
则甲酸的分子式为
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应:
II若试管内液面下降,则发生
III若溶液甲为水,溶液乙为海水,则铁钉在
您最近一年使用:0次
9-10高二下·广东湛江·期中
名校
6 . 下列变化属于氮的固定的是( )
| A.N2与H2在一定条件下反应生成NH3 |
| B.NO和O2反应生成NO2 |
| C.NH3经催化氧化生成NO |
| D.由NH3制NH4HCO3和(NH4)2SO4 |
您最近一年使用:0次
2016-12-09更新
|
813次组卷
|
21卷引用:福建省福州市琅岐中学2017-2018学年高二下学期期中考试化学试题
福建省福州市琅岐中学2017-2018学年高二下学期期中考试化学试题(已下线)2010年广东省湛江二中高二第二学期期中考试化学(文)试题福建省福州市连江第五中学2020-2021学年高一下学期第一次质量检测化学试题上海市长征中学2020-2021学年高二下学期期中考试化学试题福建省泉州惠南中学2023-2024学年高一下学期3月月考化学试题(已下线)2010年湖南省长沙市第一中学高三上学期第四次月考化学卷(已下线)2012届湖北省襄樊四中高三11月月考化学试卷(已下线)2011-2012学年广东省惠阳高级中学高一上学期期末考试化学试卷(已下线)2011-2012学年四川省南山中学高一下学期3月月考化学试卷(已下线)2011-2012年浙江宁波万里国际中学高一第二学期期中考试化学试卷(已下线)2012届湖北省襄樊四中高三11月月考化学试卷2014-2015山东省东营市一中高一上学期第三次模块考试化学试卷2015-2016学年吉林省长春第十一高中高一上期末化学试卷2016-2017学年山西省太原市第五中学高一3月阶段性测试化学试卷内蒙古巴彦淖尔市第一中学2016-2017学年高一3月月考化学试题安徽省濉溪县临涣中学2017-2018学年高一上学期第二次月考化学试题山东省夏津一中2018-2019学年高一上学期12月月考化学试题【全国百强校】甘肃省天水一中2018-2019学年高一(文科)下学期第一阶段考试化学试题陕西省吴起高级中学2019-2020学年高一下学期第一次质量检测化学试题上海市松江区2021届高三一模化学试卷上海市进才中学2022-2023学年高一下学期5月月考化学试题
10-11高二下·福建福州·期末
7 . (1)已知:
O2(g) = O+2(g) + e- H1=+ 1175.7 kJ·mol-1
H1=+ 1175.7 kJ·mol-1
PtF6(g) + e-= PtF6-(g) H2=- 771.1 kJ·mol-1
H2=- 771.1 kJ·mol-1
O2+ PtF6-(s) = O2+(g) + PtF6- H3=+482.2kJ·mol-1
H3=+482.2kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s) H=
H=_____________ kJ·mol-1
(2)由C和S形成的液态化合物CS2,0.2mol/l CS2在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为________ 。
(3)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为_____ 酸(填“强”或“弱”),H2A的电离方程式为_________________ ,该溶液中由水电离出的c(H+)=________________ 。
(4)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a________ b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a____ b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a________ b
O2(g) = O+2(g) + e-
 H1=+ 1175.7 kJ·mol-1
H1=+ 1175.7 kJ·mol-1PtF6(g) + e-= PtF6-(g)
 H2=- 771.1 kJ·mol-1
H2=- 771.1 kJ·mol-1O2+ PtF6-(s) = O2+(g) + PtF6-
 H3=+482.2kJ·mol-1
H3=+482.2kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)
 H=
H=(2)由C和S形成的液态化合物CS2,0.2mol/l CS2在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为
(3)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为
(4)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a
您最近一年使用:0次
11-12高二上·福建福州·阶段练习
名校
解题方法
8 . 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H1kJ·mol﹣1; H2O(g)=H2O(1) △H2kJ·mol﹣1; C2H5OH(g)=C2H5OH(1) △H3kJ·mol﹣1,若使23 g C2H5OH(1)完全燃烧生成H2O(1),则放出的热量为______________
您最近一年使用:0次
2011高二·福建龙岩·学业考试
解题方法
9 . (1) 2010年10月1日下午18时59分57秒,中国探月二期工程先导星“嫦娥二号”在西昌点火升空,准确入轨。“嫦娥二号”所用燃料为液氢和液氧。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式_______ ;
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为_______ ;
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图_______ ;
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)_______ 。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
H2(g)=H2(l) △H=-0.92kJ·mol-1 ;
O2(g)=O2(l) △H=-6.84kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式
(2)美国的探月飞船“阿波罗号”使用的氢氧燃料电池,电解液为氢氧化钾溶液,其负极反应式为
(3)设计方案实现2HCl+2Cu= CuCl2+H2↑反应,画出装置图
(4)pH相同的四种电解质溶液:①Na2CO3 ②NaHCO3 ③CH3COONa ④ NaOH,
其物质的量浓度由大到小的顺序是(填编号)
您最近一年使用:0次
11-12高二上·福建泉州·期末
解题方法
10 . 回答下列问题:
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2→2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式:______ 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为______ 极,电极反应式为______
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:______
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______
③下列哪个装置可防止铁棒被腐蚀______
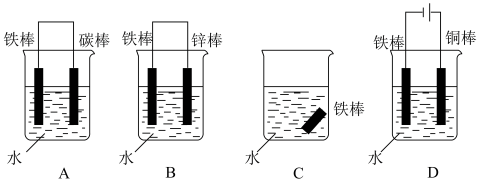
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
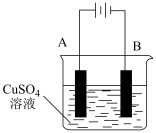
A电极对应的金属是______ (写元素名称),B电极的电极反应式是______
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2→2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g)⇌CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式:
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
③下列哪个装置可防止铁棒被腐蚀

④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:

A电极对应的金属是
您最近一年使用:0次



