解题方法
1 . 催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=-3412 kJ·mol-1
2SO2(g)+O2(g)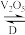 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=-130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为_______ kJ。
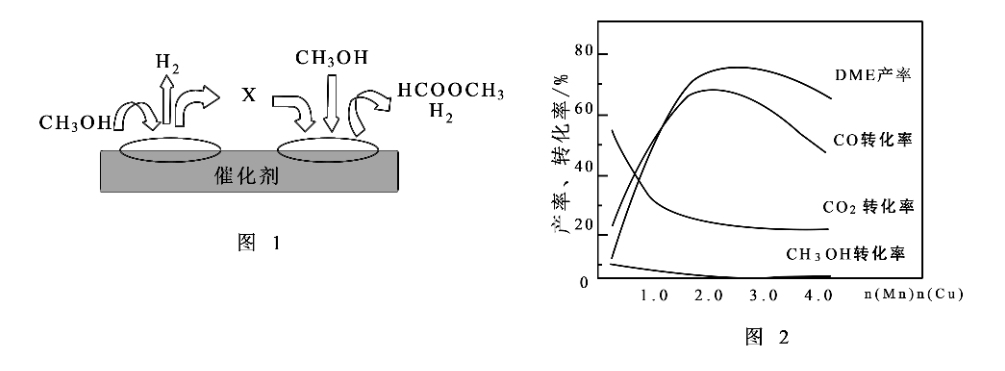
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为__________ 。
(3)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②____________ 。
(4)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO ,该反应的离子方程式为
,该反应的离子方程式为____________ 。
(5)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl ,
,
Sn2++4Cl-+2HgCl2=SnCl +Hg2Cl2↓,
+Hg2Cl2↓,
6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。
+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量___________ (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量________ 。
(6)①可选用______ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是___ (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________ ;
b.沉淀:_______ ;
c.分离,洗涤;
d.烘干,研磨。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=-3412 kJ·mol-1
2SO2(g)+O2(g)
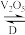 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1SO3(g)+H2O(l)=H2SO4(l) △H=-130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)
 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0第二步:HCOOCH3(g)
 CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为


(3)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②
(4)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO
 ,该反应的离子方程式为
,该反应的离子方程式为(5)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl
 ,
,Sn2++4Cl-+2HgCl2=SnCl
 +Hg2Cl2↓,
+Hg2Cl2↓,6Fe2++Cr2O
 +14H+=6Fe3++2Cr3++7H2O。
+14H+=6Fe3++2Cr3++7H2O。①若SnCl2不足量,则测定的Fe3+量
②若不加HgCl2,则测定的Fe3+量
(6)①可选用
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:
b.沉淀:
c.分离,洗涤;
d.烘干,研磨。
您最近一年使用:0次



