解题方法
1 . 2030年前实现碳达峰的承诺,体现了中国的大国风范。甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一、甲烧和二氧化碳重整制合成气的反应为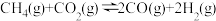
 。
。
已知:i.部分化学键键能数据如下表。
ii.副反应Ⅰ:
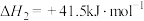
副反应Ⅱ:

(1)①
___________  ,
,
___________  。
。
②副反应Ⅱ属于___________ (选填“熵增”或“熵减”)反应。
(2)已知甲烷和二氧化碳重整制合成气反应的正反应速率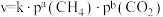 ,k为速率常数。900℃时,其他反应条件不变,只改变
,k为速率常数。900℃时,其他反应条件不变,只改变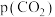 或
或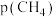 时,正反应速率v的变化如图1所示。
时,正反应速率v的变化如图1所示。
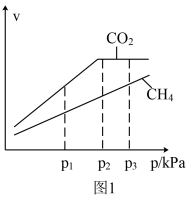
①若 和
和 的分压均为p1时,a=
的分压均为p1时,a=___________ ,b=___________ 。
②若 和
和 的分压相等,分别为p2和p3两种情况下的正反应速率之比为
的分压相等,分别为p2和p3两种情况下的正反应速率之比为___________ 。
(3)在一定条件下,向某密闭容器中充入一定量的甲烷和二氧化碳,同时发生上述三个反应。反应过程中的 平衡转化率(α)与温度和压强的关系如图2所示。
平衡转化率(α)与温度和压强的关系如图2所示。
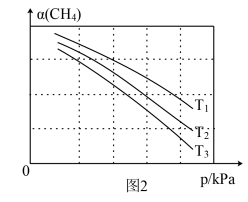
 值随压强升高而减小的原因为
值随压强升高而减小的原因为___________ ;图2中的温度由大到小为___________ ,其判断理由为___________ 。
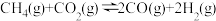
 。
。已知:i.部分化学键键能数据如下表。
| 化学键 | C-H | C=O | H-H |  |
| 键能/(kJ/mol) | 413 | 745 | 436 | 1011 |

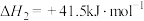
副反应Ⅱ:


(1)①

 ,
,
 。
。②副反应Ⅱ属于
(2)已知甲烷和二氧化碳重整制合成气反应的正反应速率
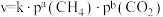 ,k为速率常数。900℃时,其他反应条件不变,只改变
,k为速率常数。900℃时,其他反应条件不变,只改变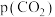 或
或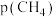 时,正反应速率v的变化如图1所示。
时,正反应速率v的变化如图1所示。
①若
 和
和 的分压均为p1时,a=
的分压均为p1时,a=②若
 和
和 的分压相等,分别为p2和p3两种情况下的正反应速率之比为
的分压相等,分别为p2和p3两种情况下的正反应速率之比为(3)在一定条件下,向某密闭容器中充入一定量的甲烷和二氧化碳,同时发生上述三个反应。反应过程中的
 平衡转化率(α)与温度和压强的关系如图2所示。
平衡转化率(α)与温度和压强的关系如图2所示。
 值随压强升高而减小的原因为
值随压强升高而减小的原因为
您最近一年使用:0次
2 . 钯催化剂(主要成分为 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的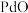 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
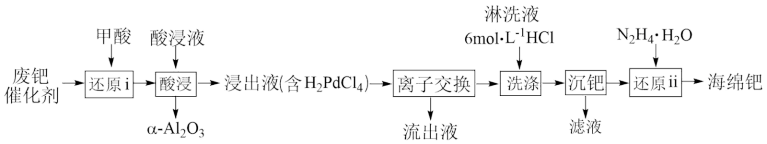
(1)“还原i”加入甲酸的目的是还原_______ (填化学式)。
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择_______ (填标号)。
A.王水(浓硝酸和浓盐酸按体积比 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
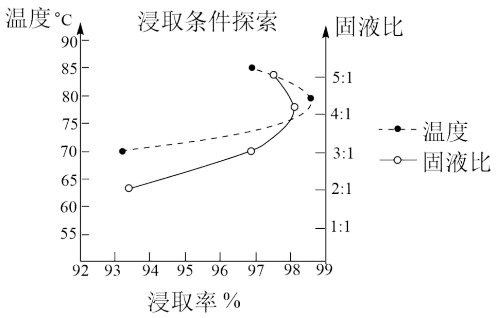
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。
①“离子交换”流出液中阳离子有 、
、_______ (填离子符号)。
②淋洗液需保持 小于2的原因是
小于2的原因是_______ 。
(4)“沉钯”过程钯元素主要发生如下转化: (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是_______ 。
(5)“还原ii”中产生无毒无害气体。由 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为_______ 。
(6)该工艺流程中可循环利用的物质有_______ 。
 ,还含少量铁、铜等元素)在使用过程中,
,还含少量铁、铜等元素)在使用过程中, 易被氧化为难溶于酸的
易被氧化为难溶于酸的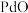 而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
而失活。一种从废钯催化剂中回收海绵钯的工艺流程如图。
(1)“还原i”加入甲酸的目的是还原
(2)“酸浸”过程:
①从绿色化学要求出发,酸浸液应选择
A.王水(浓硝酸和浓盐酸按体积比
 混合) B.盐酸和
混合) B.盐酸和 C.盐酸和
C.盐酸和
②温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为

(3)“离子交换”和“洗脱”可简单表示为:
 ,(
,( 为阴离子交换树脂)。
为阴离子交换树脂)。①“离子交换”流出液中阳离子有
 、
、②淋洗液需保持
 小于2的原因是
小于2的原因是(4)“沉钯”过程钯元素主要发生如下转化:
 (稀溶液)
(稀溶液) (稀溶液)
(稀溶液) (沉淀)。“沉钯”的目的是
(沉淀)。“沉钯”的目的是(5)“还原ii”中产生无毒无害气体。由
 生成海绵钯的化学方程式为
生成海绵钯的化学方程式为(6)该工艺流程中可循环利用的物质有
您最近一年使用:0次
2022-01-21更新
|
970次组卷
|
3卷引用:河北省石家庄市第二中学2022届高三2.5模化学试题
3 . Fe3+与SCN-的配位平衡是研究化学热力学原理的重要载体。向5 mL0.005 mol/LFeCl3溶液中加入5 mL0.01 mol/LKSCN溶液,溶液变红,t秒时测得溶液中c(Fe3+)=0.001 mol/L,待稳定后将溶液均分于两支试管中,完成下列实验。
下列说法正确的是
| 试管 | 操作 | 现象 |
| Ⅰ | 滴入1 mol/LKSCN溶液4滴 | 溶液红色加深 |
| Ⅱ | 加入饱和FeCl3溶液4滴 | 溶液红色加深 |
A.离子方程式: |
B.t时间内,反应平均速率 |
| C.试管Ⅰ溶液颜色加深说明该反应是可逆反应 |
| D.将试管Ⅱ饱和FeCl3溶液换为KCl固体,现象相同 |
您最近一年使用:0次
2022-01-14更新
|
314次组卷
|
3卷引用:河北省石家庄市第二十四中学2023-2024学年高二上学期10月月考化学试题
2021·山东济南·一模
名校
4 . 在热带海域中,珊瑚虫在浅海区域分泌石灰石骨骼,与藻类共生形成美丽的珊瑚。下列说法错误的是
A.珊瑚形成的反应为Ca2+ (aq)+2HCO (aq)⇌ CaCO3(s)+ H2O(l)+CO2(aq) (aq)⇌ CaCO3(s)+ H2O(l)+CO2(aq) |
| B.与温带海域相比,热带海域水温较高是利于形成珊瑚的原因之一 |
| C.与深海区域相比,浅海区阳光强烈,藻类光合作用强,更有利于珊瑚形成 |
D.大气中CO2浓度增加,会导致海水中CO 浓度增大,有利于珊瑚形成 浓度增大,有利于珊瑚形成 |
您最近一年使用:0次
2022-01-13更新
|
520次组卷
|
7卷引用:选择题11-15
(已下线)选择题11-15山东省济南市2021-2022学年上学期高三上学期1月学情检测化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)山东省枣庄市2022-2023学年高二上学期期末考试化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期10月月考化学试题辽宁省六校协作体2023-2024学年高二上学期12月月考化学试题2024届内蒙古自治区包头市高三下学期三模理科综合试题-高中化学
名校
5 . 某实验小组研究一定温度下的反应:2M(g) N(g),根据表格中实验数据绘制的浓度—时间曲线如图所示,下列说法错误的是
N(g),根据表格中实验数据绘制的浓度—时间曲线如图所示,下列说法错误的是
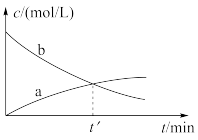
 N(g),根据表格中实验数据绘制的浓度—时间曲线如图所示,下列说法错误的是
N(g),根据表格中实验数据绘制的浓度—时间曲线如图所示,下列说法错误的是
| t/min | 0 | 1 | 2 | 3 |
| c(M)/mol/L | 0.16 | 0.10 | 0.04 | 0.02 |
| c(N)/mol/L | 0 | 0.03 | 0.06 | 0.07 |
| A.曲线a是N的浓度变化曲线 |
| B.在3min内,随着M浓度减小,正反应速率减小,逆反应速率减小 |
| C.1~3min内,v(M)=0.04mol·L-1·min-1 |
D.t′时, =1,反应并未达到平衡状态 =1,反应并未达到平衡状态 |
您最近一年使用:0次
解题方法
6 . 下列选项中出现的情况不能用勒夏特列原理解释的是
| A.使用含有氟化钠的牙膏可以防止龋齿 |
| B.硫酸亚铁溶液在空气中久置产生红褐色沉淀 |
| C.保存过久的古书籍易腐烂,因为古代的纸张中含有硫酸铝 |
| D.在净水过程中,除了加入明矾外,往往再加入少量碳酸氢钠,以增强净水能力 |
您最近一年使用:0次
7 . 将氯化氢转化为氯气的技术是科学研究的热点。 发明的直接氧化法是将
发明的直接氧化法是将 。如图为刚性容器中,进料浓度比
。如图为刚性容器中,进料浓度比 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

(1)反应平衡常数
_______  填>、<或=
填>、<或= 。
。
(2)设HCl初始浓度为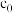 ,进料浓度比
,进料浓度比 :1的曲线是图中的
:1的曲线是图中的_______ (填A、B或C)。根据该进料浓度比曲线,计算平衡常数
_______  用含有
用含有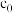 的表达式作答,要求化到最简)。
的表达式作答,要求化到最简)。
(3)按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 、过低均会给生产带来不利影响,分别是
、过低均会给生产带来不利影响,分别是_______ 、_______
(4) 直接氧化法可按下列催化过程进行:
直接氧化法可按下列催化过程进行:



则 直接氧化法的热反应方程式为:
直接氧化法的热反应方程式为:_______ 。
 发明的直接氧化法是将
发明的直接氧化法是将 。如图为刚性容器中,进料浓度比
。如图为刚性容器中,进料浓度比 分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
(1)反应平衡常数

 填>、<或=
填>、<或= 。
。(2)设HCl初始浓度为
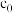 ,进料浓度比
,进料浓度比 :1的曲线是图中的
:1的曲线是图中的
 用含有
用含有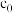 的表达式作答,要求化到最简)。
的表达式作答,要求化到最简)。(3)按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比
 、过低均会给生产带来不利影响,分别是
、过低均会给生产带来不利影响,分别是(4)
 直接氧化法可按下列催化过程进行:
直接氧化法可按下列催化过程进行:


则
 直接氧化法的热反应方程式为:
直接氧化法的热反应方程式为:
您最近一年使用:0次
8 . 对于反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49kJ/mol,下列说法错误的是
A.增大 的值,可提高H2的转化率 的值,可提高H2的转化率 |
| B.升高温度,正、逆反应的反应速率均增大 |
C.达平衡后,其他条件不变,缩小容器体积, (正)> (正)> (逆) (逆) |
| D.lmolCO2和3molH2充分反应时放出49kJ热量 |
您最近一年使用:0次
名校
9 . 已知反应:2NO2(红棕色) N2O4(无色) ΔH<0,将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),下列说法正确的是
N2O4(无色) ΔH<0,将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),下列说法正确的是
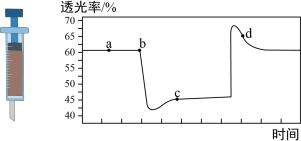
 N2O4(无色) ΔH<0,将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),下列说法正确的是
N2O4(无色) ΔH<0,将一定量的NO2充入注射器后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),下列说法正确的是
| A.b点的操作为拉伸注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
C.d点 正< 正< 逆 逆 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
您最近一年使用:0次
2021-12-29更新
|
466次组卷
|
11卷引用:河北省唐山市玉田县2018-2019学年高二上学期期中考试化学试题
河北省唐山市玉田县2018-2019学年高二上学期期中考试化学试题河北省正定县弘文中学2020-2021学年高二上学期9月月考化学(理)试题河北省石家庄市正定县2020-2021学年高二上学期月考化学(理)试题2015届浙江省东阳市高三5月模拟考试理综化学试卷2015-2016学年浙江省桐乡市高级中学高二上期中(实验班)化学试卷浙江省之江教育评价2020-2021学年高二下学期期中联考化学试题广东省广雅中学2021-2022学年高二上学期期中考试化学试题广东省珠海市斗门区第一中学2022-2023学年高二上学期第一次考试化学试题浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题山东省青岛第二中学2019-2020学年高二上学期期中考试化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题
名校
10 . 一定温度下,向1.0L恒容密闭容器中充入2 mol SO2和1 mol O2发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
2SO3(g) ΔH<0。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是
 2SO3(g) ΔH<0。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
2SO3(g) ΔH<0。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:| t/s | 0 | 2 | 4 | 6 | 8 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A.4 s内反应的平均速率v(O2)=0.35 mol· L-1·s-1 |
| B.该反应的平衡常数K=810 |
| C.保持温度不变,向容器中再充入2 mol SO2、1 mol O2,反应的平衡常数增大 |
| D.此温度下,若该容器中有0.1 mol SO2、0.5 mol O2和0.8 mol SO3,则反应逆向进行 |
您最近一年使用:0次
2021-12-25更新
|
518次组卷
|
2卷引用:河北省部分学校2021-2022学年高二上学期第三次月考化学试题



