名校
解题方法
1 . 已知反应S2O (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )

①2Fe3+(aq)+2I-(aq) I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
②2Fe2+(aq)+S2O (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)
 (aq)+2I-(aq)
(aq)+2I-(aq) 2SO
2SO (aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是 ( )
①2Fe3+(aq)+2I-(aq)
 I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)②2Fe2+(aq)+S2O
 (aq)
(aq) 2Fe3+(aq)+2SO
2Fe3+(aq)+2SO (aq)
(aq)| A.Fe3+是该反应的催化剂,加入Fe3+后降低了该反应的活化能 |
| B.反应①比反应②所需活化能大 |
| C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深 |
| D.该反应可设计成原电池 |
您最近半年使用:0次
2020-09-25更新
|
1721次组卷
|
14卷引用:内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题
内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题山西省大同市2021届高三上学期学情调研测试化学试题辽宁省六校协作体2021届高三第一次联考化学试题江西省赣州市会昌县七校2021届高三联合9月月考化学试题辽宁省开原市中固镇第二中学2021届高三上学期9月月考化学试题江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三上学期第一次联考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期期中考试化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(1班)试题吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题
名校
2 . 对于可逆反应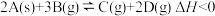 ,在一定条件下达到平衡状态,下列有关叙述正确的是( )
,在一定条件下达到平衡状态,下列有关叙述正确的是( )
①增大物质A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动, 减小
减小
③压强增大一倍,平衡不移动, 、
、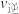 不变
不变
④增大物质B的浓度,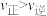
⑤加入催化剂,物质B的转化率提高
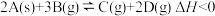 ,在一定条件下达到平衡状态,下列有关叙述正确的是( )
,在一定条件下达到平衡状态,下列有关叙述正确的是( )①增大物质A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,
 减小
减小③压强增大一倍,平衡不移动,
 、
、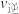 不变
不变④增大物质B的浓度,
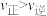
⑤加入催化剂,物质B的转化率提高
| A.①②⑤ | B.④ | C.②③④ | D.④⑤ |
您最近半年使用:0次
2020-09-20更新
|
222次组卷
|
3卷引用:内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题
内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)题型118 化学平衡移动的影响因素
名校
解题方法
3 . 将一定量纯净的氨基甲酸铵(NH2COONH4)粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )
 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法正确的是( )| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.该反应的ΔH<0 |
| B.该反应在较低温度下能自发进行 |
| C.25℃时平衡常数的值K≈1.6×10-8 |
| D.再加入少量NH2COONH4平衡正向移动 |
您最近半年使用:0次
2020-09-15更新
|
325次组卷
|
5卷引用:内蒙古自治区呼和浩特市第二中学2019-2020学年高二上学期月考化学试题
内蒙古自治区呼和浩特市第二中学2019-2020学年高二上学期月考化学试题湖南省衡阳市第八中学2020-2021学年高二上学期10月月考化学试题(已下线)专题2.3 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)广东深圳市第二外国语学校2021-2022学年高二上学期期中测试化学试题广东省广州市育才中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 如图所示,在密闭容器中发生反应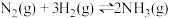
 ,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
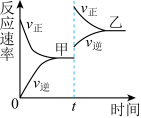
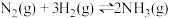
 ,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
| A.加入适当催化剂 | B.升高温度 |
| C.增大反应物的浓度 | D.增大压强 |
您最近半年使用:0次
2020-09-13更新
|
338次组卷
|
15卷引用:内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题
内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷云南省楚雄州2016-2017学年高二下学期期末考试化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题辽宁省盘锦市第二高级中学2019-2020学年高二10月月考化学试题湖南省益阳市第六中学2019-2020学年高二上学期期中考试化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第一次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高二上学期第二次月考化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节综合训练高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 第二节综合训练(已下线)清远市2016-2017学年度第一学期期末教学质量检测高二化学试题选择性必修1 专题2 第三单元综合训练2.3.1浓度 压强变化对化学平衡的影响 课后安徽省怀宁县第二中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 下列叙述及解释正确的是
A. 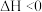 ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 ,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 |
B. 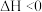 ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 ,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
C. ,在达到平衡后,加少量 ,在达到平衡后,加少量 固体,因为平衡向逆反应方向移动,故体系颜色变浅 固体,因为平衡向逆反应方向移动,故体系颜色变浅 |
D.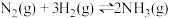 ,在达到平衡后,保持压强不变,充入 ,在达到平衡后,保持压强不变,充入 ,平衡向左移动 ,平衡向左移动 |
您最近半年使用:0次
2020-09-13更新
|
379次组卷
|
14卷引用:内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题
内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题【全国百强校】天津市静海县第一中学2018-2019学年高二上学期9月学生学业能力调研化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第一次月考化学试题天津市静海区第一中学2020届高三下学期第六周周末训练化学试题河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(一)化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)2.3.2影响化学平衡状态的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖南省衡阳市第八中学2020-2021学年高二上学期10月月考化学试题辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题
名校
6 . 下列叙述中,不能用勒夏特列原理解释的是
| A.高压比常压有利于SO2与O2合成SO3的反应 |
| B.加入催化剂有利于N2与H2合成NH3的反应 |
| C.向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 |
| D.工业制取金属钾Na(1)+KCl(l)⇌NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
您最近半年使用:0次
2020-09-05更新
|
77次组卷
|
2卷引用:内蒙古自治区呼和浩特市内蒙古师范大学附属中学2019-2020学年高二上学期期中考试化学试题
名校
解题方法
7 . 下列变化不能用勒夏特列原理释解的是( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.H2、I2(g)、HI混合气体加压后颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |
您最近半年使用:0次
2020-08-10更新
|
363次组卷
|
17卷引用:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷
2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(已下线)2014届四川省雅安中学高二下学期4月月考化学试卷2015-2016学年黑龙江省红兴隆第一高级中学高二上期中理科化学试卷2016-2017学年河北省博野中学高二上学期第二次月考化学试卷2016-2017学年四川省资阳市高二上学期期末化学试卷湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题河南省焦作市博爱县第一中学2018届高三上学期收心考试化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题云南省昆明市禄劝彝族苗族自治县第一中学2019-2020学年高二下学期期中考试化学试题四川省凉山州2019-2020学年高二下学期期末检测化学(理)试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林省长春市实验中学2020-2021学年高二上学期开学考试化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题吉林省长春汽车经济技术开发区第六中学2020-2021学年高二上学期月考化学试题吉林省榆树市第一高级中学校2021-2022学年高二上学期期中检测化学试题四川省凉山州西昌天立中学2021-2022学年高二下学期5月月考化学试题河南省宜阳县第一高级中学2023-2024学年高二上学期9月开学考试化学试题
名校
8 . 某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是| A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
您最近半年使用:0次
2020-05-28更新
|
539次组卷
|
21卷引用:内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题
内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题(已下线)2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷2015-2016学年黑龙江省牡丹江高级中学高二上期末化学卷山东省济南第一中学2017-2018学年高二上学期期中考试化学试题河南省滑县第二高级中学2017-2018学年高二12月月考化学试题【全国百强校】山东省济南第一中学2018-2019学年高二上学期期中考试化学试题江西省遂川中学2017-2018学年高二上学期第三次月考化学试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)安徽省滁州市定远县育才学校2019-2020学年高二上学期期中考试(普通班)化学试题吉林省延边第二中学2019-2020学年高二12月月考化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期末考试化学试题广东省第二师范学院番禺附属中学2019-2020学年高二下学期期中段考化学试题(已下线)2.3.2 压强变化对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)福建省泰宁第一中学2018-2019学年高二上学期第二阶段考试化学(理)试题贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(理)试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题福建省三明市泰宁县福建省泰宁第一中学2019-2020学年高二上学期第二次阶段考试化学试题安徽省宿州市砀山中学2021-2022学年高二上学期第一次质量检测化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
9 . 合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
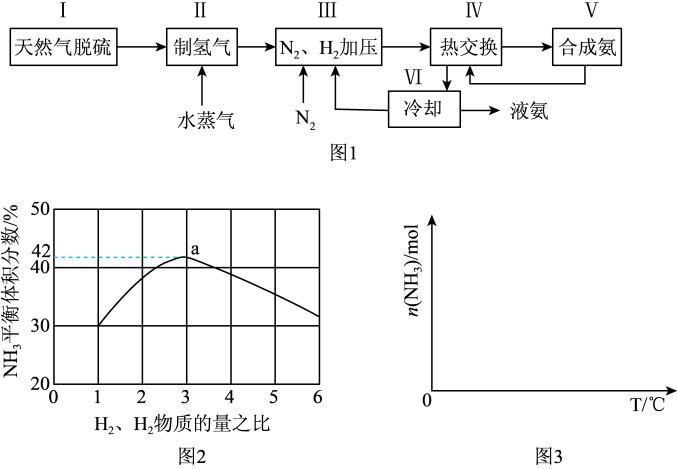
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___ 。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___ 。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___ 。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___ 。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___ (填序号),简述本流程中提高合成氨原料总转化率的方法:___ 。
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是
您最近半年使用:0次
2020-01-07更新
|
112次组卷
|
4卷引用:内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题
名校
10 . 一定温度下,反应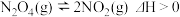 ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )
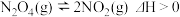 ,在密闭容器中达到平衡状态,下列说法正确的是( )
,在密闭容器中达到平衡状态,下列说法正确的是( )A.体积不变,加少许 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深 化学平衡正向移动,再达到平衡状态时与原平衡相比颜色变深 |
| B.加压时(体积变小),将使正反应速率增大,逆反应速率减慢 |
C.体积不变,加少许 ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅 ,化学平衡逆向移动,再达到平衡状态时与原平衡相比颜色变浅 |
| D.保持体积不变,升高温度,化学平衡正向移动,再达到平衡状态时混合气体密度变小 |
您最近半年使用:0次
2019-12-28更新
|
374次组卷
|
5卷引用:内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题
内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题江西省南昌市安义中学2020届高三上学期第五次月考化学试题2020届高考二轮复习《化学反应速率与化学平衡》专题卷(已下线)第六章 化学反应与能量(基础过关卷)-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)(已下线)期中01-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)



